转录因子Bach1对人微血管内皮细胞的作用研究*
2014-07-18刘俊许魏香香陈思锋
刘俊许, 蒋 丽, 魏香香, 牛 琮, 陈思锋, 孟 丹
(复旦大学基础医学院生理与病理生理学系,上海 200032)
转录因子Bach1对人微血管内皮细胞的作用研究*
刘俊许, 蒋 丽, 魏香香, 牛 琮, 陈思锋, 孟 丹△
(复旦大学基础医学院生理与病理生理学系,上海 200032)
目的: 研究转录因子Bach1对人微血管内皮细胞功能的影响。方法: 利用小干扰RNA(small interfering RNA,siRNA)细胞转染技术下调内皮细胞Bach1表达;用Matrigel管腔形成实验检测内皮细胞体外血管新生的能力;用Transwell小室法检测细胞迁移;用CCK-8法测定细胞增殖;用实时荧光定量PCR、Western blotting和ELISA法检测细胞中血红素氧合酶1(heme oxygenase 1,HO-1)和血管内皮细胞生长因子(vascular endothelial growth factor, VEGF)mRNA 和蛋白的表达情况;用转染报告基因的方法检测VEGF基因的转录活性。结果: 下调内皮细胞Bach1表达明显促进人微血管内皮细胞迁移和管腔形成能力,对内皮细胞增殖能力无明显影响;抑制Bach1表达促进内皮细胞HO-1 mRNA 和蛋白的表达,增加VEGF 转录活性及mRNA和蛋白的表达。结论: 抑制转录因子Bach1表达可增加内皮细胞HO-1和VEGF的表达,促进人微血管内皮细胞迁移和管腔形成,提示Bach1是负性调控血管新生的因子。
转录因子Bach1; 人微血管内皮细胞; 血管内皮细胞生长因子; 血红素氧合酶1; 细胞迁移
成人体内的血管新生(angiogenesis)是指从原有的血管通过发芽的方式长出原始的血管网络,包括血管周围基质的降解、内皮细胞的增殖、迁移和管状结构的形成;随后这一初级的毛细血管网被平滑肌细胞和周细胞等血管支持细胞包裹,逐步形成具有完整结构的成熟的血管。这些过程受到血管生成促进因子和抑制因子的调控。血管生成促进因子包括血管内皮细胞生长因子(vascular endothelial growth factor,VEGF)等[1]。
血管新生是由多种因子参与调控的复杂的病理生理过程,其中转录因子起着关键的调控作用。转录因子Bach1是一个转录抑制因子,属于碱性亮氨酸拉链蛋白家族成员。人的Bach1蛋白含736个氨基酸,分子量为92 kD[2]。在细胞没有受到外界刺激的状态下,转录因子Bach1在细胞核内与小Maf蛋白结合形成异二聚体,反式作用于抗氧化反应元件(anti-oxidative response element,ARE),抑制ARE介导的靶基因表达。红系衍生核因子相关因子-2(NF-E2-related factor 2,Nrf2)与Bach1之间存在相互竞争的关系。当细胞受到氧化应激刺激时,Bach1与ARE分离,而Nrf2与ARE结合, 增强抗氧化酶的表达[3]。Bach1调控的基因有血红素氧合酶-1(heme oxygenase-1, HO-1)、γ-谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase,γ-GCS)和谷胱甘肽S-转移酶(glutathione S-transferase,GST)等[4]。我们以往的研究发现,Bach1在人微血管内皮细胞中有较高表达[5],但是Bach1对血管新生的影响还不清楚。本文中我们研究了Bach1在人微血管内皮细胞迁移、增殖以及管腔形成能力中的作用及分子机制。
材 料 和 方 法
1 材料
EBM-2培养基购于Lonza;胎牛血清和Lipofectamine 2000购于Invitrogen;抗Bach1抗体、抗HO-1抗体和Bach1 siRNA 购于Santa Cruz;抗β-actin抗体购于Sigma;人VEGF酶联免疫吸附试剂盒购自欣博盛生物科技有限公司;SYBR Green 购于Bio-Rad;Matrigel购于BD;CCK-8试剂盒购自日本同仁化学研究所。
2 方法
2.1 人微血管内皮细胞培养 人微血管内皮细胞株(human microvascular endothelial cells,HMVECs)为美国马萨诸塞大学邵荣教授赠送[6],用含2%胎牛血清的EBM-2培养基,在37 ℃、 5% CO2培养箱中培养。
2.2 细胞转染 取对数生长期HMVECs,消化后种于6孔板。细胞分为未转染组(control)、转染对照siRNA组(Con si)和转染Bach1 siRNA(Bach1 si)组。未转染组加含血清的EBM-2培养基,转染组加终浓度为80 nmol/L的Bach1特异性小干扰RNA(上海吉玛制药技术有限公司),对照组加终浓度为80 nmol/L的阴性对照siRNA。用Lipofectamine 2000 转染细胞,步骤按试剂说明书进行。培养48 h后进行后续实验。
2.3 实时荧光定量PCR 收集细胞,采用Trizol法提取细胞总RNA。按照逆转录试剂盒(Fermentas)说明书采用随机引物进行逆转录合成cDNA。采用实时定量PCR试剂盒(Bio-Rad),以SYBR Green为荧光探针,在real-time analyzer(Bio-Rad)仪器上进行实时定量PCR反应并分析结果,以GAPDH作为内参照。Bach1 的上游引物为5’-CACAATTCTTCCATAGACCCTC-3’,下游引物为5’-TCTGCCACTTCTCGCTCC-3’;HO-1的上游引物为5’-TTTGAGGAGTTGCAGGAGC-3’,下游引物为5’-AGGACCCATCGGAGAAGC-3’;VEGF165的上游引物为5’-ATCTTCAAGCCATCCTGTGTGC-3’,下游引物为5’-CAAGGCCCACAGGGATTTTC-3’;GAPDH的上游引物为5’-CCATCTTCCAGGAGCGAGATC-3’,下游引物为5’-GCCTTCTCCATGGTGGTGAA-3’。实时定量PCR结果以2-ΔCt表示相对表达量,Ct为循环数,ΔCt为目的基因Ct值与内参照基因Ct值的差。每次实验重复3次。
2.4 蛋白免疫印迹 用RIPA裂解液裂解细胞30 min,4 ℃下 12 000×g离心10 min后取上清。用蛋白测定试剂盒检测蛋白浓度。蛋白上样量60 μg,加上样缓冲液,沸水中煮5 min。12% SDS-聚丙烯酰胺凝胶以100 V恒压电泳,经250 mA恒流湿转膜3h,将蛋白转移至PVDF膜(Millipore)。5%脱脂牛奶封闭1 h后分别加Bach1 (1∶500)、HO-1(1∶500)或β-actin(1∶4 000)抗体, 4 °C孵育过夜;TBST洗3次,加上辣根过氧化物酶HRP标记的Ⅱ抗(1∶3 000),室温孵育1 h 30 min,TBST洗4次后进行ECL显色发光。X光胶片用ImageJ图像分析软件进行蛋白定量分析,以目的蛋白与内参β-actin比值作相对量分析。每次实验重复3次。
2.5 内皮细胞管腔形成实验 参照我们实验室已有的方法[7],将转染Bach1 siRNA、对照siRNA 48 h或未转染的内皮细胞接种在铺有50 μL Matrigel的96孔板中(每组3复孔),细胞密度5×107cells/L,体积200 μL。放置37 ℃细胞培养箱中孵育,10 h后显微镜下随机选取5个视野进行拍照,用ImageJ软件计算管腔长度,每次试验重复3次。
2.6 细胞迁移实验 将转染Bach1 siRNA、对照siRNA 48 h或未转染的内皮细胞接种在Transwell上室中,细胞密度4×108cells/L,体积200 μL。在Transwell下室中加入2% FBS的培养基800 μL。放置37 ℃细胞培养箱中孵育,10 h后取出小室,用棉签擦去上层细胞,置于4% 预冷的多聚甲醛中固定10 min,0.1% 结晶紫染色30 min,PBS洗3遍,倒置显微镜下随机选取5个视野进行拍照并计数染色细胞,每次实验重复3次。
2.7 细胞增殖实验 将转染Bach1 siRNA、对照siRNA 48 h或未转染的内皮细胞接种在96孔板中,细胞密度3×108cells/L,体积200 μL。放置37 ℃细胞培养箱中孵育,不同时点后加入含CCK-8的培养液,CCK-8与培养液的体积比例为1∶ 10,放置37 ℃细胞培养箱中孵育2 h,在酶标仪上测定450 nm吸光度。每次实验重复3次。
2.8 报告基因萤光素酶检测 按照Invitrogen公司说明书,用Lipofectamine 2000转染细胞,将含有VEGF启动子片段(2.4 kb)的报告基因和β-半乳糖质粒,以及Bach1 siRNA或对照siRNA共转染到内皮细胞,以转染对照质粒pGL2为空白对照。转染48 h后收集细胞,制备细胞裂解物。按照萤光素酶报告基因分析系统的说明书,在萤光素酶报告分析仪上检测裂解物的荧光值。β-半乳糖酶活性的检测是将裂解物与β-半乳糖酶检测底物在37 °C孵育1 h,然后置于酶标仪上,在420 nm波长下测吸光度值。萤光素酶报告基因的荧光值与内参照β-半乳糖酶活性的比值即代表所检测的VEGF启动子片段的转录调控活性。每次实验重复3次。
2.9 酶联免疫吸附(ELISA)法检测培养上清中VEGF水平 内皮细胞转染Bach1 siRNA 或对照siRNA,48 h后收集培养上清,上清中VEGF的含量用人VEGF ELISA试剂盒检测,按照说明书步骤进行。通过VEGF的标准曲线计算上清中VEGF的含量,并用细胞蛋白含量作校正,以ng/g protein表示。每次实验重复3次。
3 统计学处理
数据以均数±标准差(mean±SD)表示。采用Prism 5.0统计软件进行分析,组间均数比较用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 Bach1表达下调促进内皮细胞官腔形成
Bach1 si组的Bach1 mRNA表达较Con si组降低66%(P<0.05),Bach1蛋白表达较Con si组降低50%(P<0.05),而Con si组与control组相比无明显差别,见图1。为了明确Bach1在体外血管新生中的作用,我们将Bach1表达下调的内皮细胞种在Matrigel上,观察Bach1对内皮细胞管腔形成能力的影响,发现抑制Bach1表达明显促进内皮细胞管腔状结构的形成(P<0.05),Con si组与control组管腔状结构的形成无明显差别,见图2。
2 Bach1表达下调促进内皮细胞的迁移,对细胞增殖无影响
Bach1 siRNA或对照siRNA转染内皮细胞48 h后,将内皮细胞接种在Transwell上,培养10 h后对迁移到膜下面的细胞进行计数。结果显示,Bach1表达下调明显促进内皮细胞的迁移能力(P<0.05),而Con si组与control组细胞迁移能力无明显差别,见图3。此外,我们用CCK-8的方法检测Bach1抑制对内皮细胞增殖的影响,结果发现,Bach1表达下调对内皮细胞的增殖无明显影响,见图4。

Figure 1.Bach1 siRNA inhibited Bach1 mRNA and protein expression in HMVECs. HMVECs were transfected with control siRNA(Con si) orBach1 siRNA (Bach1 si), and the untransfected cells were as the control. At 48 h, the cells were harvested for detecting the Bach1 mRNA level by real-time PCR (A) and Bach1 protein level by Western blotting (B). Mean±SD.n=3.**P<0.01vsCon si group.
图1Bach1 siRNA抑制人微血管内皮细胞Bach1 mRNA和蛋白的表达
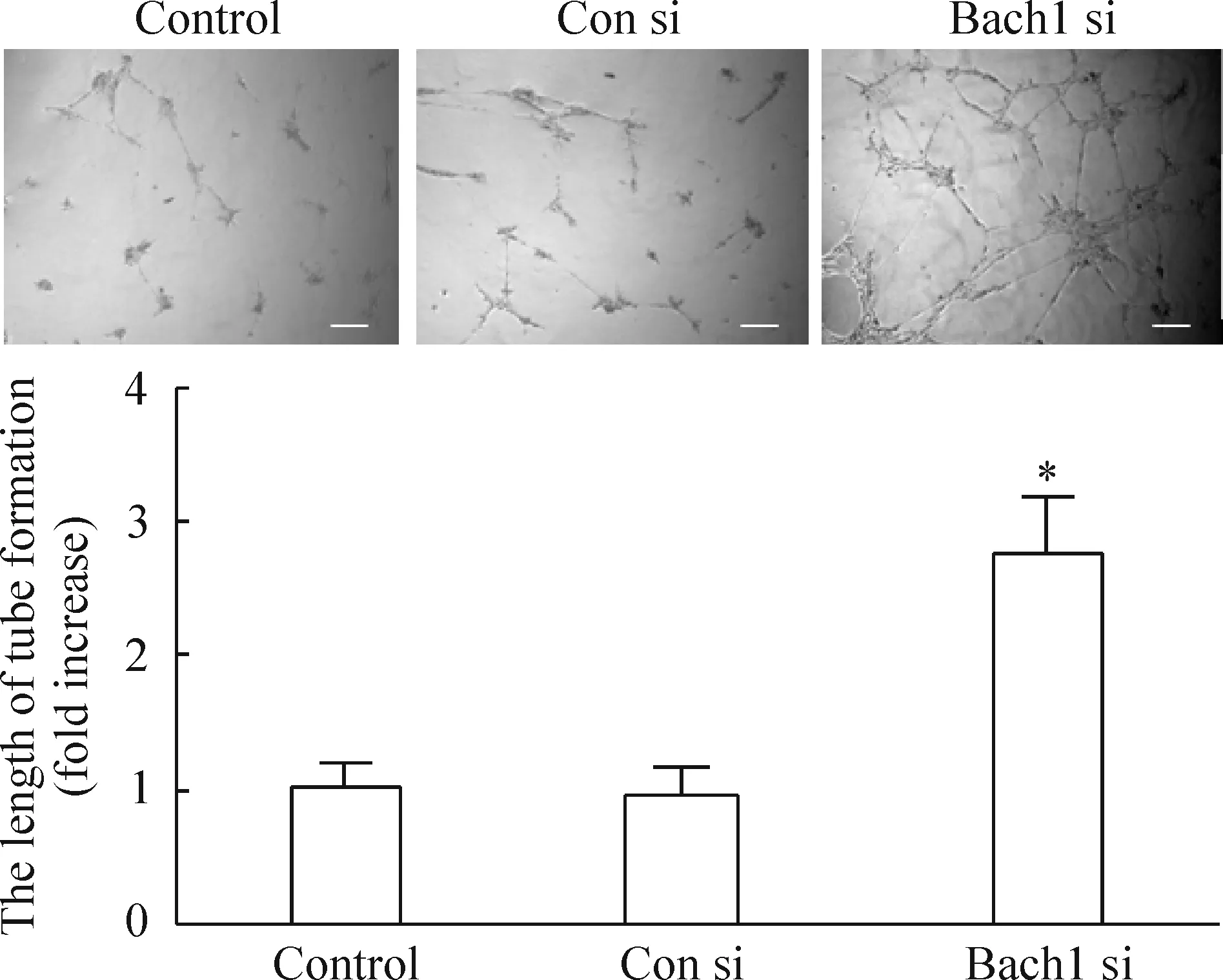
Figure 2.Knockdown ofBach1 expression promoted the tube formation in HMVECs. HMVECs transfected with control siRNA (Con si) orBach1 siRNA (Bach1 si) were seeded onto Matrigel and incubated for 10 h. The untransfected cells were as the negative control. relative tube lengths were normalized by the control. Scale bar=50 μm. Mean±SD.n=3.*P<0.05vsCon si group.
图2 Bach1表达下调促进内皮细胞管腔形成
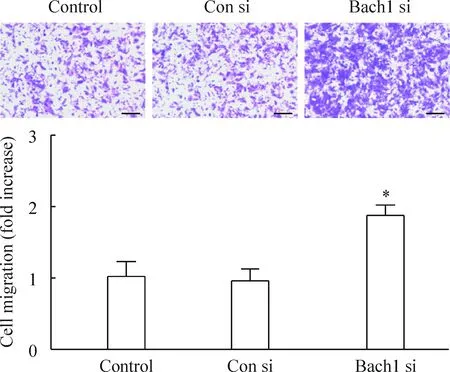
Figure 3.Knockdown ofBach1 expression enhanced endothelial cell migration. HMVECs were transfected with control siRNA (Con si) orBach1 siRNA (Bach1 si) for 48 h. Cell migration was measured by Transwell chamber. The data are expressed as the fold change relative to the control. Scale bar=100 μm. Mean±SD.n=3.*P<0.05vsCon si group.
图3 Bach1表达下调促进内皮细胞的迁移
3 Bach1表达下调增加内皮细胞HO-1 mRNA和蛋白的表达
抑制Bach1表达明显上调HO-1 mRNA的表达(P<0.05),增加HO-1蛋白的表达(P<0.05),见图5。
4 Bach1表达下调增加内皮细胞VEGF转录活性、mRNA和蛋白的表达
我们用Bach1 siRNA转染内皮细胞,观察Bach1表达下调对VEGF转录活性、mRNA和蛋白表达的影响。我们发现,抑制Bach1表达明显促进VEGF的转录激活(P<0.05),并增加内皮细胞VEGF mRNA表达及上清中VEGF蛋白的表达(P<0.05),见图6。

Figure 4.Knockdown ofBach1 expression had little effect on endothelial cell proliferation. HMVECs were transfected with control siRNA(Con si) orBach1 siRNA(Bach1 si) for 48 h. The untransfected cells were as the control. Cell proliferation was measured using CCK-8 assay. Mean±SD.n=3.
图4 Bach1表达下调对内皮细胞的增殖无影响
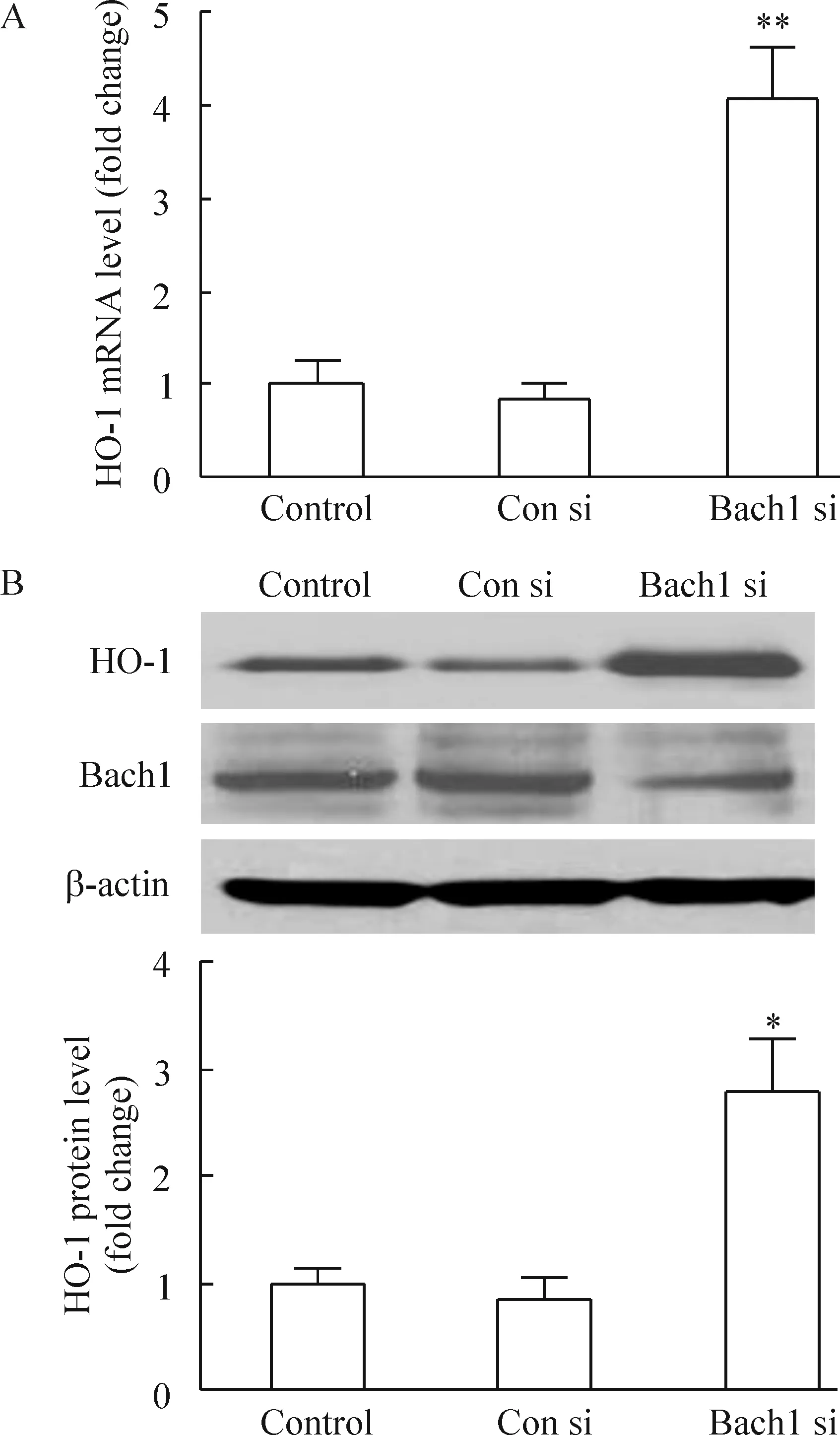
Figure 5.Bach1 silencing increased the mRNA and protein expression of HO-1. HMVECs were transfected with control siRNA(Con si) orBach1 siRNA(Bach1 si) for 48 h. The untransfected cells were as the negative control. A: HO-1 mRNA level was analyzed by real-time PCR;B: HO-1, Bach1, and β-actin protein levels were determined by Western blotting. Mean±SD.n=3.*P<0.05,**P<0.01vsCon si group.
图5 Bach1表达下调促进内皮细胞HO-1 mRNA和蛋白的表达
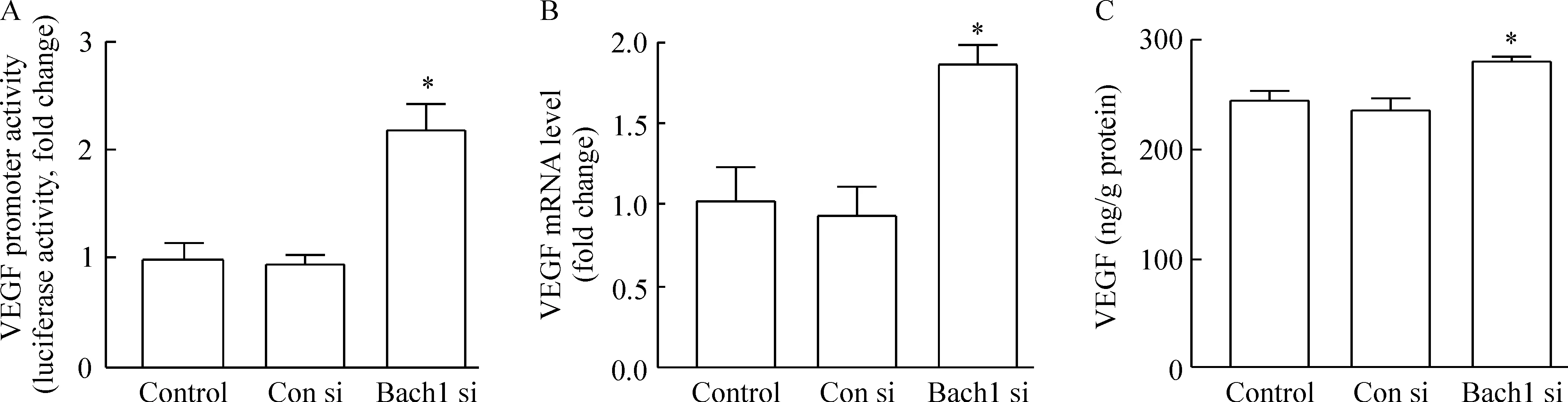
Figure 6.Bach1 silencing increased VEGF transcriptional activation, mRNA and protein expression in HMVECs. A: the relative luciferase activity was determined by the ratio of luciferase to β-galactosidase activity and normalized to the control; B: VEGF mRNA levels were determined by real-time PCR; C: the VEGF content in the supernatants was determined by ELISA. Mean±SD.n=3.*P<0.05vsCon si group.
图6 Bach1表达下调增加内皮细胞VEGF转录活性、mRNA和蛋白的表达
讨 论
近年来,促血管新生已成为治疗冠心病的一个新策略,是当前国际上的研究热点。因此,寻找促血管新生的关键分子靶点,已成为当前治疗性血管新生研究领域的中心焦点。本研究发现,抑制转录因子Bach1的表达可增加内皮细胞HO-1和VEGF的表达,促进人微血管内皮细胞迁移和管腔形成。这些结果提示Bach1是负性调控血管新生的因子。
Bach1是一个血红素结合蛋白,它结构高度保守,广泛存在于哺乳动物各种组织中。Bach1主要包含2个功能结构域:N端的BTB/POZ结构域,主要参与形成蛋白二聚体,与转录抑制有关;C端的亮氨酸拉链bZIP结构域,可与细胞核内小Maf蛋白形成异二聚体,在细胞核内与目的基因结合[3]。我们以往研究发现Bach1半胱氨酸残基557和574位点在Bach1的功能调节中起关键作用,砷可以通过氧化这些位点Bach1与ARE的解离,解除Bach1的转录抑制作用,促进HO-1的表达[5]。但是Bach1在血管新生中的作用以及调控机制还不十分清楚。本文研究证实抑制Bach1表达明显促进人微血管内皮细胞迁移以及管腔状结构的形成,提示Bach1是调控血管新生的负调控因子。Dohi等[8]发现,Bach1可以抑制氧化应激引起的p53依赖的细胞衰老。最近研究发现[9],Bach1参与调控氧化应激反应以及细胞周期,提示Bach1在细胞功能调控中发挥重要作用。Yano等[10]报道,Bach1基因缺乏可保护小鼠心肌缺血再灌注损伤,抑制Bach1使心肌细胞凋亡减少。Kondo等[11]研究发现,Bach1基因缺乏小鼠对氧化应激引起的胰岛β细胞损伤有保护作用。Hou等[12]也发现,HO-1的上调和Bach1的下调保护氧化应激引起的肝细胞损伤。这些研究表明Bach1基因缺乏对细胞损伤有保护作用,这与我们的研究结果是一致的,我们也证实Bach1基因下调促进内皮细胞的迁移,对内皮细胞管腔样结构的形成有促进作用。
本研究证实,下调内皮细胞Bach1表达促进内皮细胞HO-1 mRNA和蛋白的表达,增加VEGF 转录活性、mRNA和蛋白的表达。VEGF是目前被认为的最重要的促进血管生成的因子,其促进血管细胞的增殖和迁移,促进具有降解基膜作用的蛋白酶的释放,以及促进内皮细胞形成管腔[13-14]。大量动物实验和临床研究显示VEGF等促血管生长因子蛋白和基因应用于冠心病患者可增加缺血心肌灌注、减小梗死面积、改善心功能[15]。以往研究表明,HO-1是重要的VEGF转录调控蛋白,HO-1表达增高促进VEGF高表达。此外,HO-1还可以催化血红素降解生成胆红素, 一氧化碳和Fe2+,这些产物具有抗氧化损伤、抗炎、抗凋亡和抗增殖等作用,HO-1在许多疾病中起着重要的保护作用[16-18]。因此我们推测Bach1很可能通过影响HO-1蛋白的表达,调节VEGF的转录活性以及mRNA和蛋白表达,进而影响血管新生。此外,我们发现,Bach1基因下调对内皮细胞的增殖影响不大,其中的机制不十分清楚,还有待进一步研究。
总之,本研究证实,抑制转录因子Bach1表达增加内皮细胞HO-1和VEGF的表达,促进人微血管内皮细胞迁移和管腔形成。这项研究为阐明Bach1调控血管新生的作用和分子机制提供了理论依据,并为临床寻找有效的血管新生干预靶点提供了新的思路。
[1] Yla-Herttuala S. Cardiovascular gene therapy with vascular endothelial growth factors [J]. Gene, 2013, 525(2):217-219.
[2] Li J, Shiraki T, Igarashi K. Bach1 as a regulator of mitosis, beyond its transcriptional function [J]. Commun Integr Biol, 2012, 5(5):477-479.
[3] Okita Y, Kamoshida A, Suzuki H, et al. Transforming growth factor-beta induces transcription factors MafK and Bach1 to suppress expression of the heme oxygenase-1 gene[J]. J Biol Chem, 2013, 288(28):20658-20667.
[4] Niture SK, Khatri R, Jaiswal AK. Regulation of Nrf2-an update[J]. Free Radic Biol Med, 2014, 66(1):36-44.
[5] Meng D, Wang X, Chang Q, et al. Arsenic promotes angiogenesisinvitrovia a heme oxygenase-1-dependent mechanism[J]. Toxicol Appl Pharmacol, 2010, 244(3):291-299.
[6] Shao R, Guo X. Human microvascular endothelial cells immortalized with human telomerase catalytic protein: a model for the study ofinvitroangiogenesis[J]. Biochem Biophys Res Commun, 2004, 321(4):788-794.
[7] Meng D, Mei A, Liu J, et al. NADPH oxidase 4 mediates insulin-stimulated HIF-1alpha and VEGF expression, and angiogenesisinvitro[J]. PLoS One, 2012, 7(10):e48393.
[8] Dohi Y, Ikura T, Hoshikawa Y, et al. Bach1 inhibits oxidative stress-induced cellular senescence by impeding p53 function on chromatin[J]. Nat Struct Mol Biol, 2008, 15(12):1246-1254.
[9] Warnatz HJ, Schmidt D, Manke T, et al. The BTB and CNC homology 1 (BACH1) target genes are involved in the oxidative stress response and in control of the cell cycle[J]. J Biol Chem, 2011, 286(26):23521-23532.
[10]Yano Y, Ozono R, Oishi Y, et al. Genetic ablation of the transcription repressor Bach1 leads to myocardial protection against ischemia/reperfusion in mice[J]. Genes Cells, 2006, 11(7):791-803.
[11]Kondo K, Ishigaki Y, Gao J, et al. Bach1 deficiency protects pancreatic beta-cells from oxidative stress injury[J]. Am J Physiol Endocrinol Metab, 2013, 305(5):E641-E648.
[12]Hou W, Tian Q, Steuerwald NM, et al. The let-7 microRNA enhances heme oxygenase-1 by suppressing Bach1 and attenuates oxidant injury in human hepatocytes[J]. Biochim Biophys Acta, 2012, 1819(11-12):1113-1122.
[13]Greenberg DA, Jin K. Vascular endothelial growth factors (VEGFs) and stroke [J]. Cell Mol Life Sci, 2013, 70(10):1753-1761.
[14]梅爱红,刘俊许,陈思锋,等. 胰岛素通过活性氧的产生促进VEGF表达及血管平滑肌细胞迁移和增殖[J]. 中国病理生理杂志, 2013, 29(2):272-277.
[15]Graupera M, Potente M. Regulation of angiogenesis by PI3K signaling networks[J]. Exp Cell Res, 2013, 319(9):1348-1355.
[16]Araujo JA. HO-1 and CO: fighters vs sickle cell disease?[J]. Blood, 2013, 122(15):2535-2536.
[17]喻守佳,王海英,喻 田,等. Nrf2-ARE通路在缺氧/吡那地尔后处理减轻大鼠心肌细胞缺氧复氧损伤中的作用[J]. 中国病理生理杂志, 2013, 29(9):1696-1699,1703.
[18]吴 露,黄小平,邓常清,等. 人参皂苷Rg1对小鼠脑缺血再灌注后脑组织损伤及Nrf2/HO-1途径的影响[J]. 中国病理生理杂志, 2013, 29(11):2066-2071.
Roles of transcription factor Bach1 in human microvascular endothelial cell function
LIU Jun-xu, JIANG Li, WEI Xiang-xiang, NIU Cong, CHEN Si-feng, MENG Dan
(DepartmentofPhysiologyandPathophysiology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai200032,China.E-mail:dmeng@fudan.edu.cn)
AIM: To determine the role of transcription factor Bach1 in the functions of human microvascular endothelial cells (HMVECs). METHODS:Bach1 siRNA was transfected into HMVECs to knock down the expression ofBach1.Invitroendothelial cell tube formation assay in Matrigel culture was used as a surrogate assay for angiogenic potential. Migration of HMVECs was determined by using Transwell chambers. Cell proliferation was measured by CCK-8 assay. Real-time PCR, Western blotting, and ELISA were employed to determine mRNA expression and protein level. Reporter assay was performed to determine vascular endothelial growth factor (VEGF) transcriptional activity. RESULTS: Knockdown ofBach1 expression in HMVECs led to an increase in the tube formation and increased endothelial cell migration ability, whereas it has little effect on cell proliferation.Bach1 silencing increased the mRNA and protein expression of heme oxygenase-1 (HO-1), and enhanced VEGF transcriptional activation, and mRNA and protein expression.CONCLUSION:Bach1 silencing increases HO-1 and VEGF expression, thus promoting the cell migration and tube formation of HMVECs, indicating that Bach1 is a repressor for angiogenesis.
Transcription factor Bach1; Human microvascular endothelial cells; Vascular endothelial growth factor; Heme oxygenase-1; Cell migration
1000- 4718(2014)12- 2195- 06
2014- 08- 26
2014- 09- 13
国家自然科学基金资助项目(No.81170298; No.81270410); 国家基础科学人才培养基金资助项目(No.J1210041); 上海市卫生局科研项目(No.c106629)
R363.2
A
10.3969/j.issn.1000- 4718.2014.12.014
△通讯作者 Tel: 021-54237392; E-mail: dmeng@fudan.edu.cn
