舒林酸对丙戊酸孤独症动物模型大鼠氧化应激变化的影响*
2014-07-18张应花杨彩玲崔卫刚王中平文小军李瑞锡
张应花, 杨彩玲, 崔卫刚, 王中平, 文小军, 李瑞锡
(1新乡医学院解剖教研室,河南 新乡 453003; 2新乡医学院第一附属医院口腔颌面外科,河南 卫辉 453100;3复旦大学上海医学院人体解剖与组织胚胎学系,上海 200032; 4九江学院基础医学院生理学与病理生理学教研室,江西 九江 332000)
舒林酸对丙戊酸孤独症动物模型大鼠氧化应激变化的影响*
张应花1△, 杨彩玲2, 崔卫刚3, 1, 王中平3, 4, 文小军1, 李瑞锡3
(1新乡医学院解剖教研室,河南 新乡 453003;2新乡医学院第一附属医院口腔颌面外科,河南 卫辉 453100;3复旦大学上海医学院人体解剖与组织胚胎学系,上海 200032;4九江学院基础医学院生理学与病理生理学教研室,江西 九江 332000)
目的: 探讨舒林酸对孤独症发生过程中氧化应激变化的影响。方法: 利用丙戊酸(VPA)孤独症动物模型,检测经典Wnt信号通路特异性抑制剂舒林酸处理后经典Wnt信号通路及氧化应激标志物在孤独症模型大鼠前额叶皮质及海马脑区的表达变化。Western blotting法检测糖原合成激酶3β(GSK-3β)、β-catenin和4-羟基壬烯醛(4-HNE)表达,半定量RT-PCR法检测硫氧还蛋白(Trx)1和Trx2 mRNA表达。结果: 与对照组相比,在前额叶皮质及海马脑区VPA组GSK-3β蛋白表达减少,Trx1和Trx mRNA 表达减少,β-catenin与4-HNE的表达增加;而与VPA组相比,VPA与舒林酸同时处理组GSK-3β的表达显著增加,β-catenin和4-HNE的表达显著减少。结论: 舒林酸减少了孤独症发生过程中氧化应激的产生,提示经典Wnt信号通路上调导致氧化应激产生,进而导致孤独症易感性增加。
孤独症; Wnt/β-catenin通路; 丙戊酸; 舒林酸; 氧化应激
孤独症(autism)是一种严重的神经发育障碍性疾病。多数患儿有明显的语言交流艰难、社会交往障碍和重复刻板行为三大核心表现,临床上称为“Kanner三联征”。然而,目前孤独症的病因尚不清楚,对其发生、发展机制知之甚少。据报道,孤独症发生可能与 Wnt 信号通路传导异常有关。敲除了该通路信号分子Dvl1 基因的小鼠表现出孤独症样的社会行为异常,提示Wnt信号通路可能与孤独症发病有关[1]。近年来,我们课题组检测到孤独症模型大鼠存在 Wnt信号通路中关键信号蛋白表达异常[2-3],同时采用表观遗传学技术研究发现,孤独症大鼠动物模型脑内存在去甲基化水平升高[2],提示 Wnt信号通路机能亢进。Wnt信号通路下调可以导致神经元凋亡[4],而Wnt信号通路上调可诱导细胞增殖[5],进而可导致巨大脑和脑皮质容量增加,这可能与孤独症脑早期的过度增生有关。以上这些资料表明孤独症发生与经典Wnt信号通路传导异常有关。
近年来研究显示孤独症患者存在氧化稳态的异常[6-7]。氧化应激是由自由基在体内产生的一种负面作用,是导致孤独症患者脑区蒲肯野细胞缺失和存在其它神经解剖学异常的一个重要因素[8]。Wnt 信号通路与氧化应激是否存在关联呢?Wnt 信号通路的一个分泌性抑制剂DKK1高表达可以减少类脂的聚集[9],增加氧化应激产生的活性氧(reactive oxygen species,ROS)水平[10]。乙醇可以诱导产生氧化应激,导致 Wnt 信号通路许多组成分子下调;但是与抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine, NAC) 共处理以后,乙醇的上述作用被减弱[11]。这就提示乙醇诱导氧化应激是通过下调Wnt信号通路发挥作用的。在孤独症发生过程中Wnt信号通路与氧化应激的关系如何呢?丙戊酸(valproic acid,VPA)作为一种环境因素,导致子代孤独症的发生,这是否与调控个体发育的经典Wnt信号通路传导障碍,进而诱导氧化稳态的异常从而导致孤独症的发生有关呢?因此,本研究旨在探索孤独症发生过程中经典Wnt信号通路与氧化应激的关系,揭示孤独症发生的可能机制。
材 料 和 方 法
1 实验动物和材料
健康成年 Wistar 雄性(300~350 g)及雌性(200~250 g)大鼠,购自中国科学院(上海)实验动物部,饲养于复旦大学人体解剖与组织胚胎学系专用动物房,给予充分的饲料和饮水。所有实验动物喂养及实验程序均严格遵照复旦大学实验动物保护条款。
VPA和舒林酸(sulindac)购自Sigma;兔抗糖原合成激酶3β(glycogen synthase kinase 3β, GSK-3β)抗体购于Cell Signaling Technology;兔抗β-catenin抗体购于Santa Cruz;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG购于Jackson;小鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)单克隆抗体、蛋白酶抑制剂购于康成公司;cDNA逆转录试剂盒购自TaKaRa;2× PCR Mix购自Invitrogen。引物由上海生工生物技术服务有限公司合成。
2 方法
2.1 孤独症大鼠模型建立及实验分组 实验前大鼠在周期性光照(7:00 AM~7:00 PM)、恒温25 °C和恒湿55%条件下饲养1周,使之适应环境。然后,按雌∶雄 2∶1 合笼过夜。第二天早晨,检查到阴栓的雌鼠记为胚胎第1 天(embryoic day 1,E1),然后受孕鼠分笼单独饲养。将受孕母鼠随机分成3组:模型组(VPA组)5只,在E12.5时给予母鼠腹腔注射600 mg/kg VPA;处理组(VPA+sulindac组)6只,在母鼠注射VPA后30 min给予5 mg/kg舒林酸;对照组(control组)4只,给予母鼠注射同等量的生理盐水。各组母鼠产下的幼鼠,按照与母鼠对应的分组各取8只。
2.2 孤独症模型动物生长发育和行为学检测 参照 Schneider 等[12]所建立的方法并稍作改进,模型组和对照组幼鼠各6只进行生长发育与行为学检测。观察幼鼠出生后12、13、14、15和16 d的睁眼情况(0分:2只眼睛均未睁;1分:1只眼睛睁开;2分:2只眼睛都睁开)。出生后9、11、13和15 d的幼鼠进行游泳测验,把幼鼠逐个单独放于28 °C的恒温槽中央,观察5~10 s,根据动物耳朵与头顶部处于水面的位置评分(0分:头顶和鼻子都在水面以下;1分:鼻子在水面以下,头顶在水面以上;2分:鼻子和头顶在水面以上或者与水面平齐而双耳在水面以下;3分:鼻子和头顶的位置与2分标准相同,但水位线在耳朵中间;4分:鼻子和头顶的位置与2分标准相同,要求水位线在耳朵以下)。
2.3 半定量RT-PCR检测硫氧还蛋白(thioredoxin,Trx)1和Trx2 mRNA水平的表达 用Trizol提取大鼠前额叶皮质(prefrontal cortex,PFC)及海马(hippocampus,HC)脑组织总RNA。A260/A280比值在1.8~2.0之间。根据大鼠GenBank的基因序列使用Primer Design软件进行引物设计。具体序列如下:Trx1的上游引物为5’-TTCTTTCATTCCCTCTGTG-3’,下游引物为5’-TCCGTAATAGTGGCTTCG-3’;Trx2的上游引物为5’-GGGCTTCCCTCACCTCTA-3’, 下游引物为5’-TGTTTGGCTACCATCTTCTC-3’;GAPDH的上游引物为5’-TATCGGACGCCTGGTTAC-3’, 下游引物为5’-TGCTGACAATCTTGAGGGA-3’。RT-PCR按照说明书进行操作;反应条件为:95 °C 5 min,然后95 °C 30 s,57 °C 30 s,72 °C 30 s,扩增30循环,最后72 °C 10 min。PCR产物用1.5%琼脂糖凝胶电泳分离,在Runone DNA电泳系统中进行,用数字成像系统分析图像,以目的基因灰度与内参基因灰度比值代表目的基因的相对表达量。
2.4 Western blotting检测GSK-3β、β-catenin和4-羟基壬烯醛(4-hydroxynonenal,4-HNE)的表达 处理组、模型组和对照组冰上取全脑并分离出PFC及HC,用蛋白裂解液提取相应组织总蛋白质,用BCA法测定样品的蛋白浓度。加入5×上样缓冲液后,100 °C加热变性3 min。用12% 十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)中分离蛋白,后转移到膜上,5%牛血清白蛋白TBST摇床常温封闭2 h。加I抗,4 °C摇床过夜;加II抗和GAPDH摇床常温2 h,ECL发光显色,然后将PVDF膜置于Bio-Rad的显影机上,获取反应条带的数字图并将条带进行灰度测定,以目的蛋白和内参照GAPDH蛋白的灰度比值代表目的蛋白的相对表达量。
3 统计学处理
计量数据用均数±标准差(mean±SD)表示,用 SPSS 16.0统计软件进行分析,分别对4-HNE及Trx1、Trx2 的mRNA在模型组和对照组中的相对表达定量值采用t检验,GSK-3β、β-catenin和4-HNE在处理组、模型组和对照组3组蛋白相对表达量比较采用单因素方差分析(ANOVA),进一步两两比较采用LSD法。以P<0.05为差异有统计学意义。
结 果
1 孤独症模型动物生长发育及行为学检测比较
睁眼情况评分显示,睁眼时间有显著差异(P<0.01);其中模型组较对照组睁眼时间晚,模型组与对照组相比,在出生后 13 d差异有统计学意义,出生后12、14、15 和16 d无显著差异。游泳行为测试结果显示,游泳评分有显著差异(P<0.05);其中模型组大鼠的游泳能力比对照组明显低下,在出生后9和11 d差异有统计学意义(P<0.01);至出生后13 d,能力有所提高,但与对照组相比差异无统计学意义;而发育到出生后15 d,游泳能力进一步提高,见表1。上述结果表明,以这些模型动物为实验对象,做后续实验是可靠的。
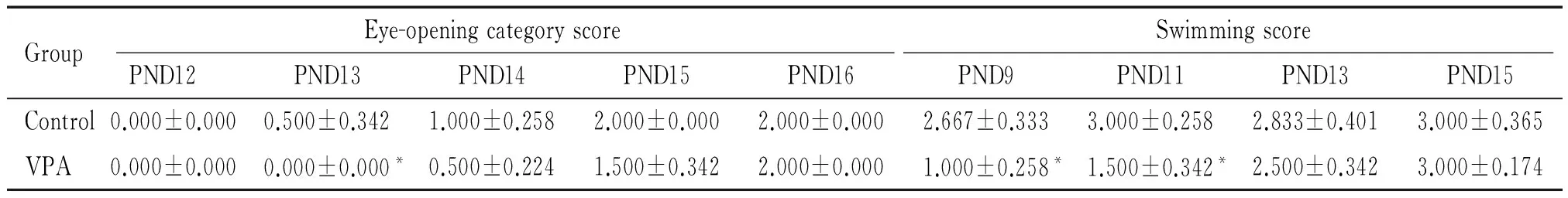
表1 孤独症模型睁眼和方位趋向感觉发育情况评估
PND:postnatal day.*P<0.05vscontrol.
2 孤独症大鼠氧化应激标志物4-HNE、Trx1和Trx2的表达变化
模型组PFC及HC组织的4-HNE蛋白表达高于对照组(P<0.05);而模型组Trx1和Trx2 mRNA的表达低于对照组,差异均有统计学意义,见图1、2和表2。
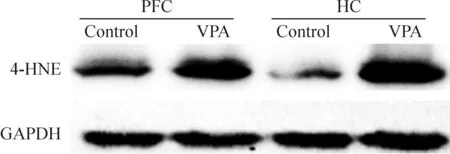
Figure 1.The protein expression of 4-HNE in PFC and HC tissues of control and autism rats.
图1 4-HNE在模型鼠与对照组大鼠PFC及HC脑区中的表达
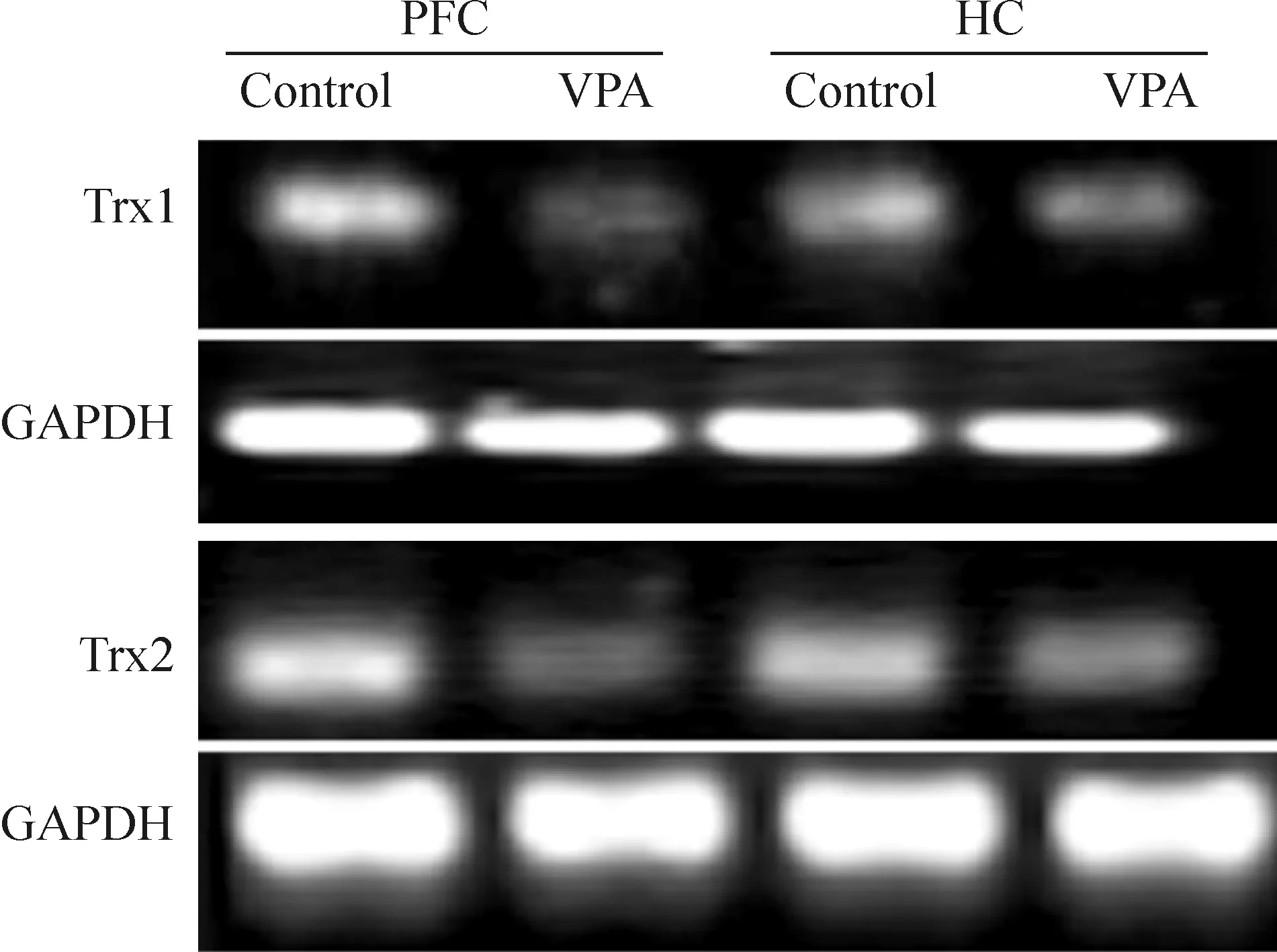
Figure 2.The mRNA expression of Trx1 and Trx2 in PFC and HC tissues of control and autism rats.
图2 Trx1及Trx2的mRNA在模型鼠与对照组大鼠PFC及HC脑区的表达
TableP<0.05vscontrol.
3 舒林酸处理后孤独症大鼠经典Wnt信号通路的变化
Western blotting结果显示,3组PFC及HC组织的GSK-3β蛋白表达有显著差异,其中处理组高于模型组,差异均有统计学意义,模型组GSK-3β蛋白的表达低于对照组,差异有统计学意义。3组PFC及HC组织的β-catenin蛋白表达有显著差异,处理组低于模型组,差异有统计学意义,而模型组高于对照组,差异有统计学意义,见图3、表3。
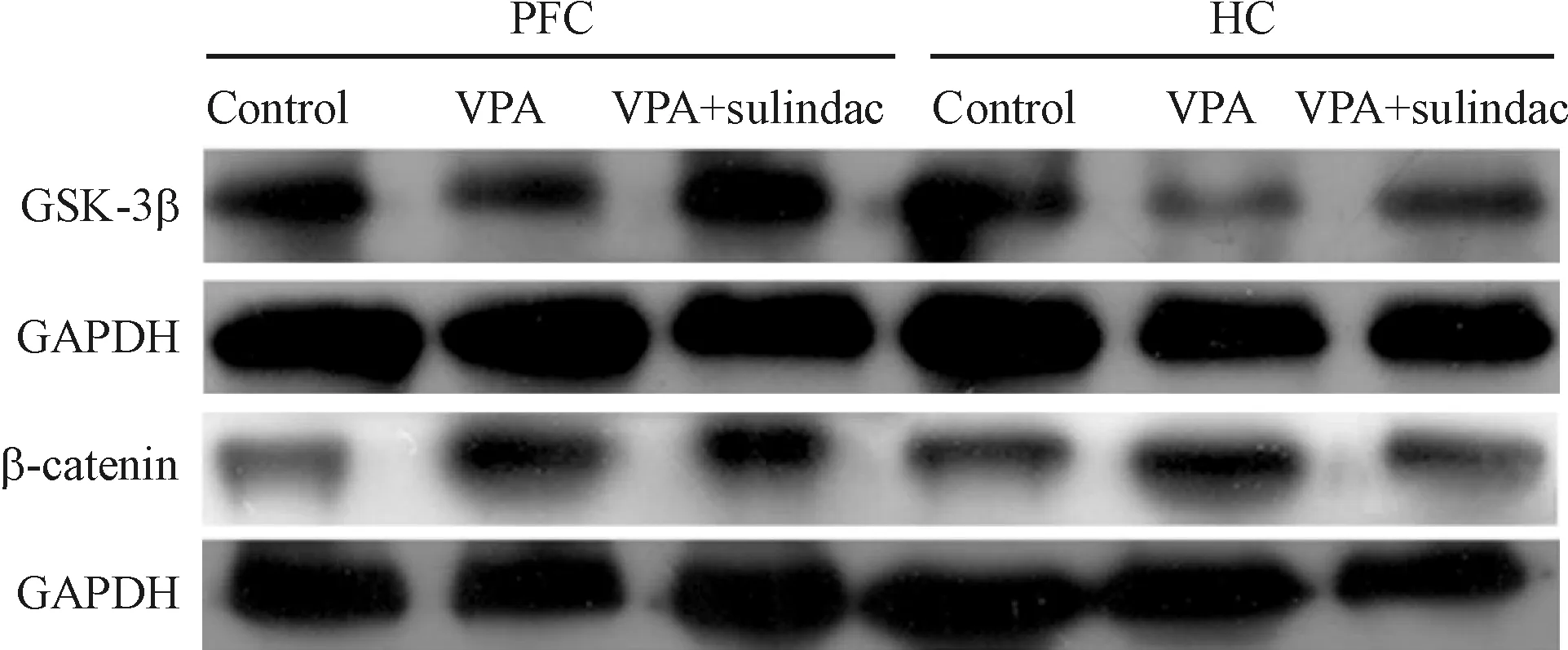
Figure 3.The protein expression of GSK-3β and β-catenin in PFC and HC in the rats of 3 groups.
图3 GSK-3β及β-catenin 蛋白在处理组、模型组与对照组大鼠PFC及HC脑区表达的变化
4 舒林酸处理后孤独症大鼠氧化应激的变化
结果显示,3组PFC及HC组织4-HNE的表达有显著差异,其中处理组低于模型组,而4-HNE的表达模型组高于对照组(均P<0.05),见图4、表3。
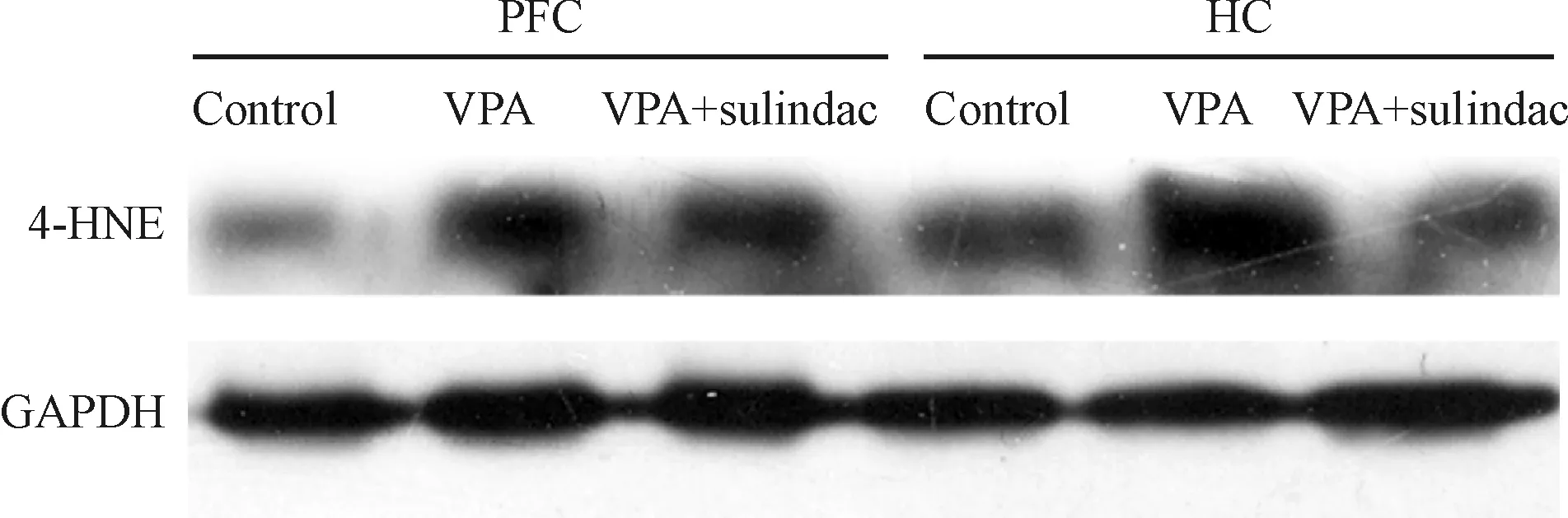
Figure 4.The expression of 4-HNE in PFC and HC of the rats in 3 groups.
图4 Sulindac处理后4-HNE在三组大鼠PFC及HC脑区中的表达
讨 论
本实验研究发现,舒林酸处理后经典Wnt通路功能减弱,基于GSK-3β 表达增加,β-catenin表达减少。舒林酸下调经典Wnt信号通路活性同时,氧化应激标志物4-HNE表达减少。这些结果表明舒林酸减少孤独症发生过程中氧化应激的产生,提示经典Wnt信号通路上调导致氧化应激产生,进而可能导致孤独症易感性增加。出生前或出生后环境因素,如VPA暴露可能会引起ROS产生[8]。ROS会干扰神经发育进程,或者导致神经中枢损伤,可能会导致行为学出现异常。这也暗示人体,特别是遗传易感儿童发育关键时期环境毒物,如VPA暴露导致遗传改变的可能机制就是氧化应激的存在。本研究结果显示,VPA孤独症模型动物的确存在氧化应激,基于4-HNE产生增加及Trx1、Trx2 的mRNA表达减少。但是有报道指出VPA并不影响氧化DNA损伤标志物8-OHdG、蛋白硝基化作用标记物3-NT和4-HNE的表达[13],这与本实验结果并不一致。可能是由于使用的VPA浓度不同,或者与分布结构对氧化应激是否敏感有关。减少氧化应激可能可以预防或至少减缓孤独症的发生。但是因为氧化应激在许多病理情况下都存在,所以孤独症的发生可能是由于其它参与该病发生的因素,如经典Wnt信号通路对氧化应激作用所导致的。的确,本实验结果显示,舒林酸作为经典Wnt信号通路的特异性抑制剂[14],下调经典Wnt信号通路的同时,减少氧化应激产生,这可能与其具有减少细胞色素P450、具有抗氧化性质有关[15]。
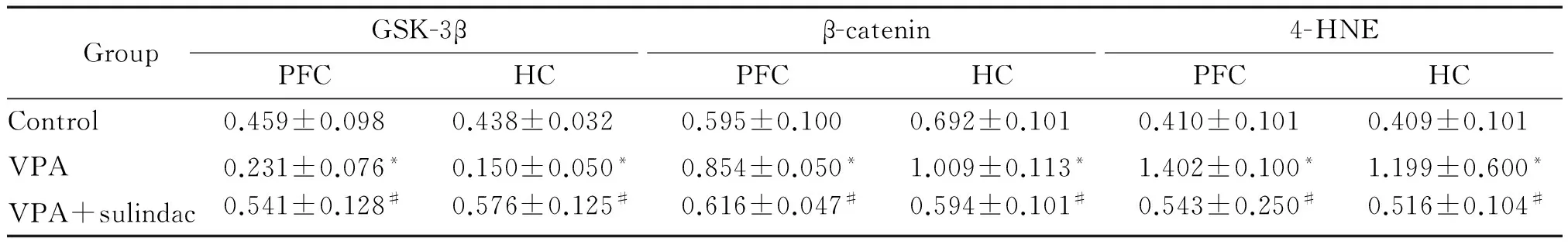
表3 GSK-3β、β-catenin和4-HNE蛋白在大鼠PFC及HC脑区的表达
TableP<0.05vscontrol;#P<0.05vsVPA.
综上所述,经典Wnt信号通路特异性抑制剂舒林酸能减少氧化应激发生,这就提示经典Wnt信号通路诱导氧化应激的发生可能导致患孤独症易感性增加,同时也提示舒林酸的抗氧化性质有可能对孤独症的产生有预防作用。鉴于动物模型的局限性,该结论扩展到孤独症患者需谨慎。而且对于神经发育障碍性疾病孤独症来说,探讨不同年龄阶段使用舒林酸对其氧化应激的影响可能较一个横断面的研究更有意义,尤其利用孤独症模型动物在早期干预期进行相关研究,可能更有临床意义。
[1] Lijam N,Paylor R, McDonald MP, et al. Social interaction and sensorimotor gating abnormalities in mice lacking Dvl1[J]. Cell, 1997, 90(5):895-905.
[2] Wang Z, Xu L, Zhu X, et al. Demethylation of specific Wnt/beta-catenin pathway genes and its upregulation in rat brain induced by prenatal valproate exposure[J]. Anat Rec (Hoboken), 2010, 293(11):1947-1953.
[3] Zhang Y, Sun Y, Wang F, et al. Downregulating the canonical Wnt/beta-catenin signaling pathway attenuates the susceptibility to autism-like phenotypes by decreasing oxidative stress[J]. Neurochem Res, 2012, 37(7):1409-1419.
[4] 杨 雁, 张晓洁, 王玉萍, 等. 噻唑烷二酮通过Wnt通路改善2型糖尿病大鼠海马阿尔茨海默病样病变[J]. 中国病理生理杂志, 2010, 26(12):2421-2427.
[5] 李海英, 张 力, 潘欢乐, 等. Wnt信号通路在食管癌细胞放射抗拒性形成中的作用[J]. 中国病理生理杂志, 2012, 28(9):1623-1626.
[6] Ghezzo A, Visconti P, Abruzzo PM, et al. Oxidative stress and erythrocyte membrane alterations in children with autism: correlation with clinical features[J]. PLoS One, 2013, 8(6):e66418.
[7] Gu F, Chauhan V, Kaur K, et al. Alterations in mitochondrial DNA copy number and the activities of electron transport chain complexes and pyruvate dehydrogenase in the frontal cortex from subjects with autism[J]. Transl Psychiatry, 2013, 3:e299.
[8] Sandhya T, Sowjanya J, Veeresh B.Bacopamonniera(L.) Wettst ameliorates behavioral alterations and oxidative markers in sodium valproate induced autism in rats[J]. Neurochem Res, 2012, 37(5):1121-1131.
[9] Strakovsky RS, Pan YX. A decrease in DKK1, a WNT inhibitor, contributes to placental lipid accumulation in an obesity-prone rat model[J]. Biol Reprod, 2012, 86(3):81.
[10]Park JW, Kuehn HS, Kim SY, et al. Downregulation of Wnt-mediated ROS generation is causally implicated in leprechaunism[J]. Mol Cells, 2010, 29(1):63-69.
[11]Chen JR, Lazarenko OP, Shankar K, et al. A role for ethanol-induced oxidative stress in controlling lineage commitment of mesenchymal stromal cells through inhibition of Wnt/beta-catenin signaling[J]. J Bone Miner Res, 2010, 25(5):1117-1127.
[12]Schneider T, Turczak J, Przewlocki R. Environmental enrichment reverses behavioral alterations in rats prenatally exposed to valproic acid: issues for a therapeutic approach in autism[J]. Neuropsychopharmacology, 2006, 31(1):36-46.
[13]Tung EW, Winn L. Valproic acid increases formation of reactive oxygen species and induces apoptosis in postimplantation embryos: a role for oxidative stress in valproic acid-induced neural tube defects[J]. Mol Pharmacol, 2011, 80(6):979-987.
[14]Huang Y, Chang X, Lee J, et al. Cigarette smoke induces promoter methylation of single-stranded DNA-binding protein 2 in human esophageal squamous cell carcinoma[J]. Int J Cancer, 2011, 128(10):2261-2273.
[15]Bass SE, Sienkiewicz P, Macdonald CJ, et al. Novel dithiolethione-modified nonsteroidal anti-inflammatory drugs in human hepatoma HepG2 and colon LS180 cells[J]. Clin Cancer Res, 2009, 15(6):1964-1972.
Effects of sulindac on oxidative stress in an autistic model induced by prenatal exposure to valproic acid
ZHANG Ying-hua1, YANG Cai-ling2, CUI Wei-gang3, 1, WANG Zhong-ping3, 4, WEN Xiao-jun1, LI Rui-xi3
(1DepartmentofHumanAnatomy,XinxiangMedicalUniversity,Xinxiang453003,China;2DepartmentofOralandMaxillofacialSurgery,TheFirstAffiliatedHospital,XinxiangMedicalUniversity,Weihui453100,China;3DepartmentofAnatomy,HistologyandEmbryology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China;4DepartmentofPhysio-logyandPathophysiology,SchoolofBasicMedicalSciences,JiujiangUniversity,Jiujiang332000,China.E-mail:zyhflo2013@163.com)
AIM: To investigate the effects of sulindac on oxidative stress in autism. METHODS: With an autistic model induced by prenatal exposure to valproic acid (VPA), we detected the expression of the signaling molecules of canonical Wnt pathway in the prefrontal cortex (PFC) and hippocampus (HC) of autistic rats treated with sulindac. The protein expression levels of glycogen synthase kinase 3β (GSK-3β), β-catenin and 4-hydroxynonenal (4-HNE) were observed by Western blotting. The mRNA expression of thioredoxin(Trx)1 and Trx2 was assessed by semi-quantitative RT-PCR.RESULTS: The protein level of GSK-3β and mRNA levels of Trx1 and Trx2 were lower, whereas the protein expression levels of β-catenin and 4-HNE were higher in VPA group than those in control group. In contrast, the protein levels of GSK-3β were significantly higher in the animals treated with both VPA and sulindac than those in VPA group, while the levels of β-catenin and 4-HNE were decreased.CONCLUSION: Sulindac attenuates oxidative stress in the pathogenesis of autism, suggesting the up-regulation of the Wnt/β-catenin signaling pathway disrupts oxidative homeostasis and further facilitates susceptibility to autism.
Autism; Wnt/β-catenin pathway; Valproic acid; Sulindac; Oxidative stress
1000- 4718(2014)12- 2161- 05
2014- 07- 04
2014- 09- 09
国家自然科学基金资助项目(No.81301174; No.81260211);新乡医学院博士科研启动基金资助项目(No.505003)
R363.1
A
10.3969/j.issn.1000- 4718.2014.12.008
△通讯作者 Tel: 0373-3029051; E-mail: zyhflo2013@163.com
