丹参酮IIA对低氧条件下人肝癌HepG2细胞增殖、凋亡的影响及与HIF-1α、VEGF和野生型P53蛋白表达的关系*
2014-07-18刘丽璇吴灵飞周小涛陈锐沛项梦琦郭益添蒲泽锦李国平
刘丽璇, 吴灵飞, 邓 巍, 周小涛, 陈锐沛, 项梦琦, 郭益添, 蒲泽锦, 李国平
(汕头大学医学院第二附属医院消化内科,广东 汕头 515041)
丹参酮IIA对低氧条件下人肝癌HepG2细胞增殖、凋亡的影响及与HIF-1α、VEGF和野生型P53蛋白表达的关系*
刘丽璇, 吴灵飞, 邓 巍, 周小涛, 陈锐沛, 项梦琦, 郭益添, 蒲泽锦, 李国平△
(汕头大学医学院第二附属医院消化内科,广东 汕头 515041)
目的: 探讨低氧条件下丹参酮IIA(Tan IIA)对人肝癌HepG2细胞增殖和凋亡的影响及其分子机制。方法: 用氯化钴(CoCl2)创建低氧模型,实验分为常氧对照组、低氧对照组和低氧+Tan IIA处理组。不同浓度的Tan IIA 分别作用于低氧下人肝癌HepG2细胞24 h、48 h和72 h,采用MTT法测定Tan IIA 对低氧下HepG2细胞增殖的抑制作用。不同浓度的Tan IIA 分别作用于低氧条件下HepG2细胞24 h和48 h后,Hoechst 33258染色法检测细胞核的形态学变化并计算凋亡率。不同浓度的Tan IIA 作用于低氧条件下人肝癌HepG2细胞48 h后,Western blotting检测低氧诱导因子1α (HIF-1α)、血管内皮生长因子(VEGF)和野生型P53的蛋白表达情况。结果: 低氧条件下Tan IIA以时间和剂量依赖方式抑制HepG2细胞的生长和增殖。Tan IIA 作用于低氧下的HepG2细胞后,可见典型的凋亡细胞形态学特征,细胞凋亡率呈时间、剂量依赖性的增加。Western blotting免疫印迹法显示常氧对照组的HIF-1α和VEGF表达较低,而低氧对照组的HIF-1α、VEGF蛋白表达较常氧组升高,低氧下随着Tan IIA 浓度的升高,HIF-1α和VEGF蛋白的表达明显降低,野生型P53蛋白的表达随着Tan IIA 浓度的升高而升高。结论: 低氧条件下,Tan IIA能抑制肝癌HepG2细胞增殖并诱导其凋亡,其机制可能与抑制HIF-1α和VEGF蛋白表达,上调P53蛋白表达有关。
丹参酮IIA; 低氧; HepG2细胞; 细胞凋亡
肝细胞性肝癌(hepatocellular carcinoma, HCC)是临床上常见的恶性肿瘤,HCC使得全球每年大约有662 000例死亡,其中一半发生在中国[1]。HCC为血供丰富的实体恶性肿瘤,但由于肿瘤快速生长而血管生长却相对滞后,致使耗氧量超过了微血管所能提供的氧量,因此肝癌组织内细胞长期处于相对缺氧的微环境[2]。低氧微环境使肿瘤细胞发生一系列适应性变化,如促进肿瘤血管生成、增强无氧糖酵解和凋亡耐受等,而低氧诱导因子1α(hypoxia-inducible factor 1 alpha, HIF-1α)是肿瘤低氧应答的关键因子,HIF-1α与肿瘤血管生成、化疗抵抗、无氧糖酵解及恶性演进、侵袭转移等密切相关[3]。因此,寻找低氧条件下仍然有效的抗肿瘤药物成为目前研究的重要课题。丹参是临床上常用的活血化瘀的中药,丹参酮IIA(tanshinone IIA,Tan IIA)是其主要成分之一,目前发现Tan IIA对包括肝癌HepG2细胞在内的多种肿瘤细胞具有抑制增殖、诱导凋亡、抑制肿瘤血管形成和转移等抗癌活性[4-5]。但目前有关低氧条件下Tan IIA对肝癌HepG2细胞增殖及凋亡的影响还不明确。本研究采用MTT法、Hoechst 33258染色法和免疫印迹法研究Tan IIA对低氧模拟培养的、表达野生型P53的人肝癌HepG2细胞增殖抑制、凋亡的影响及与HIF-1α、血管内皮生长因子(vascular endothelial growth factor,VEGF)和P53蛋白表达的相互关系。
材 料 和 方 法
1 材料
人肝癌HepG2细胞由本实验室保存;丹参酮IIA(Tan IIA)购自中国药品生物制品检定所,用二甲亚砜(DMSO)溶解,分装后于-20 ℃冰箱保存备用;MTT购于Amersco;DMEM培养基和胎牛血清购于Gibco;兔抗人多克隆抗体HIF-1α、兔抗人多克隆抗体VEGF为Santa Cruz产品;鼠抗人单克隆抗体P53、兔抗人多克隆抗体α-tubulin为北京中杉金桥产品;Hoechst 33258荧光染色试剂及氯化钴(CoCl2)、山羊抗兔多克隆Ⅱ抗、山羊抗鼠多克隆Ⅱ抗、蛋白酶抑制剂PMSF和裂解液RIPA均购自Sigma;其它试剂均为国产分析纯。
2 主要方法
2.1 细胞培养 人肝癌HepG2细胞常规培养于高糖型DMEM培养基中(含10%胎牛血清,青霉素、链霉素各1×105U/L),置于37 ℃、5% CO2及饱和湿度环境的恒温培养箱培养, 细胞呈单层贴壁生长,长满80%左右时,以0.25%胰酶-EDTA消化传代,所有实验均在细胞对数生长期进行。化学缺氧剂CoCl2加入培养液的终浓度为150 μmol/L,用于模拟低氧微环境。
2.2 MTT实验测定细胞抑制率 取对数生长期的HepG2细胞,细胞密度调整为2.5×107/L,接种于96孔板,每孔200 μL,在37 ℃、5% CO2及饱和湿度条件下的培养箱培养24 h后弃去培养基,实验分3组:常氧对照组、低氧对照组和低氧+Tan IIA处理组。待细胞贴壁后分别加入CoCl2和不同浓度的Tan IIA(0.5、1.0、2.0、5.0、10.0 mg/L),每孔总体积200 μL,每个浓度组设5个复孔,四周加入不含药物的细胞培养液为空白对照。分别继续培养24 h、48 h、72 h后每孔加入5 g/L的MTT溶液20 μL,继续孵育4 h,吸尽上清液,每孔加入DMSO 150 μL,避光振荡10 min,以DMSO调零,在酶联免疫检测仪以570 nm 波长测定各孔吸光度(A),计算5孔的平均值和增殖抑制率:增殖抑制率(%) =(常氧对照组A-低氧对照组或低氧处理组A)/常氧对照组A×100%。
2.3 Hoechst 33258染色观察凋亡细胞形态学变化及计算凋亡率 取对数生长期的HepG2细胞制成2.5×107/L的细胞悬液,接种于放有盖玻片的24孔板内,每孔0.5 mL,分组同前,待细胞贴壁后分别加入CoCl2和不同浓度Tan IIA (1.0、2.0、5.0 mg/L) 培养24 h或48 h后吸尽培养液,取出盖玻片,甲醇/冰醋酸固定液固定5 min后加入荧光染液Hoechst 33258重悬细胞,室温避光1 h,PBS冲洗,用抗荧光液封片。显微镜下观察,正常细胞核为蓝色,凋亡的细胞核为白色。每片连续观察10个细胞分布均匀的200倍镜视野,每视野计数50个细胞,共500个细胞,计算其阳性率百分数,并取其均值。凋亡率(%)=凋亡细胞数/(正常细胞数+凋亡细胞数)×100%。
2.4 Western blotting免疫印迹法测定蛋白表达情况 将对数生长期的HepG2细胞制成2.5×107/L的细胞悬液,接种于6孔板中,每孔2 mL,分组同前,待细胞贴壁后分别加入CoCl2和不同浓度Tan IIA (1.0、2.0、5.0 mg/L),培养48 h后收集细胞,分别加入适量含PMSF的RIPA裂解液,于冰上裂解30 min,4 ℃下12 000×g离心 10 min,取上清用BCA法检测蛋白浓度。用8%~12%的SDS聚丙烯酰胺凝胶电泳分离蛋白,然后转至NC膜上。5%~10%脱脂牛奶室温封闭非特异抗原1 h,然后分别加入兔抗人HIF-1α多克隆抗体(1∶200)、兔抗人VEGF多克隆抗体(1∶200)和鼠抗人P53单克隆抗体(1∶1 000),4 ℃过夜, 接着加入山羊抗兔(1∶3 000)、山羊抗鼠(1∶3 000)Ⅱ抗室温孵育1 h。用ECL法发光,于暗室曝光,Quantity one进行半定量分析。
3 统计学处理
实验数据以均数±标准差(mean±SD)表示,采用SPSS 16.0统计软件进行统计学处理,组间均数比较采用单因素方差分析(One-way ANOVA),以P< 0.05为差异有统计学意义。
结 果
1 Tan IIA 对低氧条件下的HepG2细胞增殖抑制
为了研究Tan IIA对低氧下条件HepG2细胞增殖的影响,我们做了MTT细胞活力测定实验,结果如图1显示。低氧条件下HepG2肝癌细胞的增殖受抑制, 并呈时间依赖性;而Tan IIA则可呈剂量和时间依赖性地进一步抑制低氧条件下HepG2肝癌细胞的增殖。

Figure 1.The inhibitory effect of Tan IIA on the proliferation of HepG2 cells under hypoxia detected by MTT assay. Mean±SD.n=5.*P<0.05vsnormoxia;#P<0.05vshypoxia.
图1 Tan IIA 对低氧条件下的HepG2细胞增殖活性的影响
2 Tan IIA 在低氧条件下诱导HepG2细胞凋亡
根据上述实验结果,为了进一步证实Tan IIA抑制HepG2细胞增殖是通过促进其凋亡作用,我们用Hoechst 33258分别对常氧对照组、低氧对照组和在低氧条件下经不同浓度Tan IIA(1.0、2.0、5.0 mg/L)处理24 h或48 h的细胞核进行染色,观察细胞核的形态学改变。在荧光显微镜下,正常细胞的细胞核呈弥散均匀蓝色荧光,而凋亡细胞核固缩,碎裂,分解,呈现浓染致密的颗粒块状白色荧光,出现了典型的凋亡性细胞核改变,并随着Tan IIA浓度的升高和作用时间的延长,凋亡细胞的比例逐渐增高,见图2。我们计算了凋亡率,低氧条件下Tan IIA诱导HepG2细胞凋亡率呈现剂量和时间依赖性(P<0.05),见图3。
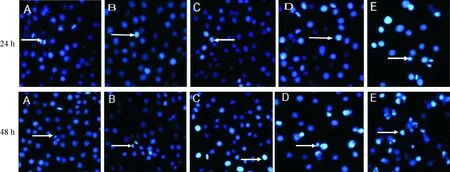
Figure 2.The effects of Tan IIA treatment for 24 h or 48 h on the apoptosis of HepG2 cells under hypoxia (Hoechst 33258 staining,×200).A: normoxia; B: hypoxia; C: hypoxia+1 mg/L Tan IIA; D: hypoxia+2 mg/L Tan IIA; E: hypoxia+5 mg/L Tan IIA.
图2 Hoechst 33258染色法观察低氧条件下Tan IIA处理HepG2细胞24 h 或48 h后的凋亡情况
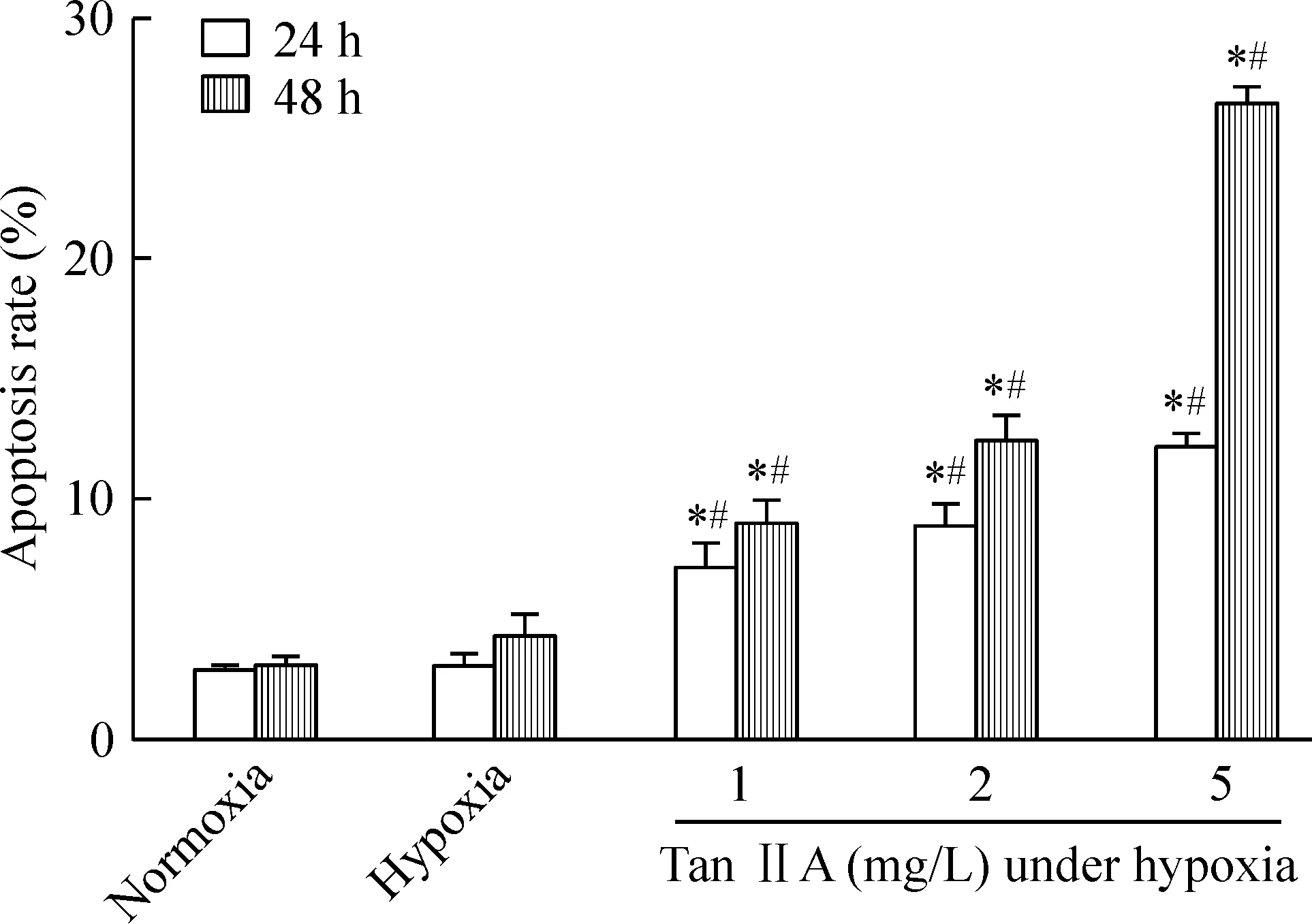
Figure 3.The apoptosis rate of HepG2 cells. Mean±SD.n=3.*P<0.05vsnormoxia;#P<0.05vshypoxia.
图3 Tan IIA 干预对低氧条件下HepG2细胞凋亡率的影响
3 Tan IIA 在低氧条件下对HepG2细胞HIF-1α、VEGF和野生型P53蛋白表达的影响
图4结果表明,常氧对照组HIF-1α和VEGF表
达较低,而低氧对照组(48 h)HIF-1α和VEGF的蛋白表达较常氧对照组升高,低氧条件下Tan IIA 处理组(48 h)的HIF-1α和VEGF蛋白表达随着Tan IIA 浓度的升高而降低(P<0.05),野生型P53的表达随着Tan IIA 浓度的升高而升高(P<0.05),差异均有统计学意义,并呈现量效关系。
讨 论
低氧微环境是多种实体肿瘤包括肝癌在内的共同特征,在缺氧条件下,肿瘤细胞为了继续生长而启动了一系列反应,包括了HIF-1的相关基因的表达[2-3]。HIF-1属于低氧诱导因子蛋白家族,该家族有HIF-1、HIF-2和HIF-3 共3个成员组成,由α亚基(HIF-1α、HIF-2α及HIF-3α)和β亚基构成异源二聚体,组成HIF的2个亚基。由于α亚基受氧浓度调节,β亚基在细胞中稳定存在不受氧浓度的调节,所以HIF-1的调控主要在于α亚基。常氧条件下,HIF-1α氧依赖降解结构域(oxygen-dependent degradation domain,ODD)特殊的脯氨酸残基被羟基化,使α亚基形成β折叠样构象,然后与林希氏(von Hippel-Lindau,VHL)蛋白结合,经泛素-蛋白酶体途径被降解[6]。低氧时由于降解途径被抑制,HIF-1α在细胞内聚集,并转位到细胞核内与HIF-1β结合成HIF-1,并启动下游基因(如VEGF)的转录,增加了相应的蛋白质产物。这些产物在肿瘤细胞的放疗和化疗耐药性中有着重要的作用[7]。
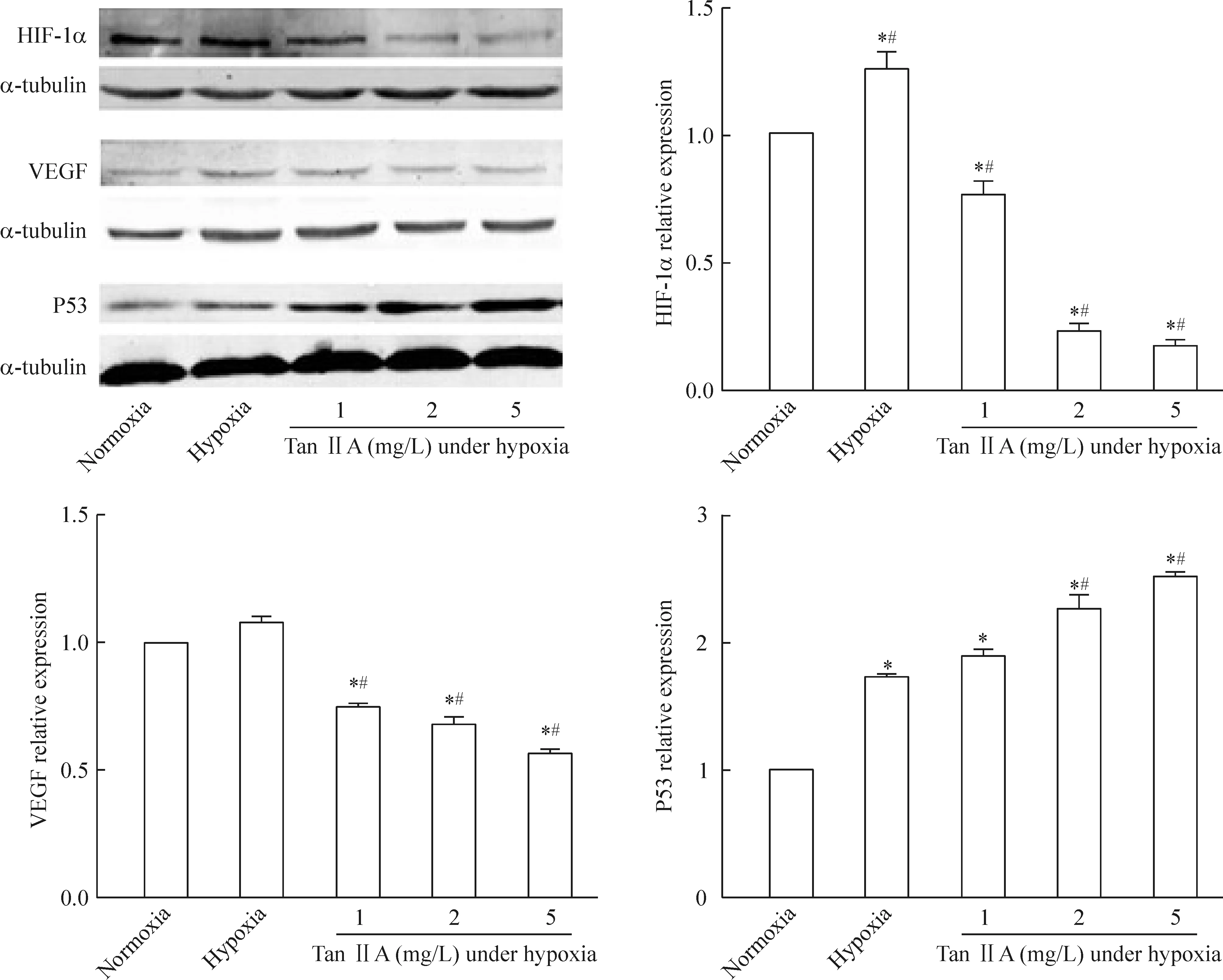
Figure 4.The effects of Tan IIA treatment on protein expression of HIF-1α, VEGF and wild-type P53 in HepG2 cells under hypoxia for 48 h. Mean±SD.n=3.*P<0.05vsnormoxia;#P<0.05vshypoxia.
图4 Tan IIA对低氧条件下HepG2细胞HIF-1α、VEGF和野生型P53蛋白表达的影响
丹参酮是中药丹参根的乙醇或乙醚提取物,其中含有15种成分,具有抗感染、抗心血管病、抗炎和调节免疫应答等作用。作为丹参的主要有效提取成分,Tan IIA在常氧条件下对HepG2细胞的生长有抑制作用,具有时间和浓度依赖性,并能诱导其凋亡[4-5]。本实验我们主要观察了低氧条件下Tan IIA对HepG2细胞的增殖和凋亡的影响以及与HIF-1α、VEGF和P53蛋白表达的关系。MTT实验发现,低氧下Tan IIA可呈剂量和时间依赖性地抑制HepG2细胞的增殖,10 mg/L作用于低氧下的HepG2细胞72 h,抑制率达到78.8%,但与48 h组比,差异没有统计学意义,这可能与Tan IIA的药代动力学特点有关。Tan IIA是短半衰期药物,其体内消除半衰期仅为2.25 h,即Tan IIA在体内经过5个消除半衰期(约57.7 h)可基本消除[8]。由此,我们在接下来的Hoechst 33258染核实验中只选取了24 h和48 h来观察低氧条件下Tan IIA对HepG2细胞凋亡的影响,结果证明随着Tan IIA浓度的升高和作用时间的延长,细胞凋亡率逐渐增高,5 mg/L作用于低氧下的HepG2细胞48 h,凋亡率为26.45%。Western blotting法发现,低氧条件下HepG2细胞的HIF-1α和VEGF的表达增强,这与文献报道相符[9],且Tan IIA能剂量依赖性抑制二者表达。研究表明,低氧诱导HIF-1α表达使肿瘤细胞耐受凋亡,而Tan IIA在低氧条件下能通过下调乳腺癌MCF-7和HCC1973细胞的HIF-1α表达来逆转阿霉素耐药[10]。赵志成等[11]证实表没食子儿茶素没食子酸酯可明显抑制缺氧处理的肝癌HepG2细胞的增殖,干预HIF-1α/VEGF信号转导通路可能是其抑制肿瘤生长的主要机制之一。肿瘤的生长、侵袭、转移与肿瘤的新生血管密切相关,VEGF是目前已知作用最强的血管生成诱导因子,其增强子区域存在数个转录因子结合位点,如AP-1、AP-2、SP-1和HIF-1。常氧条件下VEGF的表达主要由SP-1蛋白调节,但在缺氧条件下,细胞内AP-1、 AP-2和SP-1蛋白水平改变不明显,而HIF-1大量表达,HIF-1可增加VEGF基因转录,并使VEGF mRNA稳定性增加,VEGF受体表达上调,使VEGF的生物学效应增强[7]。VEGF有抑制肿瘤细胞的凋亡作用,例如VEGF可诱导抗凋亡蛋白Bcl-2的表达,直接抑制肿瘤细胞的凋亡,同时增强肿瘤细胞对放疗的耐受性。肝癌是典型的高血管肿瘤,理论上通过抑制VEGF对抗肿瘤意义重大[12]。因此,我们推测Tan IIA在缺氧时可能通过抑制HIF-1表达进而抑制VEGF发挥其抗肿瘤作用。
我们的研究证实,低氧条件下Tan IIA作用于HepG2细胞后剂量依赖性抑制HIF-1α和VEGF的表达的同时上调P53蛋白表达,这可能与发生了P53相关的凋亡有关。肿瘤细胞的凋亡有P53依赖性和非P53依赖性2条途径,而低氧条件下的凋亡可能是通过HIF-1α为中介的P53依赖性途径起作用[13]。正常情况下,野生型P53在细胞中呈现低水平表达,因为MDM-2可通过反馈环对P53的功能进行调节,即MDM-2通过泛素化与P53结合而抑制P53的转录活性[14]。在低氧情况下可通过HIF-1α通路诱导P53的表达,并能通过与P53蛋白竞争与MDM2结合,防止P53被MDM2途径降解,从而引起P53途径的活化,促进P53依赖的细胞凋亡,而野生型P53也对HIF-1α进行调节,一是通过MDM2介导的泛素-蛋白酶解通路促进HIF-1α蛋白的降解,二是和HIF-1α竞争与CBP/p300结合,抑制HIF-1α的转录激活活性从而降低HIF-1α蛋白的表达[14]。 P53与VEGF之间也有明显的相关性,野生型P53能参与下调内源性VEGF mRNA水平及VEGF启动子的活性[15]。研究证实,姜黄素可诱导细胞内P53的聚集,促进泛素-蛋白酶体对HIF-1α蛋白的降解,从而抑制HIF-1α的稳定性,继而下调HIF-1靶基因VEGF的表达[16]。
总之,本研究结果表明Tan IIA在低氧条件下可抑制HepG2肝癌细胞增殖,促进细胞凋亡。我们推测,低氧条件下Tan IIA对HepG2细胞的杀伤机制有可能是Tan IIA通过蛋白酶体途径使低氧诱导的HepG2细胞中的HIF-1α降解和失活,继而下调HIF-1下游基因VEGF的表达,从而抑制肿瘤血管生成,延缓肿瘤生长,同时发生与P53通路相关的凋亡,但具体的细胞信号通路有待进一步研究。
[1] Xie H, Ma H, Zhou D. Plasma HULC as a promising novel biomarker for the the detection of hepatocellular carcinoma[J]. Biomed Res Int, 2013, 2013:136106.
[2] Dong ZZ, Yao M, Wang L, et al. Hypoxia-inducible factor-1 alpha: molecular-targeted therapy for hepatocellular carcinoma[J]. Mini Rev Med Chem, 2013, 13(9):1295-1304.
[3] Ward C, Langdon SP, Mullen P, et al. New strategies for targeting the hypoxic tumour microenvironment in breast cancer[J]. Cancer Treat Rev, 2013, 39(2):171-179.
[4] 钟志宏, 陈文贵, 柳永和, 等. 丹参酮IIA抑制HepG2细胞生长及诱导其凋亡的实验研究[J]. 中南大学学报:医学版, 2007, 2(1):99-103.
[5] Lee WY, Chiu LC, Yeung JH, et al. Cytotoxicity of major tanshinones isolated from Danshen (Salviamiltiorrhiza) on HepG2 cells in relation to glutathione perturbation[J]. Food Chem Toxicol, 2008, 46(1):328-338.
[6] Lee JW, Bae SH, Jeong JW, et al. Hypoxia-inducible factor (HIF-1)α: its protein stability and biological functions[J]. Exp Mol Med, 2004, 36(1):1-12.
[7] Evans CE, Branco-Price C, Johnson RS. HIF-mediated endothelial response during cancer progression[J]. Int J Hematol, 2012, 95(5):471-477.
[8] 施之琪, 王洛临, 张建军, 等. 中心复合设计法优化丹七有效部位缓释微丸[J]. 中国药师, 2012, 15(6):820-823.
[9] 余桂芳, 严跃红, 王瑞鑫, 等. 不同缺氧状态对人肝癌HepG2细胞侵袭和转移能力的影响[J]. 中国病理生理杂志, 2012, 28(2):281-286.
[10]Fu P, Du F, Chen W, et al. Tanshinone IIA blocks epithelial-mesenchymal transition through HIF-1α downregulation, reversing hypoxia-induced chemotherapy resistance in breast cancer cell lines[J]. Oncol Rep, 2014, 31(6):2561-2568.
[11]赵志成, 庄 莉, 贾长库, 等. EGCG抑制肝癌细胞株HepG2增殖及HIF-1α/VEGF的表达[J]. 中国病理生理杂志, 2010, 26(4):713-720.
[12]黄 建, 王海波, 葛盛芳, 等. VEGF siRNA降低人肝癌细胞株SMMC-7721的致瘤性[J]. 分子细胞生物学报, 2007, 40(5):277-285.
[13]Obacz J, Pastorekova S, Vojtesek B, et al. Cross-talk between HIF and p53 as mediators of molecular responses to physiological and genotoxic stresses[J]. Mol Cancer, 2013, 12:93.
[14]Clegg HV, Itahana Y, Itahana K, et al. Mdm2 RING mutation enhances p53 transcriptional activity and p53-p300 interaction[J]. PLoS One, 2012, 7(5): e38212.
[15]Giatromanolaki A, Koukourakis MI, Kakolyris S, et al. Vascular endothelial growth factor, wild-type p53, and angiogenesis in early operable non-small cell lung cancer[J]. Clin Cancer Res, 1998, 4(12):3017-3024.
[16]Jana NR, Dikshit P, Goswami A, et al. Inhibition of proteasomal function by curcumin induces apoptosis through mitochondrial pathway[J]. J Biol Chem, 2004, 279(12):11680-11685.
Effects of tanshinone IIA on proliferation, apoptosis and expression of HIF-1α, VEGF and wild-type P53 in human hepatoma HepG2 cells under hypoxia
LIU Li-xuan, WU Ling-fei, DENG Wei, ZHOU Xiao-tao, CHEN Rui-pei, XIANG Meng-qi, GUO Yi-tian, PU Ze-jin, LI Guo-ping
(DepartmentofGastroenterology,TheSecondAffiliatedHospitalofShantouUniversityMedicalCollege,Shantou515041,China.E-mail:guopingli8@163.com)
AIM: To investigate the effects of tanshinone IIA (Tan IIA) on proliferation, apoptosis and its molecular mechanism in human hepatoma HepG2 cells under hypoxic condition. METHODS: Hypoxia model was established by treatment with cobalt chloride (CoCl2). The cells were divided into normoxia control group, hypoxia control group and hypoxia combined at different concentrations of Tan IIA groups. After HepG2 cells were incubated with different concentrations of Tan IIA (0.5, 1.0, 2.0, 5.0 and 10.0 mg/L) for 24 h, 48 h and 72 h under hypoxic condition, the cell proliferation was determined by MTT assay. After Tan IIA was added to the media at different concentrations for 24 h and 48 h, the apoptotic cells were observed by Hoechst 33258 staining. The protein levels of hypoxia-inducible factor 1 alpha (HIF-1α), vascular endothelial growth factor (VEGF) and wild-type P53 were detected by Western blotting after cultured with different concentrations of Tan IIA for 48 h. RESULTS: Tan IIA inhibited the proliferation of HepG2 cells in a dose- and time-dependent manner. Tan IIA induced the typical morphology of apoptotic cells and increased the apoptotic rate in a dose- and time-dependent manner after treatment with 1.0 mg/L~5.0 mg/L for 24 h and 48 h under hypoxic condition. The protein levels of HIF-1α and VEGF were weakly expressed in HepG2 cells under normoxia but up-regulated after incubated under hypoxia for 48 h. The protein expression of HIF-1α and VEGF were decreased with the increase in the concentration of Tan IIA under hypoxia. The protein expression of wild-type P53 was increased with the increase in the concentrations of Tan IIA under hypoxia. CONCLUSION: Tan IIA significantly inhibits the proliferation and induces the apoptosis of human hepatoma HepG2 cells under hypoxia, which may be related to the down-regulation of HIF-1α and VEGF and up-regulation of wild-type P53.
Tanshinone IIA; Hypoxia; HepG2 cells; Apoptosis
1000- 4718(2014)12- 2155- 06
2014- 06- 20
2014- 08- 14
广东省中医药局资助项目(No.20121165)
R285.5
A
10.3969/j.issn.1000- 4718.2014.12.007
△通讯作者 Tel:0754-88915604;E-mail: guopingli8@163.com
