黔西北蜜环菌的诱变选育与母种培养基筛选*
2014-07-18杨清艳蔡传涛刘贵周
杨清艳,蔡传涛,刘贵周,文 平
(1.中国科学院西双版纳热带植物园,云南 昆明 650223;2.中国科学院大学,北京 100049;3.大方县九龙天麻开发有限公司,贵州 大方 551600)
黔西北蜜环菌的诱变选育与母种培养基筛选*
杨清艳1,2,蔡传涛1**,刘贵周1,文 平3
(1.中国科学院西双版纳热带植物园,云南 昆明 650223;2.中国科学院大学,北京 100049;3.大方县九龙天麻开发有限公司,贵州 大方 551600)
为解决黔西北蜜环菌菌种退化造成的天麻减产问题,首次对其进行诱变选育和母种培养基筛选,结果表明,接种菌索部位在尖端0~1.0 cm时生长最好;氨水的诱变效果最好,1%氨水诱变2 min获得稳定遗传的优良突变株;最适合优良突变株生长的培养基配方为葡萄糖20 g、黄豆粉20 g、马铃薯200 g、琼脂15 g、磷酸二氢钾2 g,水1 000 mL,pH自然。
蜜环菌;菌索;诱变选育;培养基筛选
蜜环菌(Armillariamellea)别名蜜环蕈、榛蘑、青冈蕈,属于真菌门、担子菌亚门、层菌纲、伞菌目、口蘑科、蜜环菌属真菌[1,2]。蜜环菌是一类经济价值较高的大型真菌,分布极广,包括果园、葡萄园、森林地区[3,4]和城市地区[5-7],对树木有较强的侵染性[8],为名贵中药天麻(GastrodiaelataBl.)和猪苓(Grifolaumbellata)生长繁殖所必需。
天麻没有根、茎、叶的分化,因此它不能通过根吸收营养,不能进行光合作用,天麻原球茎需要蜜环菌侵入原球茎提供营养才能发育成成体球茎。目前野生天麻被大量采挖,资源短缺,进行仿野生种植成为开发天麻市场、提高天麻产量的重点,然而选育出当地优良的蜜环菌菌株成为天麻仿野生栽培综合配套技术研究的瓶颈。
天麻栽培的蜜环菌连续无性繁殖,菌种会发生严重退化,从而导致天麻的产量和天麻素质量分数急剧下降[9],黔西北天麻栽培所用的蜜环菌已出现生长速度慢、菌索细、易被杂菌抑制甚至杀死、抗旱能力差等缺陷,这些问题严重影响了天麻的产量和品质,仿野生栽培中出现菌索过细、“空窝”、菌索过早干枯等状况。所以,选育出黔西北适合于天麻栽培的蜜环菌优良菌株,已成为提高天麻产量与品质的迫切问题。
1 材料与方法
1.1 供试菌株
贵州省毕节市大方县九龙天麻开发有限公司采自野生天麻生长地青冈树根的野生蜜环菌菌索,已应用于当地天麻栽培。
1.2 培养基
配方1:麦麸30 g、葡萄糖20 g、磷酸二氢钾1.5 g、琼脂18 g,水1 000 mL,pH自然;配方2:玉米粉120 g、黄豆粉20 g、蔗糖20 g、琼脂15 g,水1 000 mL,pH自然;配方3:麦芽糖20 g、琼脂20 g,水1 000 mL,pH自然;配方4:马铃薯(削皮,下同)200 g、麦麸30 g、琼脂20 g,水1 000 mL,pH自然;配方5:麦麸50 g、玉米粉100 g、葡萄糖10 g、琼脂5 g,水1 000 mL,pH自然;配方6:胡萝卜150 g、葡萄糖20 g、硫酸镁1 g、琼脂20 g,水1 000 mL,pH自然;配方7:马铃薯100 g、木屑30 g、玉米粉60 g、琼脂10 g、磷酸二氢钾1.5 g、硫酸镁1 g、维生素B1 10 mg,水1 000 mL,pH自然;配方8:麦芽糖10 g、葡萄糖10 g、蛋白胨4 g、磷酸二氢钾0.46 g、磷酸氢二钾1 g、硫酸镁1 g、琼脂20 g,水1 000 mL,pH自然;配方9:马铃薯200 g、葡萄糖20 g、芝麻粉20 g、玉米粉10 g、磷酸二氢钾2 g、硫酸镁1.5 g,水1 000 mL,pH自然;配方10:马铃薯200 g、葡萄糖20 g、磷酸二氢钾1 g、硫酸镁1.5 g、蛋白胨5 g、琼脂20 g,水1 000 mL,pH自然;配方11:葡萄糖20 g、黄豆粉20 g、马铃薯(削皮)200 g、琼脂15 g、磷酸二氢钾2 g、水1 000 mL,pH自然;PDA培养基:葡萄糖20 g、马铃薯200 g、琼脂18 g,水1 000 mL,pH自然。
1.3 蜜环菌菌索分离
严格无菌条件下,用无菌水清洗蜜环菌5次,用接种剪从尖端开始剪成相同长度,不同部位的0.5 cm(0 cm~0.5 cm,0.5 cm~1.0 cm,1.0 cm~1.5 cm,1.5 cm~2.0 cm),放入0.1%L汞溶液中浸泡约2 min,取出后再用无菌水冲洗5次,用无菌滤纸吸净表面水后,置于PDA培养皿上,每皿放置4段,每个取样部位处理3个重复。25°C暗培养,每天对菌索不同菌索部位接种后菌索颜色、密度、分枝数和粗细等生长状况进行观察记录。
1.4 蜜环菌化学试剂诱变选育
将蜜环菌母种扩繁备用,用氨水、亚硝酸钠和硫酸二乙酯诱变蜜环菌菌索,将菌索幼嫩尖端切成2 mm小段,0.1% L汞溶液消毒1 min,置于培养皿中,去掉菌索皮层留下菌髓, 0.1%、0.5%和1%的氨水分别处理0.5 min、1 min和2 min,0.2%、0.4%和0.8%的硫酸二乙酯分别诱变1 min、3 min和5 min,0.02 mol·L-1、0.04 mol·L-1和0.08 mol·L-1的亚硝酸钠分别诱变1 min、2 min和3 min,硫酸二乙酯诱变后用20%硫代硫酸钠溶液终止反应,将诱变后的蜜环菌菌索、菌髓用无菌水冲洗5次,无菌滤纸吸干表面水分,接种到PDA平板。每种诱变剂分别选取未加诱变剂但其他处理一样的菌索菌髓作对照组,所有处理均设3个重复,25℃避光培养。
每3天测量每组菌索的生长速率,直至菌索停止生长,最后计算菌索平均生长速率;观察记录菌索颜色、密度、粗细、分枝数等指标。
1.5 蜜环菌优良突变株筛选及遗传稳定性检测
从蜜环菌菌索平均生长速率和生长特征2个方向进行综合考察筛选,选出菌索平均生长速率大、密度大、粗壮、所需萌发时间短和分枝多的菌株作为优良突变株,将其接种到PDA培养基上继代培养3次,观察其生长速率、分枝数、颜色、粗细等性状能否稳定遗传,若稳定,则作为培养基筛选的起始菌株。
1.6 蜜环菌优良突变株培养基筛选
将诱变所得的稳定遗传优良突变株在严格无菌条件下截取幼嫩菌索按照1.4的消毒接种方法进行扩大培养,培养得到的大量菌索供培养基筛选用。
截取幼嫩菌索尖端接种到1.2的12种不同组成的培养基上,每种配方处理3个重复。25°C避光培养,观察记录。
2 结果与分析
2.1 蜜环菌菌索取样部位筛选
蜜环菌菌索不同取样部位的生长特征见表1。
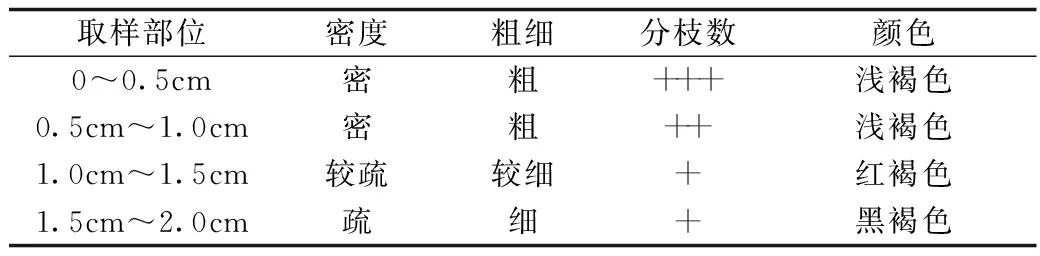
表1 蜜环菌菌索不同取样部位的生长特征
注:分枝数(个):+表示0~10个; ++表示11个~20个; +++表示21个~30个。
不同菌索段接种后的生长特征差异比较大,根据表1可以分析出,接种尖端1.0 cm以内的菌索才能保证蜜环菌菌索的正常生长和后续试验的可重复性。
2.2 蜜环菌化学诱变选育
2.2.1 菌索萌发率测定
菌株经化学试剂诱变后有11组菌索未萌发,共处理27组,因此萌发率为59.26%。
2.2.2 不同诱变剂处理后的生长特征
经3种诱变剂诱变后,根据粗细、密度、分枝数、颜色和平均生长速率等生长特征见表2和表3。
由表2、表3可以初步分析出氨水诱变效果最好,其次是亚硝酸钠,硫酸二乙酯诱变效果最差。比较表2生长特征,其中0.1%氨水0.5 min、0.1%氨水1 min、0.1%氨水2 min、1%氨水2 min、0.04 mol·L-1亚硝酸钠2 min、0.08 mol·L-1亚硝酸钠1 min和0.08 mol·L-1亚硝酸钠2 min菌索粗细和密度优于其他处理组。
2.2.3 不同诱变剂处理后的平均生长速率
方差分析显示,菌索经不同诱变剂处理后平均生长速率的差异显著(p<0.05),除了0.1%氨水0.5 min和0.08 mol·L-1亚硝酸钠3 min,其他处理组与各自对照组的差异均显著(p<0.05)。
如表3所示,0.08 mol·L-1亚硝酸钠诱变1 min后菌索生长速率最大,其次是1%氨水2 min、0.1%氨水1 min、0.5%氨水0.5 min、0.5%氨水2 min、0.04 mol·L-1亚硝酸钠2 min。
从天麻栽培中所需蜜环菌生长特性角度出发,首先需要筛选出菌索平均生长速率大的突变株,结合菌索粗细、密度、分枝数、萌发时间和色泽几个指标,最终筛选出0.08 mol·L-1亚硝酸钠1 min、0.1%氨水1 min和1%氨水2 min 3种最佳诱变条件,得到3株优良突变株。
2.3 优良突变株的遗传稳定性试验
对蜜环菌诱变后筛得的3株优良突变株进行遗传稳定性试验,继代培养3次,发现3个突变株的生长特性均能稳定地遗传,1%氨水2 min的遗传稳定性最高,3次继代培养中各生长特征无变化。
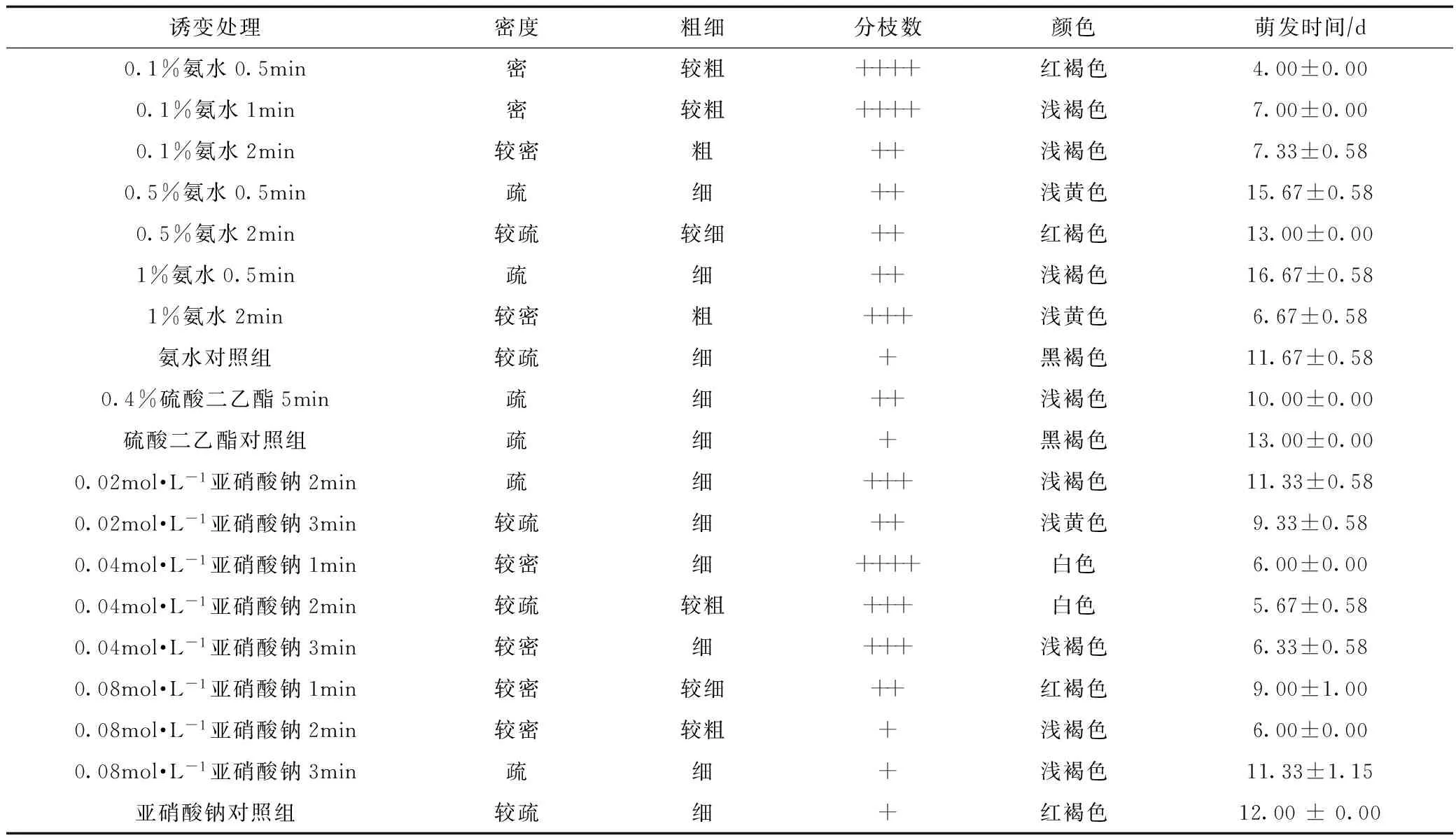
表2 蜜环菌菌索经不同诱变处理后的生长特征
注:分枝数(个): +表示0~10个; ++表示11个~20个; +++表示21个~30个; ++++表示30个~40个。下同。
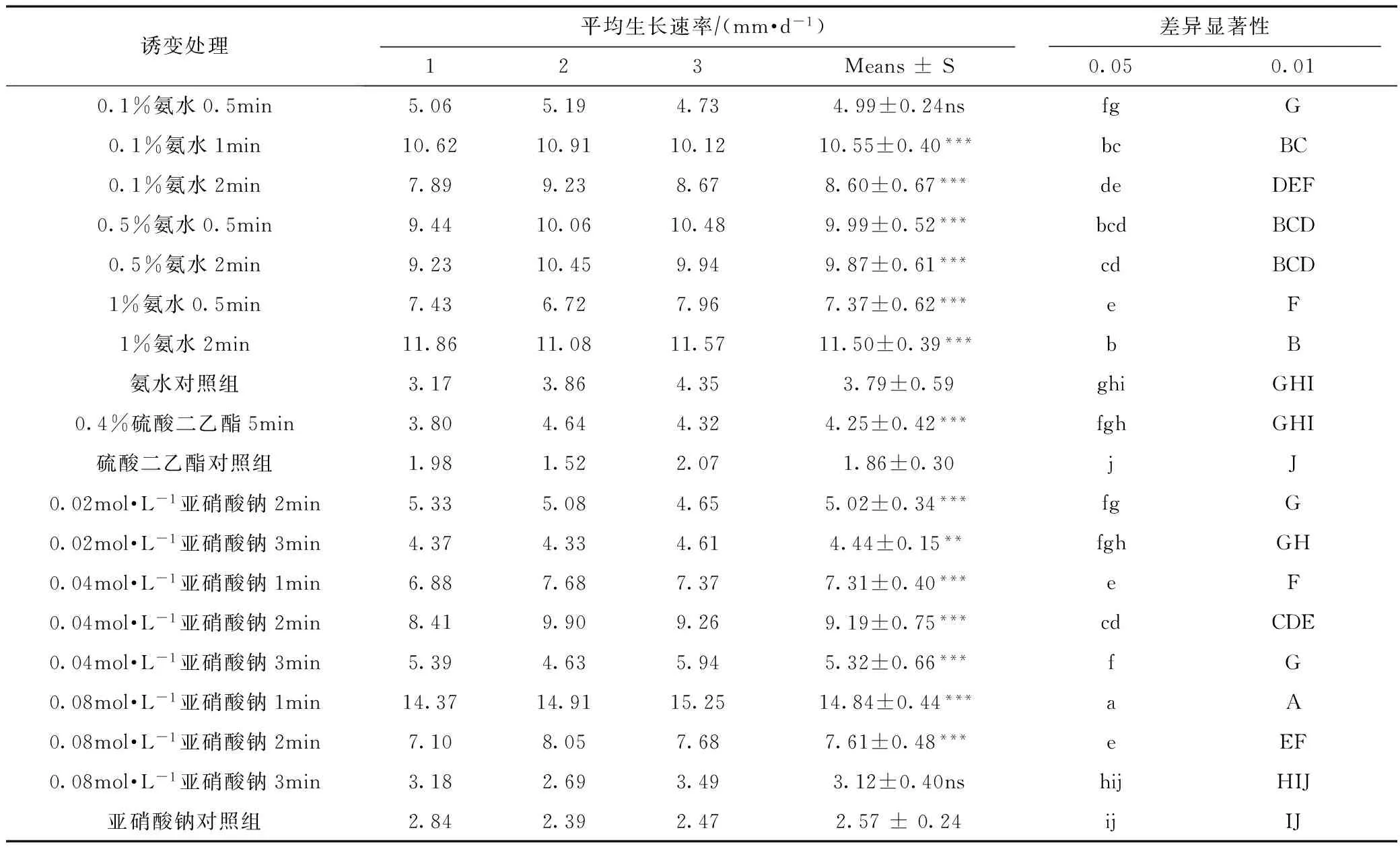
表3 蜜环菌菌索经不同诱变处理后的平均生长速率
注:与对照组比较,*p<0.05,**p<0.01,***p<0.001,ns差异不显著。下同。
2.4 蜜环菌优良突变株母种培养基筛选
遗传最为稳定的优良突变株(1%氨水诱变2 min),在不同配方上菌株生长特性差异显著。蜜环菌生长特征见表4。
由表4可见,配方1、配方2、配方7、配方9和配方11的菌索密度、菌索粗细和菌索分枝数均大于其他配方,菌索萌发时间均小于其他培养基配方。方差分析显示见表5。
由表5可见,除配方2,其他配方与对照组的差异均显著(p<0.05),配方7的菌索平均生长速率最大,其次是配方9、配方11和配方6。以菌索平均生长速率为主要筛选指标,结合菌索密度、粗细、分枝数和色泽,最终得出配方7、配方9和配方11 3种培养基配方均适合蜜环菌优良突变株生长,其中配方7最佳。
从配方成分上分析,葡糖糖和马铃薯是较为理想的碳源和氮源,再添加玉米粉、芝麻粉、黄豆粉能使菌索更为粗壮,添加适量的无机盐可以加快菌索生长。
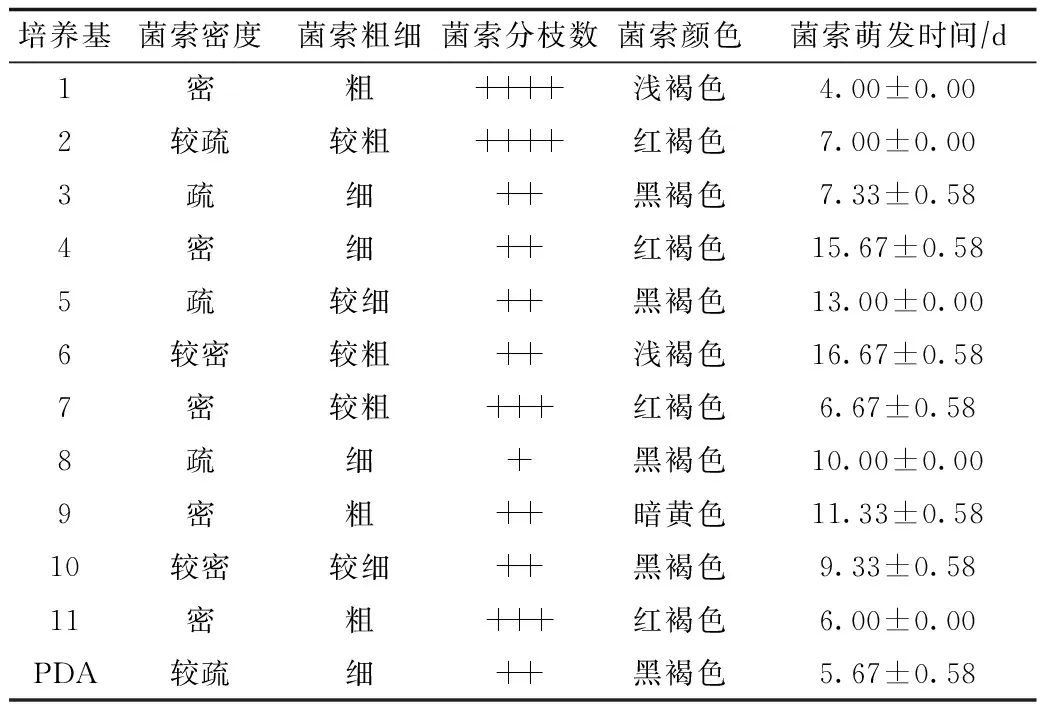
表4 蜜环菌优良突变株在不同培养基上的生长特征

表5 蜜环菌优良突变株在不同培养基上的菌索平均生长速率
3 讨论
目前蜜环菌的相关研究主要集中在蜜环菌多糖等成分研究[10-12]和分离纯化方面[13,14],而在选育方面研究极少,蜜环菌进行多代天麻栽培后出现明显的菌种退化与变异,如用已发生退化的菌种拌栽天麻则导致天麻产量与品质急剧下降[15]。同时,赵俊[16]等研究表明,由于全国各个地区天麻种类不同,跨区域引进菌种或推广是极不科学的。本研究加大了对黔西北本地天麻共生蜜环菌的研究力度,从优良菌种选育到培养基筛选等方面进行全面探讨。
化学诱变更多的是引起分子水平上的变化,对生物分子的影响通常是个别、局部的,不易引起染色体畸变或损伤, 因此,产生点突变的比例高,突变谱的稳定性好[17,18],化学诱变还有突变频率高、特异性强等特点[19]。试验中发现氨水对蜜环菌诱变效果较好。亚硝酸钠有一定的诱变效果,但不如氨水明显,可能是由于诱变剂浓度和时间不合适。硫酸二乙酯的诱变效果差,致死率接近100%。
本研究对黔西北天麻栽培所用的蜜环菌进行了分离纯化、诱变选育和母种培养基筛选,得到了菌索平均生长速率大、密度大、萌发时间短、菌索粗壮、分枝数多、菌索色泽好和遗传性状稳定的优良突变株及其合适的母种培养基配方,关于黔西北蜜环菌的抗旱、抗杂菌污染能力等尚需进一步开展研究。
[1]王秋颖,郭顺星,樊锦艳. 不同蜜环菌菌株生物学特性及菌丝体多糖含量的研究[J]. 中国药学杂志,2001,36 (9):588-590.
[2]李福后,王伟霞. 5株蜜环菌产几种胞外酶活性比较[J]. 淮海工学院学报,2006,15 (3):58-61.
[3]Rishbeth J. Species ofArmillariain southern England[J]. Plant Pathology, 1982(31):9-17.
[4]Rishbeth J.Armillariain an ancient broadleaved woodland[J]. European Journal of Forest Pathology, 1991(21): 239-249.
[5]Coetzee MPA, Wingfield BD, Harrington TC, et al. The root rot fungusArmillariamelleaintroduced into South Africa by early Dutch settlers[J]. Molecular Ecology, 2001(10): 387-396.
[6]Motta JJ, Korhonen K. A note onArmillariamelleaandArmillariabulbosafrom the middle Atlantic states [J]. Mycologia, 1986(78): 471-474.
[7]Rishbeth J. The importance of the honey mushroom(Armillaria) in urban forestry [J]. Arboriculture Journal, 1983(7): 217-225.
[8]Kendra B, Ravi B, Phillip F. A rapid infection assay forArmillariaand real-time PCR quantitation of the fungal biomass in planta [J]. Fungal Biology, 2010(114): 107-119.
[9]孙士青,马耀宏,孟庆军,等. 野生、退化、复壮蜜环菌对天麻产量及天麻素量的影响[J]. 中草药,2009,40 (8):1300-1302.
[10]宋成芝,徐燕. 蜜环菌的化学成分及药理作用研究[J]. 安徽农业科学,2010,38 (10):5119-5120.
[11]许宝奎,操玉平,于敏,等. 蜜环菌多糖对大鼠INS-1细胞凋亡的拮抗作用[J]. 中国食用菌,2010,29 (1):45-48.
[12]刘晓杰,焦连庆,杨利民,等. 蜜环菌多糖的分离纯化及PMP衍生化HPLC分析[J]. 中国药师,2012,15 (4):448-451.
[13]肖波,胡开治. 蜜环菌菌种分离新法-天麻组织分离法[J]. 微生物学通报,2006,33 (3):118-121.
[14]吴尊华,王绍柏. 蜜环菌菌种的分离纯化复壮研究[J]. 中国食用菌,2011,30 (4):17-19.
[15]孙士青,史建国,李雪梅,等. 连续无性繁殖乙型蜜环菌对天麻生物产量及天麻素含量的影响[J]. 中国中药杂志,2009,34 (3):359-360.
[16]赵俊,赵杰. 中国蜜环菌的种类及其在天麻栽培中的应用[J]. 食用菌学报,2007,14 (1):67-72.
[17]徐冠仁. 植物诱变育种学[M]. 北京:中国农业出版社,1996:1.
[18]柳学余. 农作物化学诱变育种[M]. 南京:东南大学出版社,1992:2.
[19]崔霞,梁燕,李翠,秦蕾,等. 化学诱变及其在蔬菜育种中的应用[J]. 西北农林科技大学学报:自然科学版,2013,41 (3):205-212.
Mutation Breeding and Medium Screening ofArmillariamelleain Northwestern Guizhou
YANG Qing-yan1,2, CAI Chuan-tao1, LIU Gui-zhou1, WEN Ping3
(1.Xishuangbanna Tropical Botanical Garden, KunmingYunnan650223; 2.University of Chinese Academy of Sciences,Beijing100049; 3.Dafang Gastrodia Elata Development Company, LTD, DafangGuizhou551700)
In order to solve the problem ofGastrodiaelataBlume’s yield drawdown caused by degradation ofArmillariamelleain northwestern Guizhou, mutation breeding and medium screening ofArmillariamelleawere studied for the first time. The results suggested thatArmillariamellea’sgrowth was better when the transferring part was 0~1.0 cm from the top end of rhizomorphs. It was proved that NH3·H2O was the most effective mutagen. The best induced mutation conditions were found: 1%NH3·H2O induced 2 min. The optimal culture medium for high-quality mutants was glucose 20 g, soybean meal 20 g, potato 200 g, agar 15 g, KH2PO42 g, H2O 1 000 mL, natural pH.
Armillariamellea; Rhizomorph; Mutation breeding; Medium optimization
*项目来源:国家科技支撑计划课题“喀斯特山区生态环境保护与植物类中药材开发关键技术研究与示范”(2007BAD53B04);贵州省科技厅毕节市人民政府中科院昆明分院科技合作项目“天麻栽培中替代菌材与野生萌发菌研究及其成果示范”(省地院合2011-5)。
杨清艳(1988-),女,在读硕士研究生,主要从事药用植物栽培研究。E-mail:lindy7286@126.com
**通信作者: 蔡传涛,研究员,研究方向:主要从事药用植物栽培研究。E-mail:caict@xtbg.ac.cn
2014-03-30
S646.9
A
1003-8310(2014)03-0012-04
