丹参酮II A影响大鼠急性脊髓损伤HSP70神经元的表达
2014-07-18陈杨张承馨
陈杨 张承馨
·实验研究·
丹参酮II A影响大鼠急性脊髓损伤HSP70神经元的表达
陈杨 张承馨
目的 通过对Wistar大鼠给予尾静脉注射丹参酮ⅡA, 影响大鼠急性脊髓损伤热休克蛋白质70(HSP70)神经元水平的表达。方法 采用Allen’s打击法建立急性脊髓损伤(ASCI模型), 观察丹参酮ⅡA组(STS组)、甲基强的松龙组(MP组)、安慰剂对照组(NS组)、不给药对照组(NO组), 观察在伤后1、2、4、8 h时间点HSP70阳性表达。结果 四组HSP70在ASCI后组织中显著存在, 且各组HSP70表达趋势随着各个时段上升呈上升趋势。①急性脊髓损伤大鼠不做任何处理或给予生理盐水的情况下, HSP70表达差异无统计学意义(P>0.05)。②当注射丹参酮ⅡA或甲基强的松龙时, 脊髓组织中HSP70表达差异有统计学意义(P<0.05或P<0.01)。组间比采取t检验, 其结果显示:①给脊髓损伤模型注射生理盐水和不给药时, 对脊髓组织中HSP70表达是一致的(P>0.05)。②给强的松龙治疗脊髓损伤作用优于丹参酮ⅡA注射液(P<0.05)。结论 ①急性脊髓损伤过程中神经元受到损伤致使HSP70表达增高是产生应激性保护的一种标志, 该标志在HSP 70表达中对受损神经元起到保护作用, 也使得HSP70在ASCI后表达增强。②脊髓损伤后各组的HSP70表达均呈增加趋势。STS组和MP组HSP70随时段上升阳性神经元细胞表达上升, 亦呈连续性, STS组数值虽低于MP组数值, 但具有可比性。所以二者在急性脊髓损伤后HSP70阳性神经元表达层面上具有相同作用。
急性脊髓损伤;丹参酮ⅡA;热休克蛋白70
在社会现代化进程中, 人们从事多种生产性活动, 进而发生脊髓损伤的几率大大增加。目前临床上治疗脊髓损伤有以下几种药物:甲基强的松龙、神经节苷脂、三七总皂苷、人参皂苷、胰岛素等药物, 这些药物存在着学术上争议、价格偏贵等因素, 而患者来源主要是从事交通运输、建筑等职业人群。从中药丹参中提取丹参酮ⅡA作为替代药物为患者提供一种较为低廉的药物供使用。
1 材料与方法
1.1材料 Wistar大鼠160只(体重220~250 g, 雌雄不限)由贵阳医学院动物实验中心提供。鼠抗HSP70试剂盒与SP免疫组化试剂盒购自沈阳达克制药有限公司。
1.2方法 将160只大鼠进行随机分组, 一共分为四组, 每组40只, 具体分组如下: STS组(简称STS组); 甲基MP组(简称MP组);安慰剂对照组(简称NS组);不给药对照组(简称NO组)。① STS组:在造模前30 min, 找到大鼠的尾静脉, 注射丹参酮ⅡA注射液, (按0.5 g/kg的比例)进行给药。②MP组:在造模前30 min, 找到大鼠的尾静脉, 注射甲基强的松龙注射液, (按30 mg/kg的比例)进行给药。③NS对照组:在造模前30 min, 找到大鼠的尾静脉, 注射0.9%的生理盐水, (按30 mg/kg的比例)进行给药。④NO对照组:不作任何注药, 直接造模。在T11与T12、T12与T13棘突及相应椎板之间用骨剪做剪除, 形成横行剪口, 再在T12胸椎两侧, 用骨剪行纵行切口在横突与椎板连接处, 形成口字形的剪口界线, 然后用血管钳夹住T12棘突并用力拉起即“开窗揭盖”,去除T12椎板, 用咬骨钳修整方行骨窗边缘, 使T12所对应的脊髓充分暴露。用专用撑开器撑开脊髓两侧软组织暴露脊髓,用Allen’s打击法制作脊髓损伤动物模型, 使脊柱椎体稳定,避免呼吸运动的影响, 在3 cm高度使击打棍(20 g)做自由落体运动, 致伤能量60 g·cm, 撞击T12垫片及骨窗内所暴露的脊髓, 造成急性脊髓损伤, 稳住击打棍并停留3 min再移开。Allen’s打击法造模标准:硬脊膜完整呈紫红色, 紧张, 膨隆,脊髓组织水肿、出血, 大鼠尾巴表现为痉挛性摆动, 双下肢躯体回缩样扑动, 呈迟缓性瘫痪[1]。在造模后1、2、4、8 h, 从每组中分别随机抽取10只模型鼠, 取得T12全段受损脊髓组织并分为三部分, 大鼠脊髓组织放入含30%蔗糖的PB内4℃至沉底。恒温冷冻箱进行冷冻后切片机(美国AO产)作连续冠状冰冻切片, 片厚40 μm, 收集于0.01 mol/L磷酸盐缓冲生理盐水内(PBS, pH值7.4, 下同)。进行抗HSP70免疫组织化学可溶性复合物(Avidin-biotin-HRP complex, ABC)ABC反应。并进行以下各步:经磷酸盐缓冲生理盐水进行充分漂洗, 0.3%H2O2甲醇溶液室温30 min, 含0.1%TritonX-100的正常羊血清(1:50)30 min, 入鼠抗HSP70(1:1500)4℃48 h, 生物素化羊抗鼠IgG(1:200)室温3 h, ABC液(1:200)室温3 h, DAB呈色。上述各步后均用PBS液充分漂洗3×10 min, 常规贴片、干燥、透明、封片。切片观察与记数和处理数据,三部分T12受损脊髓组织分别制作切片3张, 共9张进行记数。在10×10光镜下, 采用武昌光学仪器厂C5型0.5网形目测镜尺(划刻面积为5 mm×5 mm), 任一测点外上角和测线(横线)交叉的阳性神经元HSP70阳性神经元(核着色均匀、深染、边界清晰)作为计数终值, 单位为个/目测视野。
1.3统计学方法 所有资料均采用SPSS18.0进行统计。计量资料以均数±标准差表示, 采用t检验, P<0.05表示差异具有统计学意义。
2 结果
2.1HE染色 ASCI后注射NS组和NO组光镜下见脊髓组织水肿、出血, 出血主要位于灰质及灰质与白质交界处,灰白质交界清楚, 神经元肿胀、轮廓不清、破裂、溶解,胞质尼氏体边聚, 有噬神经现象(neuronophagia), 见图1;ASCI后注射MP组镜下见脊髓组织水肿、出血较NS组明显减轻, 见图2。
2.2光镜下观察脊髓损伤模型脊髓HSP70 阳性神经元HSP70的细胞在显微镜下是棕色的, 是一个圆形、椭圆形或三角形, 突起明显, 背景浅棕色。NO组和NS组HSP70呈散在分布的低水平表达;STS组和MP组HSP70则表达显著增强, 多数色泽均匀, 边界清楚, 数目明显高于NO组和NS组。各组前角阳性神经元HSP70差异明显且分布集中, 选择前角作为计数统计部位, 而HSP70后角分布少量, 中央管区域周围分布更少, 见图2。
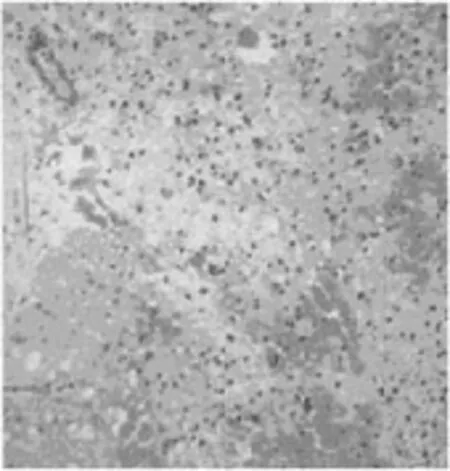
图1 伤后8 h STS组大鼠脊髓损伤HE×200

图2 伤后8 h MP组大鼠脊髓损伤HE×200
2.3NO组、NS组、MP组、STS组伤后1、2、4、8 h免疫组化HSP70表达 NO组分别见图A、B、C、D;NS组分别见图E、F、G、H;MP组分别见图I、J、K、L;STS组分别见图M、N、O、P。

A NO组伤后1 h免疫组化HSP70表达SP×400

B NO组伤后2 h免疫组化HSP70表达SP×400
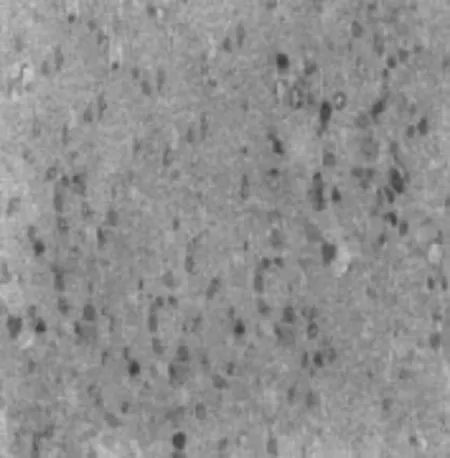
C NO组伤后4 h免疫组化HSP70表达SP×400

D NO组伤后8 h免疫组化HSP70表达SP×400

E NS组伤后1 h免疫组化HSP70表达SP×400

F NS组伤后2 h免疫组化HSP70表达SP×400

G NS组伤后4 h免疫组化HSP70表达SP×400

H NS组伤后8 h免疫组化HSP70表达SP×400

I MP组伤后1 h免疫组化HSP70表达SP×400

M STS组伤后1 h免疫组化HSP70表达SP×400

J MP组伤后2 h免疫组化HSP70表达SP×400

N STS组伤后2 h免疫组化HSP70表达SP×400
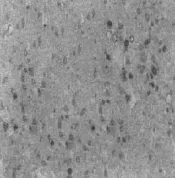
K MP组伤后4 h免疫组化HSP70表达SP×400
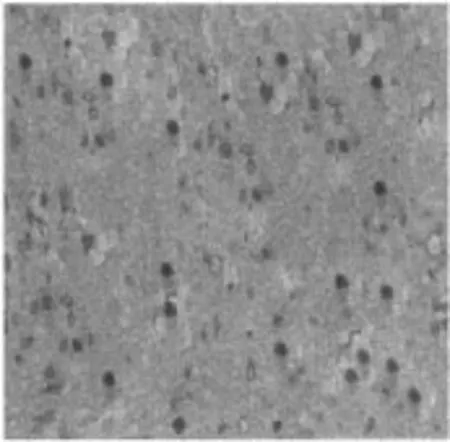
O STS组伤后4 h免疫组化HSP70表达SP×400
L MP组伤后8 h免疫组化HSP70表达SP×400

P STS组伤后8 h免疫组化HSP70表达SP×400
2.4HSP70分布密度变化进行统计分析
2.4.1各组进行组内比较 ①将NO组进行单因素的方差分析:Levene 统计量=2.017, P=0.129>0.05, 满足方差齐性。则F=0.084, P=0.968>0.05。急性脊髓损伤大鼠不做任何处理的情况下, 在造模后1、2、4、8 h脊髓组织中HSP70随着时间推移其表达差异无统计学意义(P>0.05)。②将NS组进行组内比较, 采取单因素的方差分析, Levene 统计量=1.989, P=0.133>0.05, 满足方差齐性。则F=0.183, P=0.907>0.05, 说明急性脊髓损伤模型大鼠在运用生理盐水的情况下, 在造模后1、2、4、8 h脊髓组织中HSP70差异无统计学意义(P>0.05)。③将STS组进行组内比较, 采取单因素方差分析, Levene统计量=0.583, P=0.63>0.05, 满足方差齐性条件。F=4.179, P=0.012<0.05, 急性脊髓损伤模型大鼠在注射丹参酮ⅡA情况下, 在造模后1、2、4、8 h脊髓组织中HSP70表达在不同时段中差异有统计学意义(P<0.05)。④将MP组进行组内比较,采取单因素方差分析, Levene 统计量=0.687, P=0.566>0.05,满足方差齐性。F=10.841, P=0.000<0.01, 急性脊髓损伤模型大鼠在注射强的松龙情况下, 在造模后1、2、4、8 h脊髓组织中HSP70表达差异有统计学意义(P<0.01)。
2.4.2各组对8 h时脊髓组织中HSP70进行组间比较①对NS组和NO组运用单样本的t检验, 结果显示:F=0.006, P=0.937>0.05, 满足方差齐性。则t检验显示:P=0.074>0.05。提示:NS组与NO组对脊髓组织中HSP70表达差异无统计学意义(P>0.05)。②STS组与NO组进行组间运用单样本的t检验, 结果显示:F=0.080, P=0.781>0.05, 满足方差齐性。则t检验显示:P=0.003<0.01。可以判断两组之间差异有统计学意义(P<0.05), 提示:STS组对脊髓组织中HSP70表达作用优于NO组。③对STS组和NS组运用单样本的t检验, 结果显示:F=0.498, P=0.490>0.05, 满足方差齐性。则t检验显示:P=0.022<0.05。可以判断两组之间差异有统计学意义(P<0.05)。提示:STS组对脊髓组织中HSP70表达作用优于NS组。④对MP组和NO组运用单样本的t检验, 结果显示:F=2.15, P=0.16>0.05, 满足方差齐性。则t检验显示:P=0.000<0.01, 可以判断两组之间差异有统计学意义(P<0.01), 提示:MP组对脊髓组织中HSP70表达作用优于NO组。⑤对MP组和NS组运用单样本的t检验, 结果显示:F=3.643, P=0.072>0.05, 满足方差齐性。则t检验显示:P=0.000<0.01, 可以判断两组之间差异有统计学意义(P<0.01), 提示:MP组对脊髓组织中HSP70表达作用优于NS组。⑥对STS组和MP组运用单样本的t检验, 结果显示:F=1.219, P=0.284>0.05, 满足方差齐性。则t检验显示:P=0.033<0.05, 可以判断两组之间差异有统计学意义(P<0.05),提示强的松龙对脊髓组织中HSP70表达作用优于丹参酮ⅡA。HSP70在各组的分布密度比较, 见表1。
表1 HSP70在各组的分布密度比较
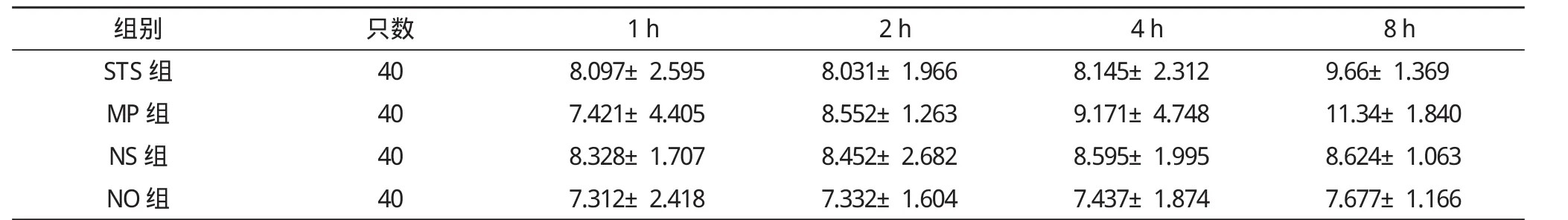
表1 HSP70在各组的分布密度比较
注:STS组表示丹参酮ⅡA组, MP组表示强的松龙组, NO组表示不给药组, NS组表示生理盐水组。组内比较:STS组:P<0.05, MP组:P<0.01, NS组:P>0.05, NO组:P>0.05;组间比较:NS组与NO组比较, P>0.05;STS组与NO组比较, P<0.01;STS组与NS组比较, P<0.05;MP组与NO组比较, P<0.01; MP组与NS组比较, P<0.01;STS组和MP组比较, P<0.05
组别只数1 h2 h4 h8 h STS组408.097±2.5958.031±1.9668.145±2.3129.66±1.369 MP组407.421±4.4058.552±1.2639.171±4.74811.34±1.840 NS组408.328±1.7078.452±2.6828.595±1.9958.624±1.063 NO组407.312±2.4187.332±1.6047.437±1.8747.677±1.166
3 讨论
热休克蛋白(HeatShockProtein, HSP)广泛存在于各种生物体中, 是一簇进化上十分保守的蛋白质, 介入诱导蛋白质的转位、折叠、装配等过程, 但这种蛋白质不能成为新合成蛋白质的组成部分, 这种功能称为“分子伴侣”(molecularchaperones)。人类以70KD的一组HSP为主,因而被称为HSP70。在受热、缺血、缺氧、病毒感染、机械性损伤后产生一种应激性具有保护性蛋白。本实验对机械性脊髓损伤中HSP70的作用进行了研究, 发现损伤后该蛋白随时段的上升而表达增加。研究表明[2]HSP70的表达可以作为预示受损神经元能否存活的一个标志。大多数人认为在中枢神经系统损伤的研究中检测HSP70的表达可以作为评价某种预防或治疗方法对中枢神经系统损伤是否有效以及判别神经元是否受到损伤的早期方法[3,4]。
丹参酮ⅡA-磺酸钠( sodium tanshinone ⅡA sulFonate, STS)是一种唇型科目类别中药丹参经磺化分离而得的一种水溶性物质, 化学主要成分有隐丹参酮、丹参酮ⅡA、丹参酮甲酯、异丹参酮、羟基丹参酮ⅡA以及丹参新酮等[5]。
脊髓在缺血及缺血再灌注过程中发生了比较明显的脂质过氧化反应, 再灌注后脂质过氧化反应将进一步加重。相关研究表明:丹参酮可改善能量代谢并且清除氧自由基、调节局部离子环境通过活血化瘀作用[6]。STS对于抑制血小板聚集、降低血液黏度有较大的影响[7]。抗血小板聚集、抑制血栓形成作用明显, 其中抗血小板聚集作用较抗凝血作用更加明显。此外, STS能减轻脑缺血组织的炎症反应并显著降低脑缺血-再灌注后的血管内皮细胞表面的表达[8]。相关研究证明:丹参酮具有促进大鼠脑缺血后神经干细胞增殖作用[9]。丹参酮通过减少HIF21ɑ的表达改善脊髓缺血再灌注损伤的局部组织微循环, 促进血管内皮生长因子的表达,对脊髓缺血再灌注损伤起到积极的防治作用[10]。林翔等[11]运用丹参酮治疗脊髓缺血型再灌注损伤大鼠模型脊髓、血清谷氨酸含量的影响, 结果显示丹参酮能降低脊髓缺血再灌注损伤大鼠脊髓谷氨酸含量, 对大鼠脊髓缺血再灌注损伤具有保护作用。
总结丹参酮ⅡA具有以下作用:①天然抗氧化作用。②抗菌抗炎作用。③抗凝抗血小板作用。④促进受损组织微循环。MP与丹参酮ⅡA在理论上对急性脊髓损伤具有相同作用, 丹参酮ⅡA在治疗脊髓缺血再灌注损伤也有相关报道,但目前国内外对丹参酮ⅡA治疗急性脊髓损伤方面的研究尚属空白。
甲基强的松龙近年来在临床上广泛应用于急性脊髓损伤的早期治疗[12]。临床上甲基强的松龙所使用的剂量和方法被大多数医生所推崇, 但其主要治疗作用机理为抗脂质过氧化作用, 随着深入研究, 急性脊髓损伤研究(NASCISⅡ)的结果发表后对此结果有很大的争议。甲基强的松龙在急性脊髓损伤后5 min就可以产生脂质过氧化物, 1 h后达到峰值[13]。大多从以下几点进行[14]:①抗氧化作用。甲基强的松龙脂质抗氧化作用被认为在脊髓损伤过程中最基础也是最重要的作用, 研究认为其抗氧化而抑制脂质过氧化物的生成, 保护了生物膜的完整性。使得在脊髓损伤后相对较好的能量生成、血液循环并保护了脊髓组织的完整性。②减少脊髓损伤的组织缺少。③改善受损伤段脊髓的血流。有相关学者在动物研究中发现, 脊髓损伤后局部血流在应用甲基强的松龙后血流明显高于对照组[15]。④抗炎症作用。⑤免疫抑制作用。
临床常规治疗脊髓损伤时, 需要应用比传统给药量更大的剂量方能奏效, 而且大剂量应用还能对脊髓损伤有遏制创伤后神经退行性病变的作用。甲基强的松龙的神经保护作用独立于糖皮质激素活性;药理特征需要大剂量给药;二相模型剂量反应曲线;需要早期治疗(创伤后8 h以内)。
急性脊髓损伤后热休克蛋白作为主要的伴侣蛋白之一,生物细胞在受热、缺血、缺氧、病毒感染、机械性损伤后产生的具有保护作用的应激蛋白, 所以产生表达。表达后机体在相应机制下保护和修复机体受伤细胞。所以HSP70是急性脊髓损伤后受损程度和损伤修复的指标之一。应用药物后促使该蛋白显著表达, 两种药物在机理上相同, 甲基强的松龙是脊髓损伤后首选用药, 所以选择其作为对照组。而丹参酮ⅡA并未在脊髓损伤临床上广泛应用, 实验研究上治疗脊髓损伤尚属空白, 本实验表明该药物亦能增加HSP70显著表达, 在临床和科研上具有研究意义。
本研究表明:①脊髓损伤后各组的HSP70表达均呈增加趋势。STS组和MP组HSP70随时段上升阳性神经元细胞表达上升, 亦呈连续性, 但STS组数值虽低于MP组数值, 但具有可比性。所以二者在急性脊髓损伤后HSP70阳性神经元表达层面上具有相同作用。②急性脊髓损伤过程中神经元受到损伤致使HSP70表达增高是产生应激性保护的一种标志, 该标志在HSP70表达中对受损神经元起到保护作用, 也使得HSP70在ASCI后表达增强。ASCI后机体同时发生了损伤性HSP70增加说明机体对损伤性刺激能够快速做出保护性反应。所以丹参酮ⅡA就HSP70表达层面与甲基强的松龙相同。
实验证实了丹参酮ⅡA对大鼠脊髓损伤后在原有基础上HSP70表达明显升高, 也证明了丹参酮ⅡA可以影响大鼠脊髓损伤后的应激性反应。同时, HSP70也不仅仅是脊髓损伤的唯一指标, 如更确切的接近客观规律, 也可以从其他方面继续研究脊髓损伤如:mRNA、NOS等。只能从HSP70角度上对大鼠脊髓损伤的机理做一推断, 但为了更确切的了解丹参酮ⅡA对脊髓损伤的治疗效果, 还需更直观、客观的证实治疗作用的存在。
[1] 李一帆, 陈东.急性大鼠脊髓损伤Allen’s法模型的改良及电生理评价.中国实验诊断学杂志, 2010, 14(8):1169-1172.
[2] 管阳太.热休克蛋白在缺血性脑损伤中的作用.国外医学(脑血管疾病分册), 1994, 2(3):142.
[3] 崔荣太.红藻氨酸诱导大鼠癫痫发作脑组织HSP70表达的免疫组化及免疫印迹分析.中风与神经疾病杂志, 1998 , 15(5): 277.
[4] Matz PG.大鼠实验性脑出血后脑胶质细胞及神经元血红素氧合酶21及HsP70 的诱导(文摘) .国外医学(脑血管疾病分册), 1997, 5(3):176.
[5] 李双, 王琳.丹参酮ⅡA-磺酸钠注射液的药理及临床应用进展.中药与临床, 2011, 2(3):61-63.
[6] 邬浩杰.丹参的药理作用研究.浙江中医药大学学报, 2008, 32(5):694-695.
[7] 张玉芳, 赵春景.丹参酮ⅡA及其钠盐的药理研究进展.中国药业, 2008, 17(1):1.
[8] 胡敏霞, 周密妹, 胡先敏, 等.丹参酮ⅡA预防性给药对脑缺血损伤炎症反应的影响.中国药理学通报, 2006, 22(4) :436.
[9] 陈岩, 李志伟, 杨谦, 等.丹参酮对大鼠脑缺血后神经干细胞增殖影响的研究.陕西医学杂志, 2011, 40(7):774-775.
[10] 伏勇, 黄志高, 张俐, 等.丹参酮对脊髓缺血再灌注损伤HIF121α和VEGF 的作用及机制.中国中医骨伤科杂志, 2010, 18(05):5-12.
[11] 林翔, 张俐, 刘蔚楠, 等.丹参酮对脊髓缺血再灌注损伤大鼠模型脊髓、血清谷氨酸含量的影响.海峡药学, 2010, 22(5):49-51.
[12] 李培建, 哥少汀.脊髓损伤实验研究的观察方法.中华外科杂志, 1997, 35(4):254-256.
[13] 张强, 廖维宏, 吴亚民, 等.大剂量甲基强的松龙对大鼠脊髓损伤后脊髓细胞凋亡的影响.中国康复医学杂志, 2000, 15(4): 218-220.
[14] 贾连顺.甲基强的松龙对急性脊髓损伤治疗与预防性用药的研究.中国脊柱脊髓杂志, 2005, 15(7):392-393.
[15] Hsu CY, Dimitrijevic MR.Methylperdnisolone and spinal cord injury:the possible mechanism oF action.J Neurotrauma, 1990 , 7(3):115-119.
2014-05-29]
550002 贵阳中医学院第一附属医院急诊科
