鄱阳湖沉积物中磷吸附释放特性及影响因素研究
2014-07-16徐进徐力刚龚然丁克强
徐进 ,徐力刚 ,龚然,丁克强
1. 南京工程学院环境工程学院, 江苏 南京 211167;2. 中国科学院南京地理与湖泊研究所湖泊与环境国家重点实验室,江苏 南京 210008
沉积物是水体中营养物质最大的源和库(Perkins和Underwood, 2001; House和Denison,2000; Welch和Cooke, 1999)。在一定条件下,它们可以成为湖泊富营养化的主导因子。湖泊沉积物-水界面间进行频繁的物质交换,主要分为沉积和释放两个过程。底泥再悬浮是内源磷释放的主要来源(Sφndergaard等, 2003; Laenen和 Le Teourneau,1996 )。沉积物磷对湖泊富营养化的作用,主要表现在磷的释放(Koop和Boynton, 1990; Sφndergaard和Jensen, 2001; 刘臣炜和汪德爟, 2006)。其中沉积物中化学释磷方式较多,主要来自三价铁氧化物的还原、金属阳离子的螯合与络合、有机质矿化等(Mortimer, 1941; 朱广伟等, 2003; 章婷曦等,2007)。生物释磷主要是溶解性有机磷化合物被细菌氧化分解成无机磷,经藻类的吸收又转化为新的有机体,沿食物链转移至高级生物体内。有研究表明,底泥再悬浮提高了系统内溶解氧的含量,应该有利于底泥对磷的吸附和固定。如范成新等(范成新等,2003)对太湖水-土界面磷的迁移规律进行研究时发现,太湖西南湖心是太湖两大磷汇区之一。但也有研究认为,由于底泥再悬浮也促进了底泥与水体的混合和交换,而这种作用被认为对磷释放的促进作用远大于系统内增加的溶解氧量对磷的吸附和固定作用。影响沉积物磷释放的影响因素很多,主要有溶解氧、pH值、光照、温度等。一般认为,湖泊底部的氧化状态能制约磷的释放。Appan和Ting(1996)研究表明,好氧状态下,磷酸盐的释放速率最大可以达到1.24 mg/(m2·d),但厌氧状态下,则可达到3.30 mg/(m2·d)。但沉积物不同时,这种影响也显著不同。水温对磷循环的影响包括化学、生物和物理方面的作用,通过改变沉积物-水界面之间的磷平衡关系得以实现。pH值是水质的重要指标,它对土壤-水界面的物理化学过程有重要影响(Paul,1991; 林建伟等, 2005)。不同影响因素对磷在底泥-水界面的迁移转化的影响不同,但迄今为止,人们对底泥再悬浮究竟是水体中磷的“源”效应还是“汇”效应,其强度如何?存在较大的争议。因此,还需要大量的试验工作来对此进行深入研究。此外,国内外有关湖泊沉积物氮磷营养盐及有机质时空分布特征已经有了大量报道,但针对鄱阳湖这种特定生态水文特征及地理环境条件背景下,磷在上覆水-底泥界面迁移转化的规律和环境因素对迁移转化过程的影响鲜见报道。本研究工作旨在揭示不同环境因子对湖泊沉积物磷迁移的生态环境效应,对于正确认识、合理评估环境因素对湖泊水体磷的影响提供更为充分恰当的试验依据和理论解释,对于维持湖泊湿地功能及生态健康的优化调控具有重要的实践价值和科学意义。
1 材料与方法
1.1 研究区域概况
鄱阳湖位于江西省北部,上承赣、抚、信、饶、修五河之水,下接中国第一大河——长江。在正常的水位情况下,鄱阳湖面积有3 914 km2,容积达300亿m3。随着江西省社会经济的快速发展,鄱阳湖水体富营养化进一步加剧,严重了影响鄱阳湖的水环境。对鄱阳湖污染的控制与治理成为当前急待解决的重大环境问题之一。因此,本论文通过控制在不同环境因素条件下,上覆水中磷的变化规律的探讨,阐明磷在上覆水-沉积物界面迁移转化的规律和环境因素对迁移转化过程的影响。
1.2 土壤基质理化性质
从鄱阳湖底沉积物中取回土壤基质,将土壤经风干、碾碎、过200目筛处理后,测定其pH值、含水率(称重法)、总磷及磷分级(鲁如坤, 2000),结果见表1。
1.3 磷的吸附动力学实验
取200目的风干土样1 g,放入250 mL的三角瓶中,加入100 mL 50 mg·L-1的KH2PO4溶液,置于温度为(25±1) ℃、转速为130 r/min的恒温振荡器中恒温振荡。分别在5,10,20,30,50,70,100和150 min后取适量溶液,用钼锑抗分光光度法测定上清液中的磷质量浓度(《水和废水监测分析方法》编委会, 1989),确定磷吸附达到平衡的时间。
1.4 磷的吸附等温线试验
取200目的风干土样1 g,分别加入磷质量浓度梯度分别为 2, 4, 8, 16, 24, 32和 40 mg·L-1(KH2PO4溶解于0.01 mg·L-1KCl溶液中配置而成)的7支离心管中,后分别加入20 mL磷标准溶液,每管中滴加2滴氯仿,防止微生物作用。各离心管加盖密封,于恒温振荡器上振荡24 h,待平衡后,静置1 h,3500 r·min-1下离心10 min,上覆水滤膜过滤后测定溶解活性磷质量浓度。
1.5 不同环境因素下土壤磷含量的变化规律
1.5.1 pH值
取200目的风干土样50 g,分别放入8个250 mL的三角瓶中,分别加入100 mL pH值为3.04,4.00,5.03,6.04,7.00,8.06,9.03 和 10.01 的含KH2PO4质量浓度为 50 mg·L-1的溶液,置于温度为(25±1) ℃、转速为130 r·min-1的恒温振荡器中振荡24 h后,静置离心,取其上清液测定上清液中磷含量。
1.5.2 溶解氧
取200目的风干土样300 g,分别加入到4个2 L的烧杯中,而后加入1 L质量浓度为50 mg·L-1的KH2PO4溶液,向其中2个烧杯中插入曝气头曝气,另外两个烧杯密封静置。分别在2,4,8,12,16,24和48 h进行溶解氧和上覆水磷含量的测定。
1.5.3 温度
取200目的风干土样50 g,分别放入6个250 mL的三角瓶中,而后分别加入100 mL质量浓度为50 mg·L-1的KH2PO4溶液,控制其他条件相同,然后将三角瓶分别置于温度为(5±1) ℃,(20±1) ℃和(30±1) ℃的恒温振荡器中振荡,分别在2,4,8,12,16,24和48 h进行取样,然后静置离心,取其上清液测定上清液中磷含量。
2 结果与讨论
2.1 沉积物与上覆水中磷素平衡实验
图1为不同反应时间梯度条件下土壤-水界面上覆水中磷质量浓度。由图1可看出,吸附初始阶段,当吸附时间为5 min时,起始上覆水磷质量浓度较高,为 8.714 mg·L-1,而此时的底泥基质磷质量分数才为0.025 mg·g-1,上覆水磷质量浓度与底泥基质磷质量分数相差较大,导致起始吸附速率很高;随着反应时间的推进,上覆水质量浓度下降,同时底泥质量分数上升,两者梯度差距随之减小;当吸附时间达到20 min时,上覆水磷质量浓度已经下降到 8.686 mg·L-1,吸附速率下降较快;随后吸附速率开始放缓,直到30 min时,此时上覆水的平衡质量浓度为 8.648 mg·L-1,此时两者含量达成平衡状态。

表1 土壤基本理化性质Table 1 Soil physical and chemical properties

图1 不同反应时间的上覆水磷质量浓度Fig.1 Phosphorus concentrations of overlying water
2.2 磷的吸附等温线试验
图2为土壤磷吸附等温线图。由吸附等温线可以看出平衡质量浓度与吸附量之间的关系。当平衡质量浓度为0.732 mg·L-1时,土壤吸附量很小,仅仅0.025 mg·L-1;当平衡质量浓度从0.732 mg·L-1增加到2.673 mg·L-1时,即增加量为1.94 mg·L-1时,上覆水磷质量浓度升到0.047 mg·L-1,其增量为0.021 mg·L-1;而当平衡质量浓度从22.735 mg·L-1增加到36.257 mg·L-1时,增量为13.522 mg·L-1时,对应的上覆水磷质量浓度增量为0.0230 mg·L-1,增速较慢。因此,随着平衡质量浓度逐渐增加,土壤吸磷量刚开始增加较快,随后增加趋势逐渐减缓直至磷饱和。

图2 磷的吸附等温线Fig.2 Phosphorus adsorption isotherm

图3 Langmuir吸附等温曲线Fig.3 Langmuir adsorption isotherm
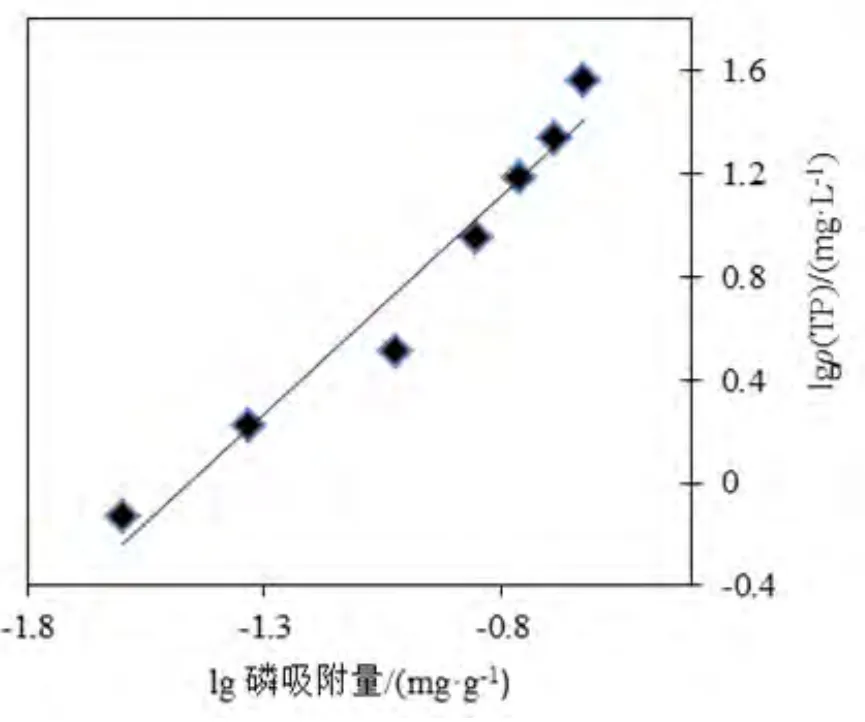
图4 Freundlich吸附等温曲线Fig.4 Freundlich adsorption isotherm
图3, 4分别采用 Langmuir等温方程与Freundlich吸附等温方程对土壤吸附特性进行拟合。用Langmuir方程拟合相关系数达到0.9925(R=0.9962),标准偏差为 4.3923;Freundlich方程拟合相关系数为 0.9615(R=0.9805),标准偏差为0.1340;用Langmuir方程拟合土壤对磷的吸附,相关系数较高,拟合度较好。各吸附等温线的拟合方程特性见表2。
2.3 不同环境因素下土壤基质与上覆水之间磷含量变化
2.3.1 pH值
由图5,当pH为3.0左右时,上覆水磷质量浓度为0.086 mg·L-1;当pH升到7.0左右时,上覆水磷质量浓度随之增加到 0.190 mg·L-1;当 pH达到10.0时,上覆水质量浓度为0.257 mg·L-1。由此可见,pH越小,即酸性越强,上覆水质量浓度越低,沉积物对磷的吸附作用越强。在酸性范围内,底泥吸收趋势很明显;pH越小,吸收强度越大,即上覆水中磷质量浓度下降趋势特别明显。在碱性范围内,底泥吸收程度明显下降,且pH越大,上覆水中TP质量浓度越大,强碱条件下,TP吸收量剧减。在酸性范围内,TP呈大量吸收状态,其原因可能是H+可使矿物表面基因质子化而有利于磷的吸附,H+质量浓度越大,其吸附能力就越强,所以pH越小,吸收强度越大。pH值接近中性范围内,磷酸盐主要以HPO42-和HPO4-存在,最易与底泥中的金属元素结合而被底泥吸附,如 Al离子可水解成胶体状Al(OH)3,它具有很大的比表面积和强的吸附水相中正磷酸盐的能力,所以TP吸收量较大。pH值在强碱范围时,TP的吸收主要是以离子交换为主,体系中的OH-与沉积物中的铁、铝磷酸盐复合体中的磷酸盐发生交换,使磷酸盐的吸收过程减弱,降低了磷从上覆水中的吸收速率。因此,pH值升高时,底泥磷吸收减少,OH-质量浓度大量存在,同底泥胶体中的阴离子相互竞争吸附位置,从而使底泥对磷酸盐的吸附量大大降低。

表2 Langmuir和Freundlich吸附等温线模型拟合Table 2 Model fitting of Langmuir and Freundlich adsorption isotherm

图5 不同pH值条件下上覆水磷质量浓度Fig.5 Phosphorus concentrations under different pH
2.3.2 溶解氧

图6 好氧、厌氧条件下,上覆水中磷质量浓度Fig.6 Phosphorus concentrations of overlying water under aerobic or anaerobic condition
由图6可知,未曝气组的上覆水中磷含量远高于曝气组中的磷含量。当反应时间为2 h时,好氧条件下,上覆水总磷含量为 3.114 mg·L-1;厌氧条件下,上覆水总磷含量为 8.162 mg·L-1;而当反应进行到4 h时,好氧条件下的上覆水总磷含量迅速下降到 0.819 mg·L-1,期间总磷含量减少了 2.295 mg·L-1;此时厌氧条件下的上覆水总磷含量为7.800 mg·L-1,仅仅减少了 0.362 mg·L-1;两者相差了近1.900 mg·L-1,说明在好氧条件下,沉积物对磷的吸附远远高于厌氧条件下沉积物的吸附。在曝气条件下,上覆水体与底泥充分接触,使得底泥能够充分吸收上覆水中的磷,导致上覆水体中的总磷含量大大下降;另外,在高溶解氧水平下,有利于Fe2+氧化成 Fe3+,Fe3+与磷酸盐结合形成难溶的磷酸铁,使得好氧状态下底泥对磷的吸收作用加强,而Fe3+在中性或碱性条件下,生成的[Fe(OH)3]x胶体也会吸附水中的游离性磷,所以在高溶解氧水平条件下,底泥从上覆水中吸收磷的作用很明显(Appan和Ting, 1996)。好氧条件下,当反应进行到12 h时,上覆水磷质量浓度为0.533 mg·L-1,16 h时,上覆水磷质量浓度为0.514 mg·L-1,48 h时,上覆水磷质量浓度为 0.505 mg·L-1。此组数据说明在反应进行到12 h时,沉积物对磷吸附已经基本完成,随后反应的12 h,土壤对磷基本没有吸附作用,已经达到吸附饱和;而实验进行到48 h时,上覆水磷质量浓度也基本保持不变。因此,在好氧条件下,反应在4 h内,沉积物对磷的吸附速率最高,随后吸附量很小直至逐渐饱和。
厌氧条件下,当反应进行到8 h时,上覆水磷质量浓度为7.657 mg·L-1;即反应时间从4 h到8 h这4 h内,上覆水磷质量浓度仅下降了0.143 mg·L-1,至24 h时,上覆水磷质量浓度为7.657 mg·L-1;至48 h时,上覆水磷质量浓度仍为7.657 mg·L-1。此说明,厌氧条件下,沉积物对磷的吸附非常有限,反应了48 h,上覆水中磷质量浓度才减少了0.505 mg·L-1,沉积物对磷的吸附作用不明显;当反应时间达到24 h后,上覆水磷质量浓度保持不变,此时沉积物磷吸附达到饱和。
在没有曝气条件下,底泥与上覆水体的接触不很充分,上覆水体中磷含量下降不是很明显;此外,在低溶解氧水平下,底泥中Fe3+还原成Fe2+,一方面使得PO43-脱离原来的沉淀状态进入上覆水体,另一方面[Fe(OH)3]x胶体转化成可溶的Fe(OH)3,同时释放吸附于其上的游离 P,导致上覆水体中总磷质量浓度下降不明显。由此可见,高溶解氧水平对于控制底泥向上覆水体释放磷,维持水体较低总磷是必要的。
2.3.3 温度
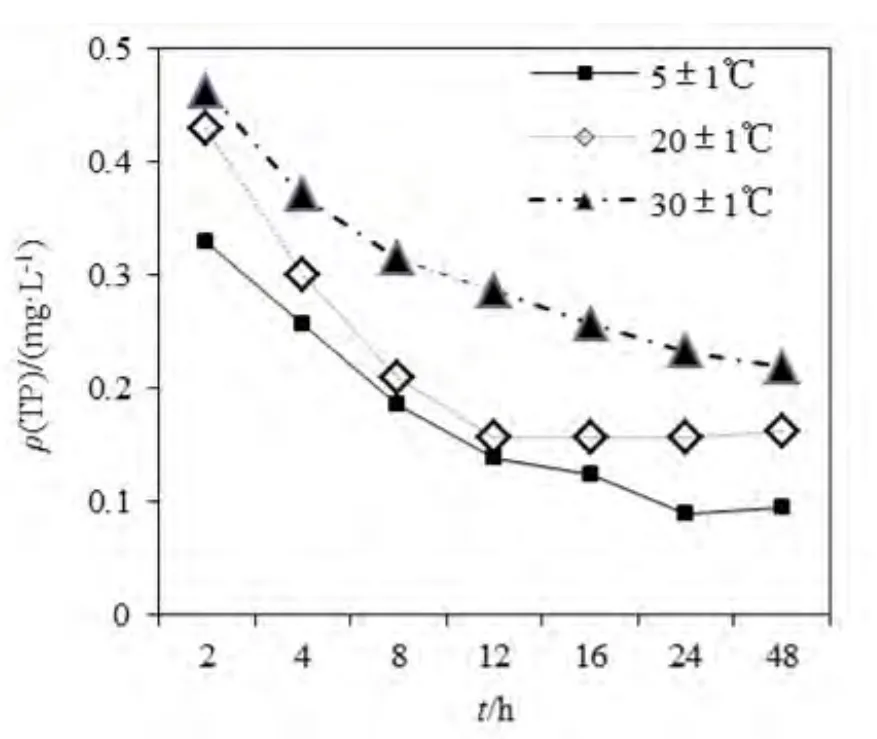
图7 不同温度条件下,上覆水中磷质量浓度Fig.7 Phosphorus concentrations of overlying water under different temperatures
温度的增加,可以显著减少沉积物磷的吸附作用。由图7可知,在温度30 ℃时,底泥对磷的吸收速度最慢,低于20和5 ℃时的磷吸收速度。在反应刚开始阶段,不同温度沉积物对磷的吸附量相差不大。在反应进行了2 h、温度为30 ℃时,上覆水磷质量浓度为0.4620 mg·L-1;与此同时,温度为20和 5 ℃时,上覆水磷质量浓度分别为 0.429和0.329 mg·L-1。在反应了8 h后,温度为30, 20和 5 ℃时,对应的上覆水磷质量浓度分别为 0.314,0.210和0.186 mg·L-1。由此可见,温度为5 ℃时,上覆水磷质量浓度最低,沉积物吸附磷效果最明显。并且由图可看出,当反应时间从0到16 h期间,温度为20 ℃和5 ℃对应的上覆水磷质量浓度较低,而且其变化趋势线基本平行;即在此反应阶段下,两种温度的上覆水磷质量浓度变化差别不大;随后反应中,温度为5 ℃条件下的上覆水磷质量浓度继续快速下降,而温度为 20 ℃条件下的上覆水磷质量浓度基本不再降低,亦即沉积物对磷的吸附基本达到平衡。在3种温度条件下,各自上覆水磷质量浓度变化值不同;当反应24 h后,三者均达到吸附平衡。因此,当上覆水的磷质量浓度较低时,高温条件下基质的磷释放速度会高于低温条件下的磷释放速度,所以许多水体到了夏季往往容易出现富营养化增强的状况。原因是随着温度升高,微生物活性增强,好氧增多,溶解氧减少,从而使氧化还原电位降低,发生Fe3+-Fe2+化学反应,Fe-P得以释放,导致沉积物释放的磷量会逐渐增多。尤其,温度对含 Ca沉积物的影响最大,因为随着温度升高,有机质矿化加强,产生大量的CO2,则含Ca沉积物会加速溶解,沉积物中磷的释放也相应加快。当水体温度升高时,藻类植物繁殖加快,减少了上覆水体中磷的质量浓度,增加了对磷的需求,从而使平衡向着有利于磷释放的一方移动,促进沉积物中磷的释放(周启星等, 2004)。无论厌氧还是好氧状态,当温度上升 1~3 ℃,将使底泥中总磷的释放增加9%~57%( Liikanen, 2002);同时水生生物活动加剧,也促进了沉积物磷的释放。
3 结论
1)在酸性范围内,底泥吸收趋势很明显,且pH越小,吸收强度越大,即上覆水中磷质量浓度下降趋势特别明显。在碱性范围内,底泥吸收程度明显下降,且pH越大,上覆水中TP质量浓度越大,强碱条件下,TP吸收量剧减。
2)在高溶解氧水平条件下,水体中的总磷含量较低,底泥从上覆水中吸收磷的作用很明显;在没有曝气装置的条件下,上覆水体中的总磷含量很高,底泥与上覆水体的接触不是很充分,导致上覆水体中磷含量下降不是很明显。厌氧条件下,有利于磷在沉积物中的释放和迁移;在好氧状态下,沉积物也会发生磷释放,只是释放速度和释放量要比厌氧状态下小得多,好氧释放的机制主要是沉积物的矿化以及有机物质的好氧分解。
3)当上覆水的磷质量浓度较低时,高温条件下基质的磷释放速度会高于低温条件下的磷释放速度,所以许多水体到了夏季往往容易出现富营养化增强的状况。
《水和废水监测分析方法》编委会. 1989.水和废水监测分析方法[M]. 北京:中国环境科学出版社:243-248.
APPAN A, TING D S. 1996.A Laboratory Study of Sediment Phosphorus Flux in Two Tropical Reservoirs[J].Water Science and Technology,(7/8):45-52.
HOUSE W A, DENISON F H. 2000. Factors influencing the measurement of equilibrium phosphate concentrations in river sediments [J]. Water Research, 34(4):1187-1200.
KOOP K W, BOYNTON F W. 1990.Sediment-water oxygen and nutrient exchanges along a depth gradient in the Baltic Sea[J]. Marine Ecology-Progress Series,63:65-77.
LAENEN A, LETEOURNEAu A P. 1996. Upper klamath basin nutrient-loading study/estimate of wind-induced resuspension of bed sediment during periods of low lake elevation[R]. Portland, Oregon: U S Geological Survey: 95-414.
LIIKANEN A N U. 2002.Effects of temperature and oxygen availability on greenhouse gas and nutrient dynamic sin sediment of an atrophic mid-boreal Lake [J].Biogcochemistry, 9(3):269-286.
MORTIMER C H. 1941.The exchange of dissolved substances between mud and water in lakes [J].Journal of Ecology, 29(2):280-329.
PAUL B C M. 1991.The influence of pH on phosphorus release from lake sediments [J].Water Research, 25(3):309-3l1.
Perkins R G, Underwood G J C.2001.The potential for phosphorus release across the sediment-water interface in an eutrophic reservoir dosed with ferric sulphate [J].Water Research, 35(6):1399-1406.
SΦNDERGAARD M, JENSEN J P, JEPPESEN E. 2003. Role of sediment and internal loading of phosphorus in shallow lake [J].Hydrobiologia,(506/507/508/509): 135-145.
SΦNDERGAARD M, JENSEN J P. 2001. Retention and internal loading of phosphorus in shallow, eutrophic lakes[J].The Scientific World, 1(1):427-442.
WELCH E B,COOKE G D.1999.Effectiveness and longevity of phosphorus inactivation with alum [J].Lake and Reservoir Management,15:5-27.
范成新,张路,秦伯强,等. 2003. 风浪作用下太湖悬浮态颗粒物中磷的动态释放估算[J].中国科学:D辑, 33(8):760-768.
林建伟,朱志良,赵建夫. 2005. 曝气复氧对富营养化水体底泥氮磷释放的影响[J].生态环境, 14(6):812-815.
刘臣炜,汪德爟. 2006. 湖泊富营养化内源污染的机理和控制技术研究[J].农业环境科学学报,25(增刊):814-818.
鲁如坤. 2000.土壤农业化学分析方法[M].北京:中国农业科技出版社:86-103.
章婷曦,王晓蓉,金相灿. 2007. 太湖不同营养水平湖区沉积物中磷形态的分布特征[J]. 农业环境科学学报,26(4):1207-1213.
周启星,俞洁,陈剑,等. 2004 .某城市湖泊中磷的循环特征及富营养化发生潜势[J]. 环境科学,25(5):138-142.
朱广伟,秦伯强,高光. 2003.浅水湖泊沉积物磷释放的重要因子——铁和水动力[J]. 农业环境科学学报,22(6):762-764.
