烟酰胺超载对大鼠血浆内甲基化反应水平的影响
2014-07-10伦永志姚晓坤周士胜
伦永志,孙 杰,骆 宁,姚晓坤,周士胜
(1. 大连大学 医学院 辽宁省高校生物物理学重点实验室,辽宁 大连 116622;2. 大连港医院 检验科, 辽宁 大连 116013)
代谢综合征指一组多种代谢紊乱伴随发生的集群,包括肥胖、胰岛素抵抗、高血压和血脂异常等,是2 型糖尿病和心血管疾病的主要危险因素[1]。近年来,代谢综合征的发病率不仅在成年人群中呈现指数增长,在青少年、儿童群体中也增长显著[1]。虽然关于代谢综合征发生的精确机制仍不清楚,但是逐渐增多的证据提示,氧化应激[2]和甲基化代谢紊乱,如改变的血浆甲基供体[3],同型半胱氨酸[4]和DNA 甲基化样式[5]在代谢综合征的形成过程中发挥重要作用。因此,从氧化应激和不正常甲基化样式方面寻找代谢综合征的成因,将有助于阐明该病的病理机制。
尼亚新(维生素B3,烟酸或烟酰胺)作为一种主要的合成营养素,是NAD 和NADP 的前体物质[6],因此烟酰胺的代谢平衡对于维持细胞的正常功能非常重要。过量的烟酰胺摄入能够触发氧化应激和胰岛素抵抗[7,8]。在烟酰胺负荷实验中已证实,烟酰胺摄入可以显著抑制儿茶酚胺的降解[9]。由此我们推测,高烟酰胺摄入也将影响机体其他甲基化反应。为了验证以上假设,本实验进行了长期烟酰胺大鼠喂养实验,以观察烟酰胺喂养对机体甲基化反应的影响。
1 材料与方法
1.1 实验动物
健康,雄性SD 大鼠,5 周龄,由大连医科大学动物中心提供。实验动物置于室温和光照可控的饲养室内(22±2°C,12/12 h: 6:00 a.m.到6:00 p.m.),自由进食水。
1.2 主要试剂与仪器
烟酰胺(Sigma,美国);N1-甲基烟酰胺(Osaka,日本);N1-ethylnicotinamide,2Py(见文献[10,11]合成);同型半胱氨酸(Sigma,美国);甜菜碱(Sigma,美国);Hypersil ODS C18 column(Thermo,美国);SupelcosilTMLC-SCX column(Supelco,美国);Waters 470 fluorescence detector(Milford,美国);UV3000 detector(Thermo,美国);Bio-Rad model 550-microplate reader(Bio-Rad,美国)。
1.3 动物饲养及组织样本采集
实验大鼠分为三组:对照组和两个烟酰胺负荷组,两个烟酰胺负荷组的鼠粮中分别加入烟酰胺1 或4 g /kg。喂养时间:20 周;饲养期间记录每天饮食量,每周监测体重、血糖,每4 周进行一次糖耐量实验;烟酰胺负荷结束,20 %乌拉坦麻醉,后眼眶静脉丛采血,EDTA 抗凝后离心收集血浆,-80°C 保存。
1.4 血浆学指标测定
1.4.1 烟酰胺、N1-甲基烟酰胺、同型半胱氨酸、甜菜碱测定
样品经预处理后,加入标准品作为内标进色谱分析。
烟酰胺、N1-甲基烟酰胺的流动相配置及样品检测:10 mM 庚烷磺酸钠,50 mM 三乙胺水溶液(pH 3.20),乙腈(78:22 v/v),0.45 μm 微孔滤膜过滤之后,超声脱气30 min;流速:1.0 mL/min;色谱柱:Hypersil ODS C18 column;进样量:20 μL;荧光检测器激发波长为366 nm,发射波长为418 nm。
同型半胱氨酸的流动相配置和样品检测:含30 mL/L 甲醇的0.1 mol/L 醋酸盐缓冲液(pH 4.6),0.45 μm 微孔滤膜过滤后,超声脱气30 min;流速0.8 mL/min;色谱柱:Hypersil ODS C18 column;进样量:20 μL;荧光检测器激发波长为385 nm,发射波长为515 nm。
甜菜碱的流动相配置和样品检测:22 mmol/L 胆碱溶于100 mL/L 双蒸水,加入900 mL/L 乙腈,0.45 μm 微孔滤膜过滤后,超声脱气30 min;流速1.2 mL/min;色谱柱:SupelcosilTMLC-SCX column;进样量:20 μL;紫外检测器检测波长为254 nm。
1.4.2 胆碱测定
胆碱测定按照美国 Biovision 公司生产的Choline/Acetylcholine Quantification kit 试剂盒标准步骤完成,反应生成物于Bio-Rad model 550 酶标仪检测,检测波长570 nm。
1.5 统计方法
数据以均数±标准差(x-±SD)表示,组间采用t检验,多组间采用单因素方差分析,P<0.05 显著性差异。
2 结果
烟酰胺主要利用S-腺苷蛋氨酸介导的甲基化反应,生成N1-甲基烟酰胺进行代谢清除。如图1 所示,大鼠烟酰胺超载的情况下,血浆烟酰胺(图1A),N1-甲基烟酰胺(图1B)和胆碱水平(图1D)升高 ,血浆甜菜碱水平显著下降(图1E)。血浆同型半胱氨酸水平在1 g 烟酰胺喂养的状况下略有下降,4 g 烟酰胺喂养的情况下略有上升(图1C),这些结果均说明,高烟酰胺摄入所诱发的甲基耗竭,影响了机体的甲基代谢平衡。
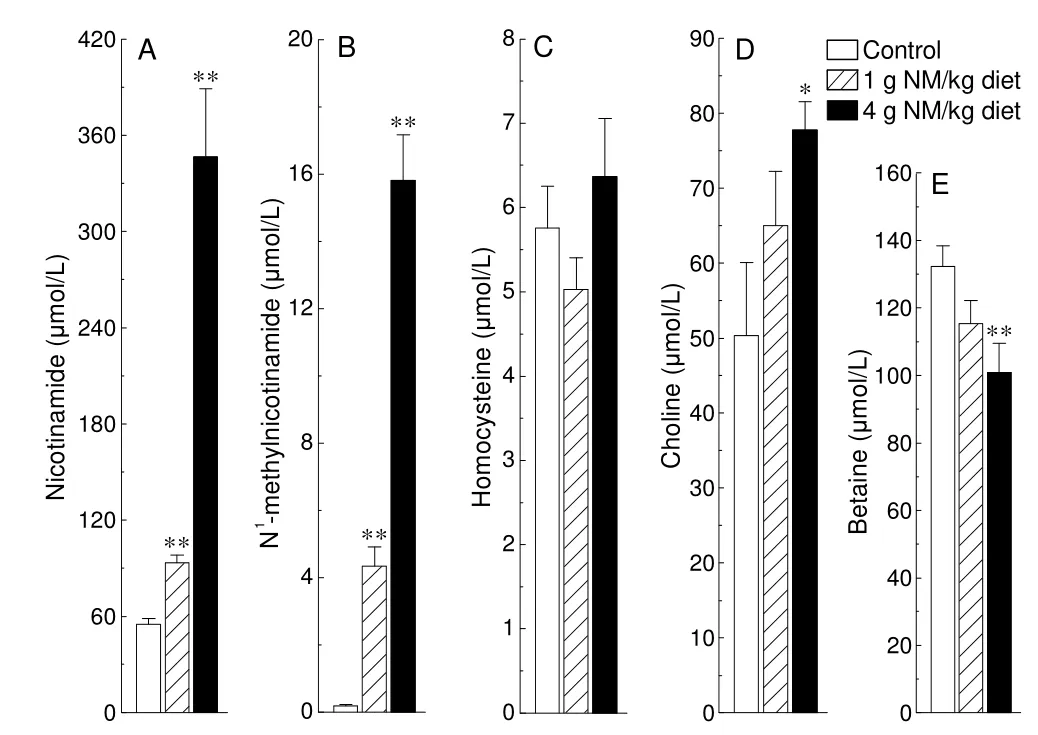
图1 尼克酰胺负荷后,血浆中烟酰胺、N1-甲基烟酰胺、同型半胱氨酸、胆碱与甜菜碱水平
棒状图:mean±SD;NM:尼克酰胺.;*P<0.05,**P<0.001 vs Control
3 讨论
逐渐增多的证据显示,氧化应激[2]和异常的甲基化状态[3-5]在代谢综合征的发生发展中扮演重要角色。可以想象的是,饮食甲基供体的平衡(缺乏或者过量)将对机体甲基化反应产生显著的影响。因此,烟酰胺有可能通过诱导甲基耗竭来影响其他甲基化反应,例如该研究中,烟酰胺喂养后,大鼠甲基供体甜菜碱含量显著下降。相似的是,也有人研究发现,协同服用甜菜碱将缓解尼亚新耗竭S-腺苷蛋氨酸引起肝脏毒性[12]。有趣的是,当大鼠喂养高水平烟酰胺时,血浆另一种甲基供体,胆碱水平显著提升。一般来说,体内胆碱水平的维持由多种途径参与:如两个胆碱获取途径(饮食摄入和PEMT 合成途径)和两个胆碱消耗途径(胆碱氧化和胆汁磷脂酰胆碱分泌),因此任何一条胆碱获取或代谢途径出现异常,将显著影响胆碱平衡[13]。由此我们推测,烟酰胺触发的氧化应激,可能通过诱导细胞膜胆碱前体磷脂酰胆碱的释放,进而提高血浆胆碱水平。
值得注意的是,血浆同型半胱氨酸,在1 g 烟酰胺喂养的情况下呈降低趋势,而在4 g 烟酰胺喂养的状况下反而升高。一些相似的研究也发现,高同型半胱氨酸血症在代谢综合征中很少被观察到,但在其最初的临床结局中,如2 型糖尿病和心血管疾病中却经常被发现[1]。这些现象似乎也反映了,机体的同型半胱氨酸在向蛋氨酸或者胱硫醚转换时具备自身调节能力,并且这种调节也受到许多因素的影响,如血浆同型半胱氨酸的水平被发现伴随年龄的增加而升高[14,15]。并且,由于饮食是决定血浆同型半胱氨酸水平的主要因素[16],因此代谢综合征的患者,即使心血管疾病患者,在进行低甲基消耗物质饮食时,或者具备一个高效的同型半胱氨酸转变为蛋氨酸能力的时候,其血浆同型半胱氨酸水平也将显著降低。从该观点和当前的实验结果分析,血浆同型半胱氨酸水平似乎并不是一个能够良好预测甲基供给和消耗间平衡的良好指标。
烟酰胺的过量摄入诱导的甲基耗竭可能会干扰内源性底物的甲基化代谢,例如影响DNA 甲基化和单胺神经递质的甲基化灭活,因为所有的内源性和外源性底物共用相同的甲基供体库进行甲基化反应。我们近期的研究证实,烟酰胺在进行甲基化降解的同时,会通过抑制儿茶酚胺的甲基化清除,显著增加了血浆儿茶酚胺浓度[9]。之后的研究提示,烟酰胺诱导的自由甲基缺乏将干扰DNA 的甲基化反应,包括全基因组DNA 低甲基化和部分基因启动子核心调控区域甲基样式的改变[17]。
[1] Zhou SS, Zhou YM, Li D, et al. Dietary methyl-consuming compounds and metabolic syndrome [J]. Hypertens Res, 2011, 34(12): 1239-1245.
[2] Roberts CK, Sindhu KK. Oxidative stress and metabolic syndrome [J]. Life Sci, 2009, 84(21-22): 705-712.
[3] Konstantinova SV, Tell GS, Vollset SE, et al. Divergent associations of plasma choline and betaine with components of metabolic syndrome in middle age and elderly men and women [J]. J Nutr, 2008, 138(5): 914-920.
[4] Dominguez LJ, Galioto A, Pineo A, et al. Age, homocysteine, and oxidative stress: relation to hypertension and type 2 diabetes mellitus [J]. J Am Coll Nutr, 2010, 29(1): 1-6.
[5] Gallou-Kabani C, Junien C. Nutritional epigenomics of metabolic syndrome: new perspective against the epidemic [J]. Diabetes, 2005, 54(7): 1899-1906.
[6] Li F, Chong ZZ, Maiese K. Cell Life versus cell longevity: the mysteries surrounding the NAD+ precursor nicotinamide [J]. Curr Med Chem, 2006, 13(8): 883-895.
[7] Li D, Sun WP, Zhou YM, et al. Chronic niacin overload may be involved in the increased prevalence of obesity in US children [J]. World J Gastroenterol, 2010, 16(19): 2378-2387.
[8] Zhou SS, Li D, Zhou YM, et al. B-vitamin consumption and the prevalence of diabetes and obesity among the US adults: population based ecological study [J]. BMC Public Health, 2010, 10: 746.
[9] Sun WP, Li D, Lun YZ, et al. Excess nicotinamide inhibits methylation-mediated degradation of catecholamines in normotensives and hypertensives [J]. Hypertens Res, 2012, 35(2): 180-185.
[10] Hirayama T, Yoshida K, Uda K, et al. High-performance liquid chromatographic determination of N1- alkylnicotina- mide in urine [J]. Anal Biochem, 1985, 147(1): 108-113.
[11] Holman WI, Wiegand C. The chemical conversion of nicotinic acid and nicotinamide to derivatives of N-methyl- 2-pyridone by methylation and oxidation [J]. Biochem J, 1948, 43(3): 423-426.
[12] McCarty MF. Co-administration of equimolar doses of betaine may alleviate the hepatotoxic risk associated with niacin therapy [J]. Med Hypotheses, 2000, 55(3): 189-194.
[13] Craig SA. Betaine in human nutrition [J]. Am J Clin Nutr, 2004, 80(3): 539-549.
[14] Strassburg A, Krems C, Luhrmann PM, et al. Effect of age on plasma homocysteine concentrations in young and elderly subjects considering serum vitamin concentrations and different lifestyle factors [J]. Int J Vitam Nutr Res, 2004, 74(2): 129-136.
[15] Powers RW, Majors AK, Lykins DL, et al. Plasma homocy- steine and malondialdehyde are correlated in an age-and gender-specific manner [J]. Metabolism, 2002, 51(11): 1433-1438.
[16] Appel LJ, Miller ER, 3rd, Jee SH, et al. Effect of dietary patterns on serum homocysteine: results of a randomized, controlled feeding study [J]. Circulation, 2000, 102(8): 852-857.
[17] Li D, Tian YJ, Guo J, et al. Nicotinamide supplementation induces detrimental metabolic and epigenetic changes in developing rats [J]. Br J Nutr, 2013, 110(12): 2156-2164.
