香豆素类荧光传感器检测金属离子的研究进展
2014-07-05舒杰明高云玲姚克俭胡颖
舒杰明,高云玲,姚克俭,胡颖
(浙江工业大学化学工程与材料学院,浙江 杭州 310014)
香豆素类荧光传感器检测金属离子的研究进展
舒杰明,高云玲,姚克俭,胡颖
(浙江工业大学化学工程与材料学院,浙江 杭州 310014)
金属离子对自然环境和生物体的生长发育具有重要的影响,因此对环境中及生物体内的金属离子的识别和检测正日益受到人们广泛的关注。在不同的分析方法中,荧光分析法具有灵敏度高、选择性好和实时原位检测等优点,是实现环境中和生物体内金属离子识别和检测的良好工具。本文综述了近5年来香豆素类荧光传感器对一些重金属离子(Hg2+、Pb2+、Cd2+、Ni2+、Ag+)和一些具有重要生物学意义的过渡金属离子(Cu2+、Zn2+、Fe3+)的识别与检测及其应用进展情况,着重介绍了传感器分子的设计合成、识别机理、传感特性及其在环境分析和生物检测中的应用。随着金属离子检测要求的提高,未来香豆素类荧光传感器的设计将向着灵敏度更高、选择性更好、抗干扰性能更强的方向发展。此外,香豆素类传感器在生物检测中的应用研究有望得到进一步发展。
香豆素;传感器;选择性;配合物
汞、铅、镉等重金属毒性强、难降解,会对生态环境中的水体和土壤造成严重污染;在植物体内积累,并通过食物链进入动物和人体内,导致各种疾病,对人类的健康产生不可忽视的影响。在适量的条件下,铜、锌、铁等过渡金属对生物体的生长发育过程具有重要作用,但缺少或过量也会对生物体产生危害。因此,识别和检测环境中以及生物体内的这些金属离子受到人们日益广泛的关注。荧光传感器能将分子识别信号转化为可供测量的荧光信号,具有灵敏度高、选择性强以及实时原位检测的优势。
香豆素类荧光团具有荧光量子产率高、stocks位移大,光化学稳定性好等优点,在荧光传感器的设计中备受人们的青睐。
1 荧光传感器的设计及传感机理
荧光传感器可分为两类[1]:一类是化学反应型传感器,这类传感器通过与分析物发生特异的化学反应,引起荧光信号变化,从而实现对分析物的检测;另一类是络合型传感器,这类传感器通过离子络合作用引起荧光信号变化,从而实现对分析物的检测。荧光传感器主要由荧光团、连接基和接受基团三部分构成(图1)。当分析物与接受基团结合后,导致传感分子的光物理性质发生变化,具体表现为荧光团荧光的增强或淬灭,或者光谱位移。荧光传感器的设计一方面要求设计的分子中包含能与特定分析物选择性相互作用的接受基团,另一方面要求分子中包含能将识别信息转化为可测量的荧光信号的报告基团。接受基团的设计是传感器研究中的重要环节,直接关系到传感器的识别性能。根据被分析物的特性,如金属离子的直径、电荷密度、配位数等,选择合理的接受基团是关键。常见的阳离子识别基团有冠醚、吡啶、环芳烃、多胺类、含有中心原子氮或硫的配体等。对于荧光团的选择,要求其具有良好的光物理和光化学性能。文献中报道的荧光团常见的有罗丹明、荧光素、芘、蒽、萘酰亚胺、香豆素和BODIPY等。荧光传感器识别的荧光响应机理[2]主要涉及光诱导电子转移(PET)、分子内电荷转移(ICT)、荧光共振能量转移(FRET)以及形成激基缔合物等。
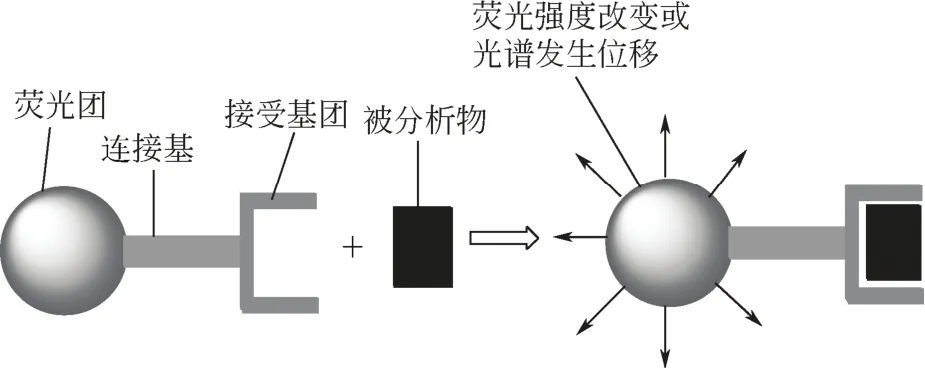
图1 荧光传感器工作原理示意图
2 香豆素类金属离子荧光传感器
2.1 香豆素类Hg2+荧光传感器
金属汞在自然界中以单质汞、各种有机汞和无机汞的形式存在。其中,由水体微生物代谢产生的甲基汞和非生命形式产生的无机汞具有高毒性和易于在生物体内积累的特点。汞中毒会引起诸如癌症、心血管、神经系统和生殖系统等疾病,其对人类健康的影响受到人们的极大关注。因此,对Hg2+的检测具有重要意义。近年,香豆素类荧光传感器对水体中及生物体内Hg2+的检测是人们研究的热点。
香豆素类化学反应型Hg2+传感器是近年研究的热门课题[3-10]。这类传感器通过与Hg2+发生化学反应实现荧光信号的变化,是今后开发研究高灵敏度Hg2+传感器的重要方法。
2009年,Kim和Lee等[3-4]设计了传感器1(下文简称1,下同)和2。在乙醇水溶液(30∶70,体积比,下同)中,化合物1分子中的硫缩醛与Hg2+发生脱硫作用,硫缩醛基团水解为醛基,引起荧光淬灭,从而实现对Hg2+的选择性检测。此外,1能成功实现对人体血浆中Hg2+的检测;而2在对Hg2+的检测过程中,Hg2+充当催化剂,促进传感器分子上的炔烃基和水发生反应生成酮基,使香豆素HOMO(最高占据轨道)上的电子向酮基上的LUMO(最低未占轨道)进行电子转移,从而引起荧光淬灭。2对Hg2+的响应下限为1.2μmol/L,在紫外光下可用肉眼分辨出传感器对Hg2+的荧光淬灭效果。
与1、2相比,Cho等[5]合成的传感器3是荧光增强型传感器,它是基于:传感分子在Hg2+作用下发生水解,生成具有强烈荧光的香豆素衍生物3-1(图2),从而实现对Hg2+的荧光增强检测,与Hg2+的结合比例为1∶1。
Ma等[7]报道了荧光增强型Hg2+探针4。在乙腈水溶(30∶70,pH=7.0)中,Hg2+能够诱导探针4脱硫,形成1,3,4-二唑,使原先的氨基硫脲基团由供电子基团变为吸电子基团。荧光分子的共轭体系得到了增强,荧光光谱发生红移,吸收强度增大。该探针对Hg2+的识别具有灵敏度高和选择性好的特点。
Chen等[9]设计了反应型荧光传感器5,该传感器基于Hg2+脱硫作用原理实现Hg2+的检测,检测限为2.6μmol/L,其反应机理如图3所示。
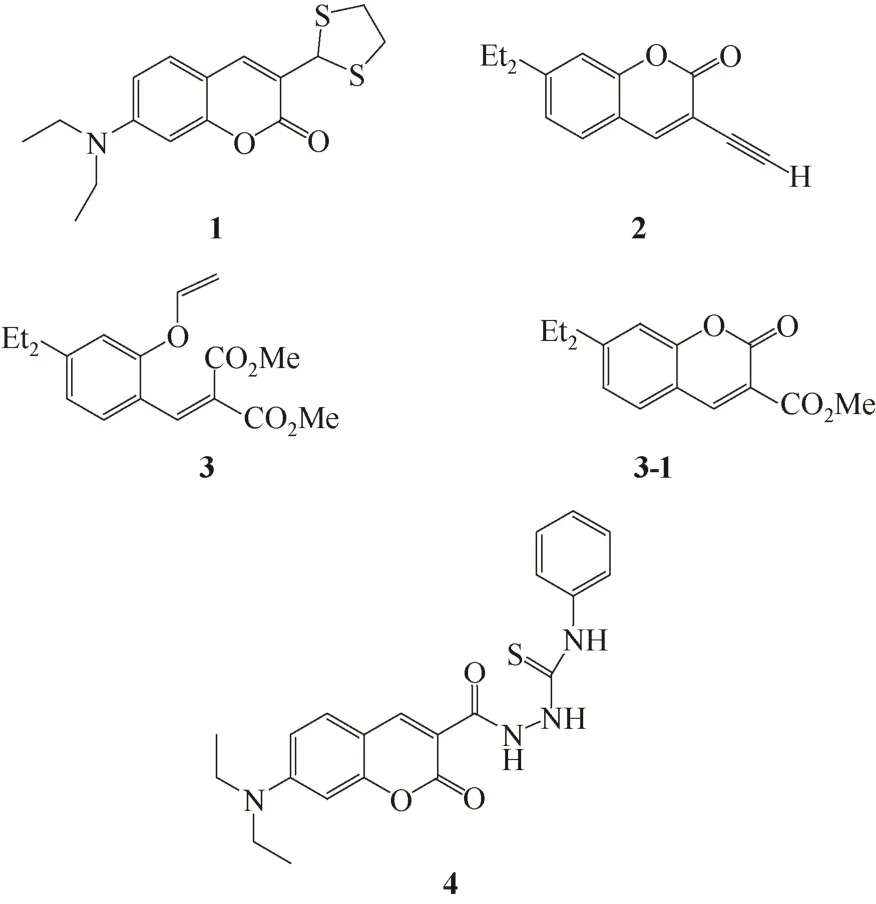
图2 Hg2+荧光传感器1~4

图3 传感器5与Hg2+的反应机理[9]
Ma等[6]基于香豆素和罗丹明荧光团设计了传感器6。传感器6~9见图4。Hg2+与传感器结合后能够引起罗丹明上的内酰胺发生开环反应。传感器分子因香豆素和罗丹明间的PET过程受到抑制而使荧光增强,同时传感器的颜色发生变化,实现对Hg2+的快速定性定量检测。线性检测范围为8.0× 10-8~1.0×10-5mol/L,检测下限达到4nmol/L。该传感器实现了自来水和河水中Hg2+的分析,结果令人满意。
荧光比率传感器利用两个特定波长处的荧光强度比值变化作为信号,对外部环境的干扰具有内置的校正作用,提高了探针定量检测的准确性[11]。
传感器7和8[8,10]都是反应型的比率Hg2+传感器。传感器7对Hg2+的检测是通过共轭键能量转移(through-bond energy transfer,TBET)机理实现的,与荧光共振能量转移(FRET)传感器相比,TBET传感器对电子给体基团和受体基团的发射光谱没有重叠的要求,并且有更高效的能量转移效率。因此,TBET的传感机理为比率传感器的设计提供了更广阔的空间。通过Hg2+促进脱硫作用,化合物7结构中的香豆素基团和罗丹明基团间开启高效的能量转移(TBET)进程,使香豆素基团在470nm处的荧光强度减小,而罗丹明基团在580nm处的荧光强度增大。传感器7对Hg2+表现出高灵敏性,线性检测范围为2.0×10-8~3.0×10-5mol/L,检测限达到了7nmol/L。此传感器也被应用于生物细胞内Hg2+的成像和实际水样中Hg2+的检测,取得了满意的效果。传感器8与7结构相似,与Hg2+反应机制相同,但检测机理为荧光共振能量转移。在Hg2+促进脱硫作用下,传感器8的香豆素基团在467nm的发射峰荧光强度减小,而罗丹明基团在590nm的发射峰荧光强度增大,荧光颜色由绿变红。且传感器对Hg2+的检测几乎不受其他金属离子的影响,表现了良好的选择性。另外,该传感器还被成功地应用于A375细胞内Hg2+的检测。
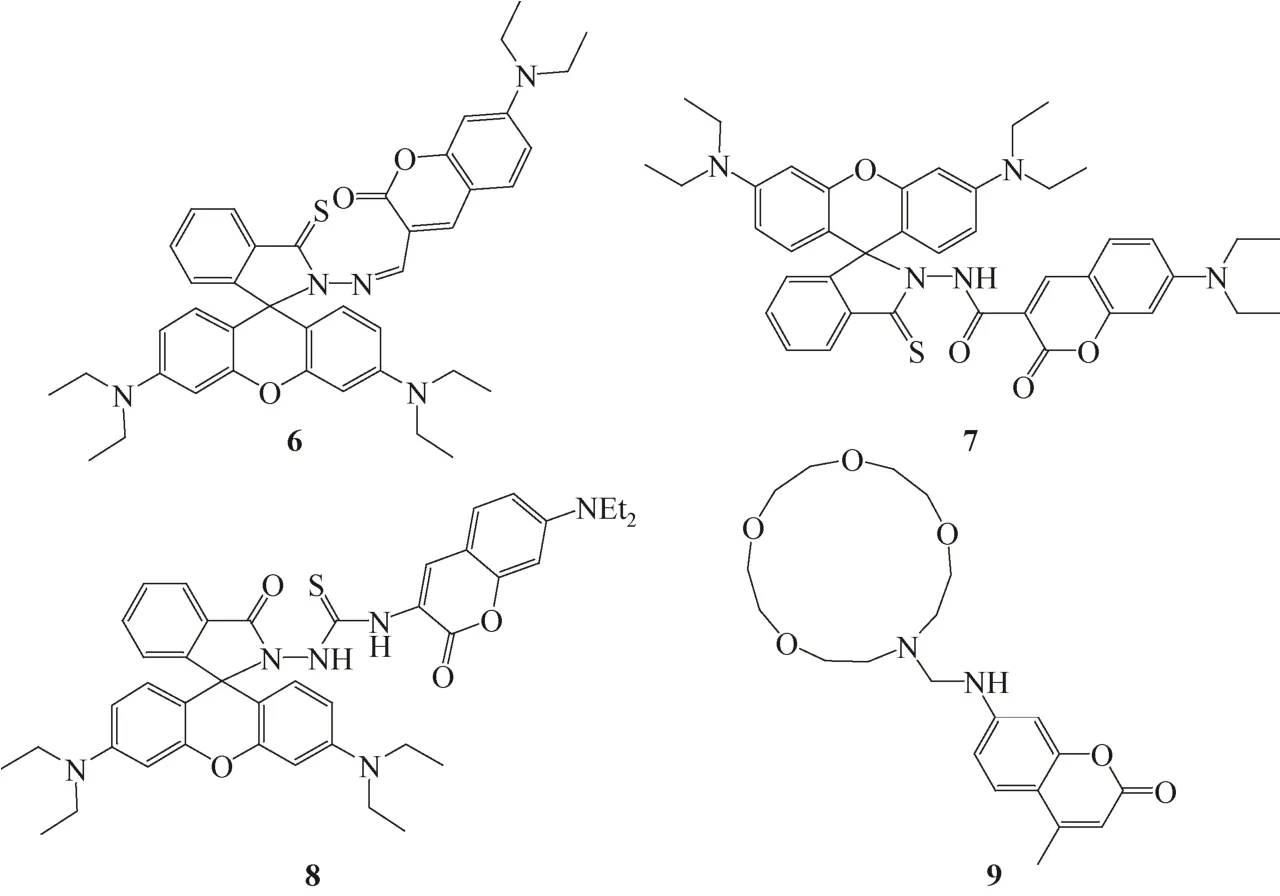
图4 Hg2+荧光传感器6~9
另一类近年报道较多的香豆素类Hg2+荧光传感器是“turn-on”(开启)型或“turn-off”(关闭)型传感器[12-15]。
9~11都是基于PET机理的Hg2+荧光传感器。Voutsadaki等[12]以香豆素为荧光团,以杂冠醚为识别基团设计了“turn-on”型传感器9。该传感器水溶性好,能够在纯水溶液中选择性识别Hg2+,解离常数为13.1µmol/L。Guha等[13]将香草醛连接到含氮香豆素上,设计了传感器10。传感器10检测Hg2+的机理如图5所示,两个传感分子与一个Hg2+络合后,香草醛基团的旋转受到限制,其氮和氧原子上的电子向香豆素基团进行的PET进程被阻止,从而导致荧光增强。结合常数为2.2×105(mol/L)-1/2,检测限为1.25µmol/L。Garcia-Beltran等[14]开发的传感器11是一种新型的“turn-off”型传感探针。在pH=7.4的缓冲液中,该探针与Hg2+络合后在460nm处发生荧光淬灭。而且Hg2+的浓度与荧光淬灭程度呈线性关系,相关性高达0.9916。竞争实验表明该探针对Hg2+具有良好的选择性,并成功地实现了细胞内Hg2+的成像检测(图6)。
Ho等[15]设计合成了三唑基香豆素衍生物荧光传感器12和13(图7)。在甲醇-氯仿溶剂(体积比9∶1)中,两分子化合物12选择性地结合一分子Hg2+,结合常数为6.94×107(mol/L)-2,检测限为2.00×10-7mol/L。研究表明,在化合物12中参与络合的原子是三唑基上2,3位上的氮原子。而乙酰基和4-异丁基苯乙醚上的两个氧原子对络合产生了协助作用。与12相比,化合物13在三唑基的4位上用苄基取代了含氧原子的4-异丁基甲醚基团。12以1∶1的比例选择性结合Hg2+。在相同条件下,与Hg2+络合后,传感器13比12荧光增强程度更大。这主要是Hg2+一般情况下能通过自旋轨道耦合淬灭荧光,12结合两个Hg2+可能会使荧光增强程度减小;另外,12中的键合基团更具柔韧性,更易通过非辐射形式减弱荧光。传感器13与Hg2+的结合常数为7.44×104(mol/L)-1,检测限为3.15×10-7mol/L。
2.2 香豆素类Pb2+荧光传感器
铅是最丰富的重金属,对环境和人类健康有重要影响。铅中毒的来源主要有含铅油漆、含铅汽油以及受到铅污染的土壤等,能引发消化系统、肾脏系统以及神经系统疾病。因此,对铅离子的识别和检测得到人们的关注。

图5 荧光传感器10与Hg2+的作用机理示意图[12]
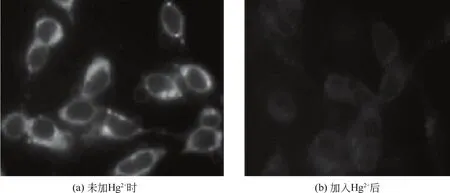
图6 人体肿瘤细胞内加入传感器11(左)及再加入Hg2+(右)后的荧光照片[14]

图7 Hg2+荧光传感器11~13
Roussakis等[16]分别将苯并咪唑、苯并噻唑和苯并唑与香豆素基团相连,设计合成了Pb2+荧光探针14~16。这些探针荧光特性相似,对Pb2+有着良好的亲和性。探针14~16与Pb2+结合后,激发光谱在401nm处荧光增强,而在470nm处荧光下降。但其他常见金属却没有明显引起探针在401nm和470nm处荧光强度的比率变化,这说明探针能以比率特性区分Pb2+和其他常见金属离子。另外,探针14~16满足细胞内Pb2+的检测条件,具有检测细胞内Pb2+的潜力。探针14~16与Pb2+结合前后的荧光性质及解离常数见表1。传感器14~19结构式见图8。
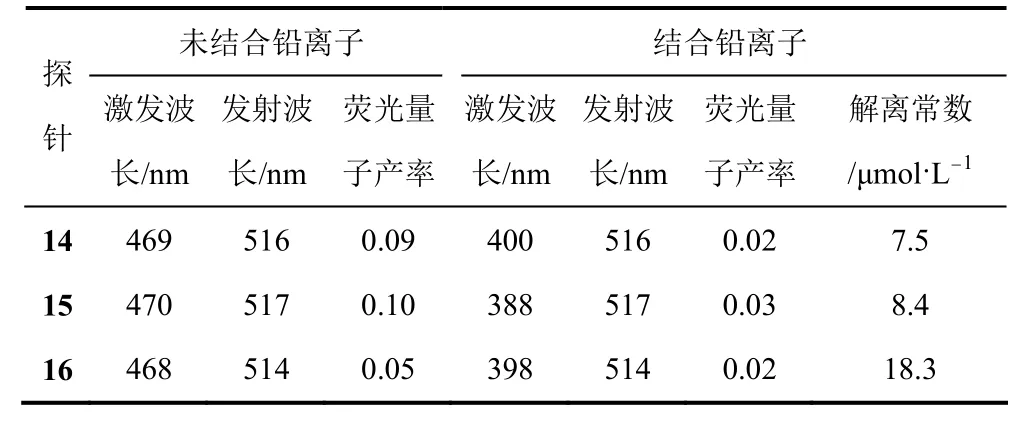
表1 探针14~16与Pb2+结合前后的荧光性质
2.3 香豆素类Cd2+荧光传感器
镉是一种高毒性的重金属,是环境污染物之一。镉通过被染污的食物、饮用水和烟草等进入人体,会对人的肾脏、肝脏、肠胃、大脑及骨骼等器官和组织造成损伤。因此,研究能检测出环境和生物组织中的镉离子的荧光传感器意义重大。
Swamy等[17]通过在7-羟基香豆素的不同位置引入不同的配位基团设计合成了Cd2+传感器17~19。在DMSO-HEPES(0.02mol/L,1∶99, pH=7.4)水溶液中,Cd2+能与传感器17~19络合形成配位复合物,使传感器的荧光大幅增强。Cd2+与传感器17~19的络合常数分别是1.7×104L/mol、2×105L/mol和1.4×105(mol/L)-1。同时,传感器17~19也是Zn2+传感器,其中传感器17对Zn2+的选择性比对Cd2+选择性要好,而传感器18、19对Zn2+的选择性虽然优于对Cd2+的选择性,但并不明显。
Cd2+传感器的优劣要看其能否实现对Cd2+和Zn2+的区分。Sumiya等[18]设计的传感器20同样是Zn2+和Cd2+传感器,但其能从Zn2+中区分出Cd2+。在HEPES(100mmol/L,pH=7.3)水溶液中,传感器对Zn2+和Cd2+在波长437nm和386nm处分别表现出选择性荧光增强。如图9所示,Zn2+和Cd2+都与两个吡啶上的N、胺上的N和酰胺上的O络合形成1∶1的结构,但Zn2+还与OH-配位,这导致了其π轨道上的电子向香豆素基团转移,增加了香豆素基团上的电子密度,使其发射波长增大。
传感器17~20能同时实现两种金属离子的识别,这在很大程度上增加了传感器的使用价值,但进一步发展此类传感器需要克服选择性和抗干扰性差的问题。
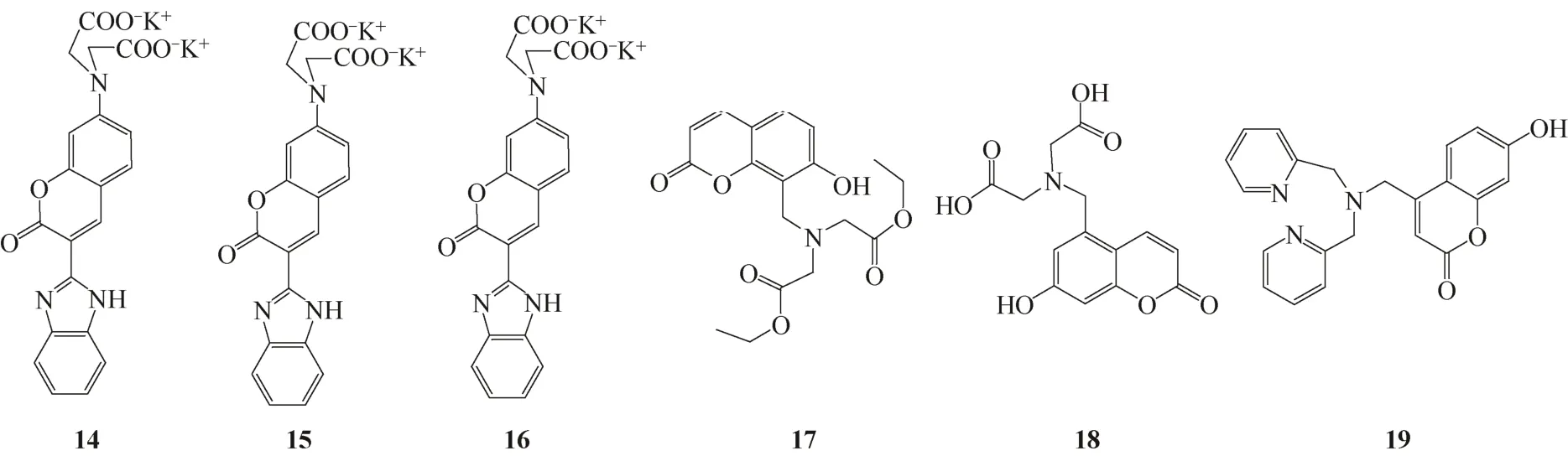
图8 Pb2+荧光传感器14~16 和Cd2+荧光传感器17~19
Taki等[19]开发了Cd2+比率传感器21。比率传感器能克服抗干扰差的问题。在HEPES水溶液中,传感器对Cd2+具有高亲和性,与Cd2+结合后在333nm和356nm处的荧光强度比率增大,能够实现从其他过渡金属离子中区分出Cd2+,对Cd2+表现出了良好的选择性。该传感器的细胞兼容性好,能够对生物细胞中的Cd2+进行定性和定量检测(图10)。
2.4 香豆素类Ni2+荧光传感器
镍是生物系统中不可或缺的微量元素之一,在呼吸作用、生物合成和新陈代谢中发挥着重要作用。然而镍也是一种有毒的工业污染物,会对人体造成呼吸系统损伤,诱发过敏症和癌症。利用传感器实现对镍离子的选择性识别和检测对环境评价和临床分析具有重要意义。
2009年,Wang等[20]设计合成了包含香豆素荧光团的聚合物型荧光传感器22。传感器22~24结构式见图11。在中性水溶液中,传感器与Ni2+作用后荧光增强,对Ni2+的浓度响应范围为6.67×10-6~5.33×10-5mol/L。传感器的检测机理主要是哌嗪环上的两个N原子与Ni2+发生络合作用,减弱了其向香豆素基团的供电子能力,从而使荧光增强。该聚合物传感器在灵敏性和选择性方面还需进一步改善。
2011年,Rakesh等[21]首次报道了香豆素型Ni2+比色传感器23。在乙醇水溶液中,23与Ni2+络合后在270nm和372nm处的紫外吸收峰减弱,而在508nm处产生新的吸收峰。23与Ni2+络合后,发生了配体向金属的电荷转移(MLCT),在508nm处产生新的吸收峰,从而导致颜色改变。23与Ni2+以2∶1进行络合,结合常数为8.6×109(mol/L)-2。
2012年,Wang等[22]开发了一个简单、轻便、基于香豆素席夫碱化合物的Ni2+比色传感器24。将Ni2+添加到24的乙腈溶液中,可以明显地观察到溶液的颜色迅速由黄变红。传感器与Ni2+结合后,在465nm处的紫外吸收峰减弱,而在486nm和516nm处产生新的吸收峰,因此颜色发生改变。在1∶1的基础上,通过计算得出传感器与Ni2+的结合常数为2.9×104(mol/L)-1。
2.5 香豆素类Ag+荧光传感器
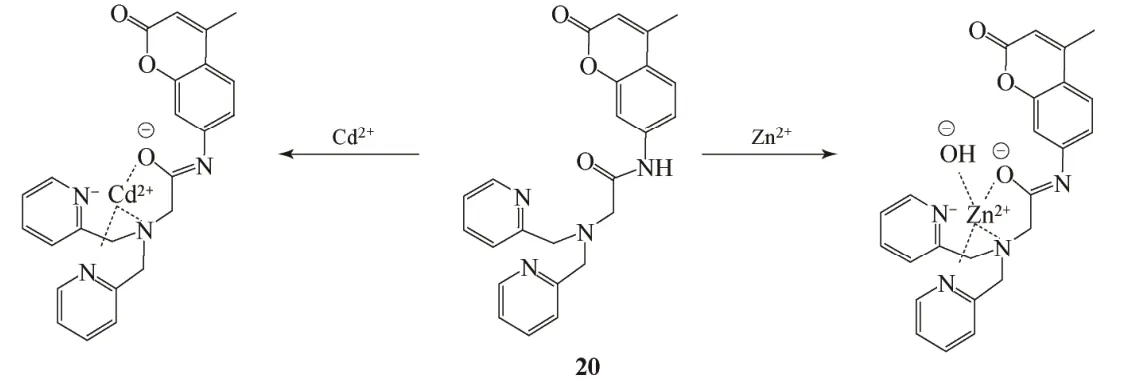
图9 荧光传感器20与Zn2+和Cd2+的络合模型[18]
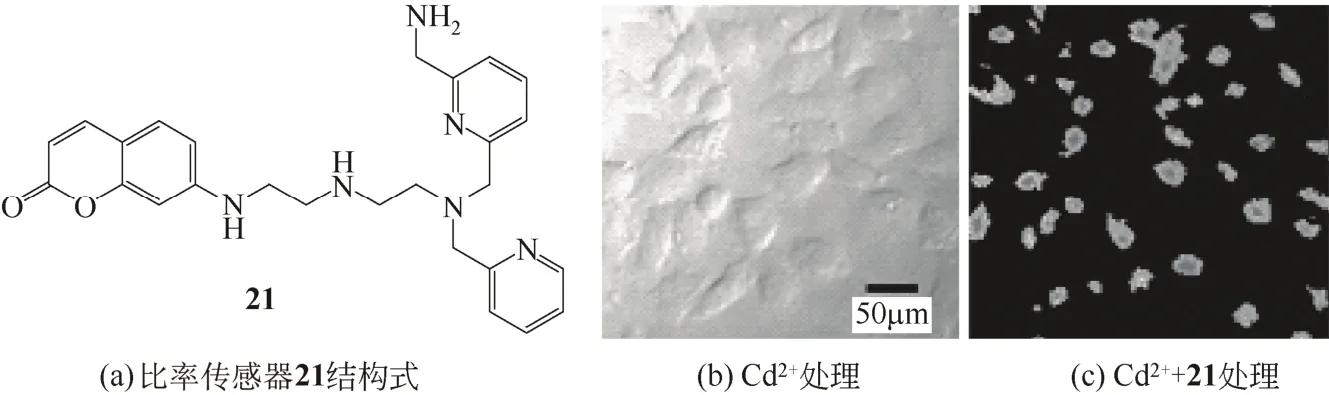
图10 比率传感器21及其应用于Hela细胞内Cd2+检测的荧光照片[19]

图11 Ni2+荧光传感器22~24
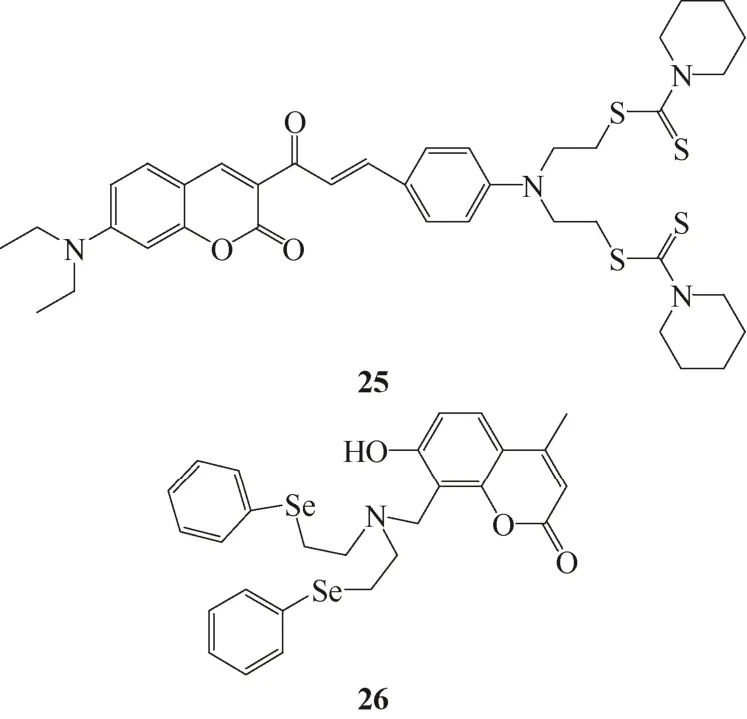
图12 Ag+荧光传感器25和26
银是人体内的微量元素之一。银广泛应用于医药、摄影、电子等工业中。高浓度的银离子会对环境中的生物产生危害[23],用传感器检测环境中的银离子引起了人们的兴趣。
2008年,Wang等[24]合成了香豆素类“turn-off”型Ag+传感器25。传感器25和26结构式见图12。传感器与Ag+以1∶1结合后,荧光淬灭达到18倍,而其他金属离子对传感器荧光几乎无影响,这表明传感器对Ag+有良好的选择性。传感器与Ag+结合导致荧光团和配位基之间的PET进程开启,使荧光发生淬灭。传感器与Ag+间的解离常数为5.9×10-6mol/L。
2011年,Huang等[25]将含Se2N的螯合基团连接到香豆素基团上,设计合成了荧光增强型银离子传感器26。在乙醇水溶液(1∶1)中,26对Ag+表现出高灵敏性和选择性。传感器与银离子以1∶1结合后,配位基团上的电子向香豆素基团转移的PET进程受到阻止,从而荧光增强。结合常数达到了1.61×108(mol/L)-1,检测限为5.2×10-8mol/L。
2.6 香豆素类Cu2+荧光传感器
铜是人体中不可或缺的微量元素,在许多生命进程中扮演着重要角色,如铜离子可作为许多不同金属酶的催化辅因子[26]。人体内铜一旦缺乏或过量就会造成生长和代谢紊乱,导致诸如老年痴呆症和帕金森综合症等神经性疾病[27]。高浓度的铜离子也会对环境造成污染。因此,采用荧光传感器检测环境以及生物体内的铜离子在环境和生命科学领域有着重要意义。
近年,反应型Cu2+传感器的研究受到很大的关注[28-30]。这类传感器制备简单、响应性和灵敏性好,是今后铜离子传感器一个重要的发展方向。
Kim等[28]设计的传感器27是一种新型Cu2+传感器。传感器27~32的结构式见图13。在水溶液中,Cu2+催化腙键水解使传感分子的荧光增强。传感器对Cu2+的检测不受其他干扰金属离子的影响,对Cu2+的选择性良好,检测限为100nmol/L。Zhou等[29]报道了同样基于Cu2+催化水解机理的传感器28,其检测限达到了35nmol/L。该传感器被成功地应用到了幼马血清及两种水样中Cu2+的检测。
另一类反应型Cu2+传感器是基于Cu2+氧化作用而设计的。如Li等[30]报道的传感器29。在50%乙腈水溶液中,浓度为1μmol/L的弱荧光化合物29能被Cu2+氧化为发强烈绿色荧光的3-苯并噻唑-7-N,N-二乙基氨基香豆素。传感器29对Cu2+表现出高度灵敏性和选择性。这种由金属离子促进氧化作用实现荧光信号的改变为金属离子的检测提供了一种新的方法。
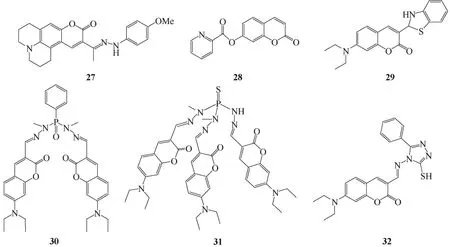
图13 Cu2+荧光传感器27~32
基于Cu2+与荧光探针络合的荧光增强型Cu2+传感器也是近年的发展趋势[31-33]。
Chandrasekhar等[31]设计开发了传感器30和31。通过与Cu2+结合,传感器30和31的荧光发生显著增强,络合常数分别达到了1.9×105(mol/L)-1和6.1×104(mol/L)-1。传感器30和31对Cu2+具有良好的选择性。其荧光增强机理主要是基于Cu2+与传感器的结合阻止了传感器N=C的旋转异构化,从而终止了氮孤对电子的PET进程,使荧光增强。这种由含磷化合物作为支撑结构来设计Cu2+传感器的方法也为设计其他金属离子传感器提供了一种思路。
Ko小组[32]根据其提出的“轨道控制增强荧光(FEOC)”机理设计了传感器32。在80%乙腈水溶液中,传感器32与Cu2+作用后荧光显著增强,对Cu2+具有很高的选择性。这是由于32与Cu2+结合后,结合位点上氮原子的孤对电子与Cu2+发生配位作用,孤对电子向香豆素基团转移的PET进程被阻止,从而荧光淬灭进程被终止。另外,传感器与Cu2+结合后,C=N键的异构化也能使传感器的荧光增强,结合常数为3.34×104(mol/L)-1。
Jiang等[33]以8-羟基喹啉为离子载体合成了传感器33。传感器33~38的结构式见图14。在1%乙腈水溶液中,化合物33与Cu2+形成1∶1络合物,荧光增强13倍。络合常数为2.88×104(mol/L)-1,检测限为1.16μmol/L。
“turn-off”型Cu2+传感器相对于“turn-on”型Cu2+传感器来说往往在灵敏度和选择性方面相对较差,因为像Cu2+等顺磁性过渡金属离子对荧光具有天然的淬灭作用[34]。但是这类传感器在生物应用研究方面有了一定的进展[35-38]。
Jung等[35]设计了对生物体内Cu2+具有高效的选择性和亲和性的“turn-off”型传感器34。传感器对Cu2+的络合常数和检测限分别是(1.17± 0.29)×105(mol/L)-1和0.5µmol/L。2010年,Ciesienski等[34]合成了新型传感器35。在10%DMSO水溶液中,传感器与Cu2+以1∶1的比例络合后荧光强度降低了75%。而用紫外线照射后,由于光诱导作用使传感器分解,破坏了Cu2+的淬灭效应,从而荧光得到了2倍的增强。该传感器虽被用于人体乳腺癌细胞内Cu2+检测,但灵敏性有待进一步提高。
Helal等[27]和Huang等[36]分别报道了传感器36和37。基于噻唑-香豆素设计的传感器36对Cu2+有高选择性、高灵敏性,这主要是传感器与Cu2+的结合影响了ICT进程而引起荧光淬灭。传感器对Cu2+的检测限达到了0.04μmol/L,络合常数为2.2 × 106(mol/L)-1。传感器37在DMSO水溶液(体积比1∶9)中对Cu2+同样具有高灵敏度和选择性。晶体结构分析证明了传感器与Cu2+的结合比例为1∶1。密度泛函理论(DFT)计算阐明了传感器的荧光淬灭机制,即传感器与Cu2+结合后,荧光分子形成二维共平面结构。此外,传感器37还被应用于HepG2细胞内的Cu2+生物成像研究,如图15所示。传感器37对Cu2+的检测限为0.1μmol/L,络合常数为6.4×105(mol/L)-1。
Chen等[37]开发了基于香豆素和喹啉的传感器38。该传感器能在pH值为5~11的范围内实现水溶液中Cu2+的选择性检测。传感器检测Cu2+的机理主要利用了传感器分子和Cu2+结合后形成的络合轨道促进了N原子上的孤对电子向香豆素基团转移的PET进程,从而促进了荧光淬灭。此外,在活体细胞中,传感器对Cu2+亦有较好的响应性,说明传感器在活体细胞中具有潜在的应用价值。

图14 Cu2+荧光传感器33~38

图15 传感器37对HepG2细胞内Cu2+成像的荧光照片[36]
Xu等[38]设计了高选择性荧光淬灭型Cu2+传感器39。传感器39和40的结构式见图16。39对Cu2+响应迅速,荧光淬灭与Cu2+成线性关系。在60%甲醇水溶液中,39与Cu2+的解离常数达到了0.1 μmol/L。此传感器对人体乳腺癌细胞内Cu2+的成像表明它是良好的细胞内Cu2+显像剂。
2012年,Yuan等[39]以香豆素和罗丹明为荧光团,设计了基于FRET原理的荧光比率传感器40。传感器40在Cu2+的作用下发生荧光共振能量转移,在473nm处的发射峰减弱,而在481nm处产生新的发射峰。在0.08~30μmol/L Cu2+的作用下,481nm处与473nm处的荧光强度比率呈线性增长,从而能实现Cu2+的定量检测。该传感器不但对Cu2+具有较高的选择性和灵敏性,而且对细胞具有较好的兼容性。所以,传感器还被用于海拉细胞中Cu2+的成像检测。
2.7 香豆素类Zn2+荧光传感器

图16 Cu2+荧光传感器39和40
锌是生物体中含量仅次于铁的微量元素,在基因表达、细胞凋亡、酶的调节、免疫、神经传递等生命进程中扮演着重要的角色[40]。在病理学上,老年痴呆症、癫痫病、局部缺血性中风等疾病的形成都与锌的代谢紊乱有关[41]。采用荧光传感器实现对锌离子的识别和检测是一种重要的方法。在报道的锌离子传感器中,基于香豆素荧光团的传感器近年来发展迅速,在灵敏度上有了进一步的提升,并在检测生物细胞内的锌离子的应用研究方面有了初步进展。
Li等[42]报道了一种合成简单的传感器41。传感器41~47的结构式见图17。该传感器在有机溶剂乙腈中几乎无荧光,但加入Zn2+后荧光增强,溶液颜色由无色变为黄色,而加入其他金属离子后却无明显变化,表明传感器能选择性检测Zn2+。通过荧光滴定确定了传感器与Zn2+以1∶1的比例结合,解离常数为(7.7±0.3)×10-5mol/L。
Su等[43]设计了香豆素类“turn-on”型Zn2+传感器42。在30%乙醇水溶液中,42与Zn2+络合后荧光显著增强,发射光谱从483nm蓝移到457nm。这是由于42与Zn2+络合后,氨基脲基团上的电子向香豆素基团进行的ICT进程被阻止,从而恢复了荧光。在0.5~10μmol/L的范围内,传感器的荧光强度与锌离子浓度呈线性关系,检测限为0.29μmol/L,结合常数为(9.15 ± 3.50)×105(mol/L)-1。应用传感器42对水样中Zn2+的检测结果表明,该传感器具有简单实用性。
Yan等[44]开发了一种高灵敏性的Zn2+荧光传感器43。在含10μmol/L探针43的四氢呋喃溶液中,加入0.5当量的Zn2+,荧光强度达到了19.5倍增幅。但在Cd2+存在条件下,荧光仅增加了2.2倍,说明Cd2+对传感器的选择性有一定的影响。该探针对Zn2+的检测下限达到了10nmol/L。

图17 Zn2+荧光传感器41~47
Xu等[45]合成了传感器44,其分子中包含可异构互变的氨基-氨甲基吡啶结构,与Zn2+结合后最大发射波长从485nm红移到了505nm,荧光增强9倍,而其他金属离子并不会引起探针44吸收波长的变化,这表明了探针对Zn2+的良好选择性。另外,探针44还能以酰胺形式与Cr3+结合,并在485nm处发生荧光增强,发出蓝色荧光。而加入不同浓度的Zn2+后,探针分子的酰胺结构发生异构互变成亚氨酸结构,在485nm处的发射强度逐渐减弱,而在505nm处的发射强度逐渐增强。这说明探针44能以比率特性区分Cr3+和Zn2+。同样,探针44也能区分Hg2+、Pb2+和Zn2+。
Li等[46]以二-2-甲氨基吡啶为识别基团,开发了“turn-on”型Zn2+荧光传感器45。探针45对Zn2+具有很强的亲和能力,与Zn2+以1∶1配位后荧光增强达到13倍。荧光增强机理是45与Zn2+络合阻止了配位基团上的电子向荧光团转移的PET进程,导致荧光增强。该探针受到Hg2+、Cd2+、Co2+、Ni2+、Cu2+等金属离子的干扰,但对活体细胞具有较好的兼容性和低毒性,是实现细胞内定量检测Zn2+的极具潜力的传感器。
An等[47]基于香豆素和荧光素基团设计合成的传感器46在10%乙醇水溶液中与Zn2+结合后荧光显著地增强了33倍,而且可以观察到溶液的颜色由无色变为浅黄绿色。这是因为传感器46与Zn2+络合引起了罗丹明基团的开环反应,阻止了两个荧光团之间的PET进程,从而导致荧光增强。此外,传感器与Zn2+络合也影响了探针分子内的电荷转移(ICT)进程,从而能实现溶液颜色的改变。传感器与Zn2+的结合常数为1.213×104(mol/L)-1,检测限为6.54nmol/L。
Wu等[48]根据C=N异构互变机制设计了荧光增强型比色传感器47,它能选择性地从Cd2+及其他重金属中鉴别出Zn2+。在乙腈水溶液(体积比3∶7,Tris-HCl,10mmol/L,pH=7.4)中,47与Zn2+结合后荧光增强,发射光谱发生14nm的蓝移,溶液呈现出肉眼可见的绿色。检测机理是47与Zn2+结合后,C=N键的旋转异构受到阻碍,导致分子内的PET进程受阻,荧光增强。47与Zn2+结合常数是3.3×106(mol/L)-1。另外,该探针成功地被应用于肝癌细胞内Zn2+的成像研究(图18)。同样根据C=N异构互变机制设计的传感器48[49]也实现了对Zn2+的选择性识别,且对乳腺癌细胞内的Zn2+成像效果良好。
2009年,Mizukami等[50]在7-羟基香豆素的8位上引入配位基团以及其他位置上引入修饰基团,设计合成了一系列基于香豆素基团对锌离子有高亲和性能的传感器49~53,并对其性质进行了研究。其中,探针49和50的配位基相同,修饰基团不同;探针51、52和53的配位基相同,修饰基团不同。探针51、52和53与探针49和50相比对Zn2+有更高的络合能力。探针49~53对Zn2+的解离常数分别为28pmol/L、14pmol/L、5.2pmol/L、5.0pmol/L和3.6pmol/L。探针49~53都具有比率荧光传感器的特性,但对Zn2+的选择性都受到Cd2+的较大影响。而探针53的荧光比率值虽然还受到Fe3+、Cu2+、Co2+的较小影响,但有较好的细胞兼容性,能在可见光的激发下检测细胞内的Zn2+。传感器48~53的结构式见图19。
2.8 香豆素类Fe3+荧光传感器
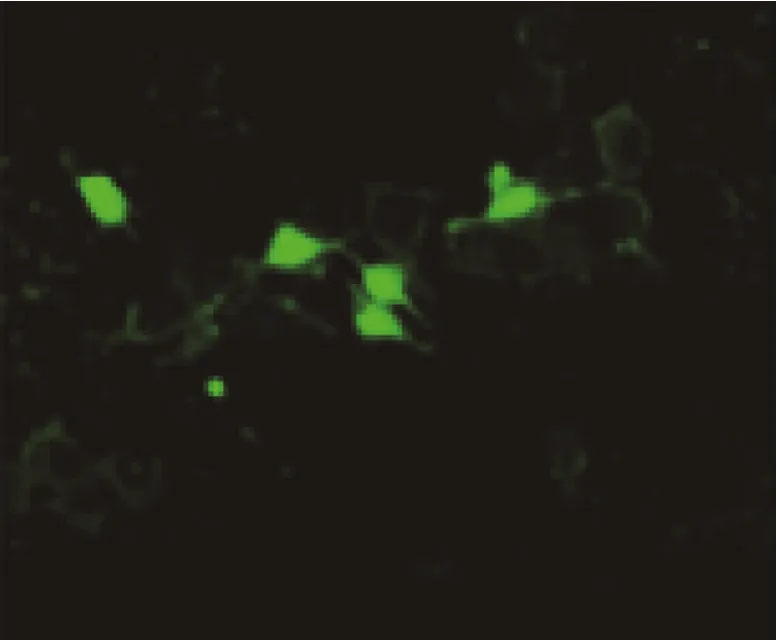
图18 传感器47应用于HepG2细胞内Zn2+成像的荧光照片[48]

图19 Zn2+荧光传感器48~53
铁在生物系统和许多生化过程中起着至关重要的作用,如在细胞代谢中提供血红素携氧能力,作为许多酶促反应的辅助因子等。铁的缺乏和过量可诱发贫血,肝、肾功能损害,心脏衰竭,糖尿病等疾病[51]。因此,一种简便、快速的方法用于分析实际样品中的Fe3+在生物医学研究中具有重要的意义。
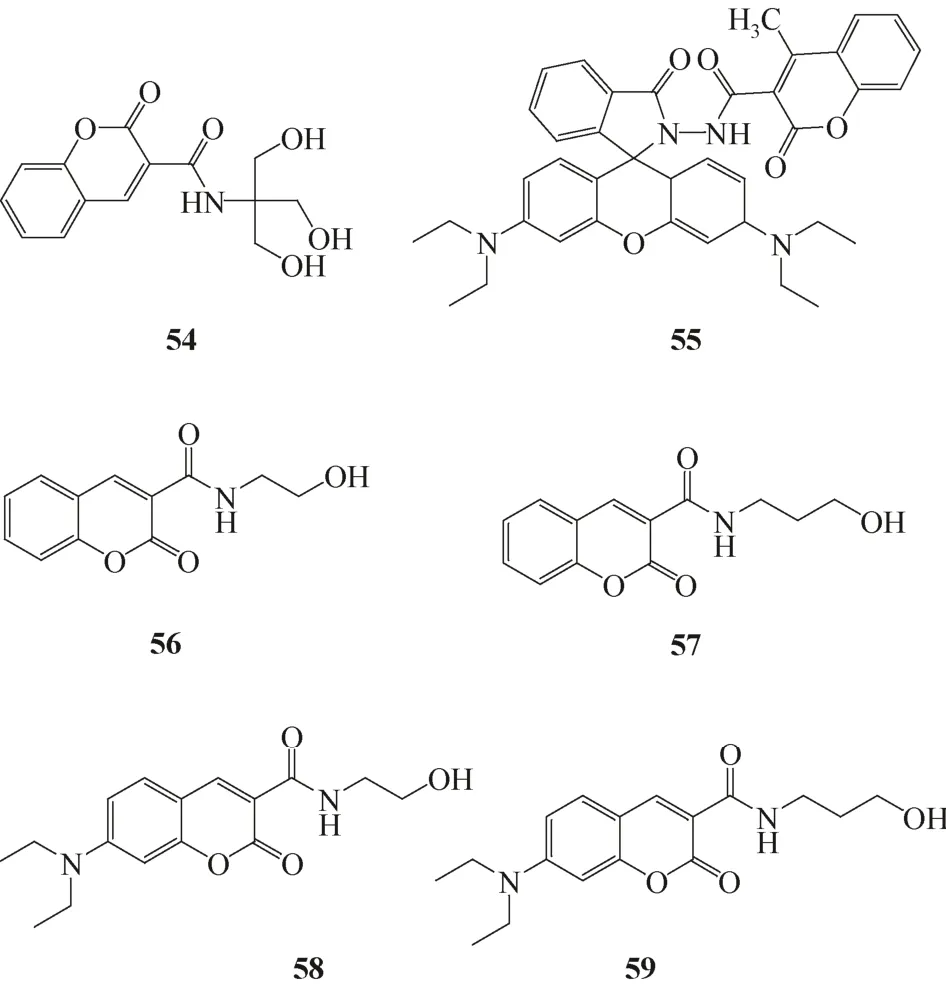
图20 Fe3+荧光传感器54~59
2009年,Yao等[52]设计合成了新型基于香豆素衍生物的Fe3+传感器54。传感器54~59的结构式见图20。在HEPES缓冲水溶液(20mmol/L,pH=7.2)中,探针54能选择性地与Fe3+形成1∶1的络合物,导致荧光下降,从而从其他金属离子当中识别Fe3+。探针对Fe3+的解离常数为(0.57 ± 0.07)mmol/L。此探针虽然表现出良好的选择性,但在灵敏度方面尚未不足。
2011年,Tang等[53]用酰胺键将罗丹明B与香豆素基团连接,报道了能检测Fe3+的荧光传感器55。在乙腈水溶液(体积比1∶1,HEPES 50mmol/L,pH = 7.0)中,探针55选择性结合Fe3+,并且荧光大幅度加强。其机理主要是Fe3+诱导罗丹明发生开环反应,致使探针分子中的PET进程被阻止,引起荧光增强。探针与Fe3+以1∶1的比例络合,络合常数为1.7 × 104(mol/L)-1。
2012年,Chen等[54]合成了包含酰胺结构的香豆素衍生物传感器56~59。这些传感器对Fe3+都具有选择性淬灭效应。在4个传感器中,59对Fe3+的选择性最佳,在其他常见金属离子存在下能够识别出乙腈溶液中的Fe3+,其与Fe3+的结合常数为2.2×104(mol/L)-1。
3 结 语
利用香豆素类金属离子传感器对环境和生物体内的金属离子进行分析检测是近年来人们持续关注和研究的热点。今后,此类传感器将向灵敏度更高、选择性更好、抗干扰性能更强的方向发展,如利用特定反应设计的化学反应型传感器在提升灵敏度和选择性上将得到进一步的研究和发展,而比率型传感器具有抗外界干扰能力强的特性。香豆素类荧光传感器检测生物细胞内金属离子的应用研究虽然有了初步成果,如生物成像、定性检测,但开发出对细胞无毒、兼容性好并且对细胞内的金属离子能进行定性和定量检测的香豆素类传感器仍需进一步研究。香豆素类荧光传感器对生物体内金属离子以及其他生命物质检测的应用研究将会更加活跃。此外,虽然人们已经掌握了诸多香豆素类金属离子传感器的设计方法,但是随着纳米、生物以及超分子化学技术的发展与交融[55],如何借助新技术的发展来进一步开发灵敏度更高,荧光信号更加稳定,应用领域更加广阔的传感器仍然是一个充满意义的课题。
[1] Nolan E M,Lippard S J. Tools and tactics for the optical detection of mercuric ion[J].Chemical Reviews,2008,108(9):3443-3480.
[2] Jiang P J,Guo Z J. Fluorescent detection of zinc in biological systems:Recent development on the design of chemosensors and biosensors[J].Coordination Chemistry Reviews,2004,248(1-2):205-229.
[3] Kim J H,Kim H J,Kim S H,et al. Fluorescent coumarinyldithiane as a selective chemodosimeter for mercury(Ⅱ) ion in aqueous solution[J].Tetrahedron Letters,2009,50(43):5958-5961.
[4] Lee D N,Kim G J,Kim H J. A Fluorescent coumarinylalkyne probe for the selective detection of mercury(Ⅱ) ion in water[J].Tetrahedron Letters,2009,50(33):4766-4768.
[5] Cho Y S,Ahn K H. A “turn-on” fluorescent probe that selectively responds to inorganic mercury species[J].Tetrahedron Letters,2010,51(29):3852-3854.
[6] Ma Q J,Zhang X B,Zhao X H,et al. A highly selective fluorescent probe for Hg2+based on a rhodamine-coumarin conjugate[J].Analytica Chimica Acta,2010,663(1):85-90.
[7] Ma W H,Xu Q,Du J J,et al. A Hg2+-selective chemodosimeter based on desulfurization of coumarin thiosemicarbazide in aqueous media[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2010,76(2):248-252.
[8] Gong Y J,Zhang X B,Zhang C C,et al. Through bond energy transfer:A convenient and universal strategy toward efficient ratiometric fluorescent probe for bioimaging applications[J].Analytical Chemistry,2012,84(24):10777-10784.
[9] Chen J H,Liu W M,Wang Y,et al. Turn-on fluorescence sensor based on the aggregation of pyrazolo[3,4-b]pyridine-based coumarin chromophores induced by Hg2+[J].Tetrahedron Letters,2013,54(48):6447-6449.
[10] Zhou Y,Chu K H,Zhen H F,et al. Visualizing Hg2+ions in living cells using a FRET-based fluorescent sensor[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2013,106:197-202.
[11] Wang Y Q,Zhao T,He X W,et al. A novel core-satellite CdTe/silica/Au NCs hybrid sphere as dual-emission ratiometric fluorescent probe for Cu2+[J].Biosensors & Bioelectronics,2014,51:40-46.
[12] Voutsadaki S,Tsikalas G K,Klontzas E,et al. A “turn-on”coumarin-based fluorescent sensor with high selectivity for mercury ions in aqueous media[J].Chemical Communications,2010,46(19):3292-3294.
[13] Guha S,Lohar S,Hauli I,et al. Vanillin-coumarin hybrid molecule as an efficient fluorescent probe for trace level determination of Hg(Ⅱ) and its application in cell imaging[J].Talanta,2011,85(3):1658-1664.
[14] Garcia-Beltran O,Mena N,Berrios T A,et al. A selective fluorescent probe for the detection of mercury(Ⅱ) in aqueous media and its applications in living cells[J].Tetrahedron Letters,2012,53(48):6598-6601.
[15] Ho I T,Lai T L,Wu R T,et al. Design and synthesis of triazolyl coumarins as Hg2+selective fluorescent chemosensors[J].Analyst,2012,137(24):5770-5776.
[16] Roussakis E,Pergantis S A,Katerinopoulos H E. Coumarin-based ratiometric fluorescent indicators with high specificity for lead ions[J].Chemical Communications,2008(46):6221-6223.
[17] Swamy K M K,Kim M J,Jeon H R,et al. New 7-Hydroxycoumarin-based fluorescent chemosensors for Zn(Ⅱ) and Cd(Ⅱ)[J].Bulletin of the Korean Chemical Society,2010,31(12):3611-3616.
[18] Sumiya S,Shiraishi Y,Hirai T. Mechanism for different fluorescence response of a coumarin-amide-dipicolylamine linkage to Zn(Ⅱ) and Cd(Ⅱ) in water[J].Journal of Physical Chemistry A,2013,117(7):1474-1482.
[19] Taki M,Desaki M,Ojida A,et al. Fluorescence imaging of intracellular cadmium using a dual-excitation ratiometric chemosensor[J].Journal of the American Chemical Society,2008,130(38):12564-12565.
[20] Wang B Y,Liu X Y,Hu Y L,et al. Synthesis and photophysical behavior of a water-soluble coumarin-bearing polymer for proton and Ni2+ion sensing[J].Polymer International,2009,58(6):703-709. [21] Rakesh K,Mishra R K,Upadhyay K K. Coumarin-based chromogenic receptor for Ni2+in aqueous medium exhibiting a reconfigurable logic gate pattern[J].European Journal of Organic Chemistry,2011(25):4799-4805.
[22] Wang L Y,Ye D C,Cao D R. A novel coumarin Schiff-base as a Ni(Ⅱ) ion colorimetric sensor[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2012,90:40-44.
[23] Alizadeh A,Khodaei M M,Hamidi Z,et al. Naked-eye colorimetric detection of Cu2+and Ag+ions based on close-packed aggregation of pyridines-functionalized gold nanoparticles[J].Sensors and Actuators B:Chemical,2014,190:782-791.
[24] Wang M X,Meng X M,Zhu M Z,et al. Novel fluorescent chemosensor for Ag+based on coumarin fluorophore[J].Chinese Chemical Letters,2008,19(8):977-980.
[25] Huang S S,He S,Lu Y,et al. Highly sensitive and selective fluorescent chemosensor for Ag+based on a coumarin-Se2N chelating conjugate[J].Chemical Communications,2011,47(8):2408-2410.
[26] Jeong Y,Yoon J. Recent progress on fluorescent chemosensors for metal ions[J].Inorganica Chimica Acta,2012,381:2-14.
[27] Helal A,Rashid M H O,Choi C H,et al. Chromogenic and fluorogenic sensing of Cu2+based on coumarin[J].Tetrahedron,2011,67(15):2794-2802.
[28] Kim M H,Jang H H,Yi S,et al. Coumarin-derivative-based off-on catalytic chemodosimeter for Cu2+ions[J].Chemical Communications,2009(32):4838-4840.
[29] Zhou Z J,Li N,Tong A J. A new coumarin-based fluorescence turn-on chemodosimeter for Cu2+in water[J].Analytica Chimica Acta,2011,702(1):81-86.
[30] Li J B,Zeng Y,Hu Q H,et al. A fluorescence “turn-on”chemodosimeter for Cu2+in aqueous solution based on the ion promoted oxidation[J].Dalton Transactions,2012,41(13):3623-3626.
[31] Chandrasekhar V,Bag P,Pandey M D. Phosphorus-supported multidentate coumarin-containing fluorescence sensors for Cu2+[J].Tetrahedron,2009,65(47):9876-9883.
[32] Ko K C,Wu J S,Kim H J,et al. Rationally designed fluorescence“turn-on” sensor for Cu2+[J].Chemical Communications,2011,47(11):3165-3167.
[33] Jiang Z J,Lv H S,Zhu J,et al. New fluorescent chemosensor based on quinoline and coumarine for Cu2+[J].Synthetic Metals,2012,162(23):2112-2116.
[34] Ciesienski K L,Hyman L M,Derisavifard S,et al. Toward the detection of cellular copper(Ⅱ) by a light-activated fluorescence increase[J].Inorganic Chemistry,2010,49(15):6808-6810.
[35] Jung H S,Kwon P S,Lee J W,et al. Coumarin-derived Cu2+-selective fluorescence sensor:Synthesis,mechanisms,and applications in living cells[J].Journal of the American Chemical Society,2009,131(5):2008-2012.
[36] Huang L,Cheng J,Xie K F,et al. Cu2+-selective fluorescent chemosensor based on coumarin and its application in bioimaging[J].Dalton Transactions,2011,40(41):10815-10817.
[37] Chen F J,Hou F P,Huang L,et al. Development of a novel fluorescent probe for copper ion in near aqueous media[J].Dyes and Pigments,2013,98(1):146-152.
[38] Xu H X,Wang X Q,Zhang C L,et al. Coumarin-hydrazone based high selective fluorescence sensor for copper(Ⅱ) detection in aqueous solution[J].Inorganic Chemistry Communications,2013,34:8-11.
[39] Yuan L,Lin W Y,Chen B,et al. Development of FRET-based ratiometric fluorescent Cu2+chemodosimeters and the applications for living cell imaging[J].Organic Letters,2012,14(2):432-435.
[40] Xu Y H,Zhou Y,Ma W H,et al. Highly sensitive and selective OFF-ON fluorescent sensor based on functionalized Fe3O4@SiO2nanoparticles for detection of Zn2+in acetonitrile media[J].Applied Surface Science,2013,276:705-710.
[41] Zhao Liyun,Mi Qili,Wang Guangke,et al. 1,8-Naphthalimide-based“turn-on” fluorescent sensor for the detection of zinc ion in aqueous media and its applications for bioimaging[J].Tetrahedron Letters,2013,54(26):3353-3358.
[42] Li H Y,Gao S,Xi Z. A colorimetric and “turn-on” fluorescent chemosensor for Zn(Ⅱ) based on coumarin Shiff-base derivative[J].Inorganic Chemistry Communications,2009,12(4):300-303.
[43] Su Z A,Chen K Y,Guo Y A,et al. A coumarin-based fluorescent chemosensor for Zn2+in aqueous ethanol media[J].Journal of Fluorescence,2010,20(4):851-856.
[44] Yan M H,Li T R,Yang Z Y. A novel coumarin Schiff-base as a Zn(Ⅱ) ion fluorescent sensor[J].Inorganic Chemistry Communications,2011,14(3):463-465.
[45] Xu Z C,Liu X,Pan J,et al. Coumarin-derived transformable fluorescent sensor for Zn2+[J].Chemical Communications,2012,48(39):4764-4766.
[46] Li J,Zhang C F,Ming Z Z,et al. Coumarin-based novel fluorescent zinc ion probe in aqueous solution[J].Tetrahedron,2013,69(23):4743-4748.
[47] Tang L J,Cai M J,Huang Z L,et al. Rapid and highly selective relay recognition of Cu(Ⅱ) and sulfide ions by a simple benzimidazolebased fluorescent sensor in water[J].Sensors and Actuators B:Chemical,2013,185:188-194.
[48] Wu J S,Sheng R L,Liu W M,et al. Fluorescent sensors based on controllable conformational change for discrimination of Zn2+over Cd2+[J].Tetrahedron,2012,68(27-28):5458-5463.
[49] Song Z K,Dong B,Lei G J,et al. Novel selective fluorescent probes for sensing Zn2+ions based on a coumarin Schiff-base[J].Tetrahedron Letters,2013,54(36):4945-4949.
[50] Mizukami S,Okada S,Kimura S,et al. Design and synthesis of coumarin-based Zn2+probes for ratiometric fluorescence imaging[J].Inorganic Chemistry,2009,48(16):7630-7638.
[51] Ouyang H,Gao Y,Yuan Y F. A highly selective rhodamine-based optical-electrochemical multichannel chemosensor for Fe3+[J].Tetrahedron Letters,2013,54(23):2964-2966.
[52] Yao J N,Dou W,Qin W W,et al. A new coumarin-based chemosensor for Fe3+in water[J].Inorganic Chemistry Communications,2009,12(2):116-118.
[53] Tang L J,Li F F,Liu M H,et al. A new rhodamine B-coumarin fluorochrome for colorimetric recognition of Cu2+and fluorescent recognition of Fe3+in aqueous media[J].Bulletin of the Korean Chemical Society,2011,32(9):3400-3404.
[54] Chen G F,Jia H M,Zhang L Y,et al. A highly selective fluorescent sensor for Fe3+ion based on coumarin derivatives[J].Research on Chemical Intermediates,2012,39(9):4081-4090.
[55] 马文辉,彭孝军,徐群,等. 香豆素类荧光传感器[J]. 化学进展,2007,19(9):1258-1266.
New progress in coumarin-based fluorescence sensor for metal ions
SHU Jieming,GAO Yunling,YAO Kejian,HU Ying
(College of Chemical Engineering and Materials Science,Zhejiang University of Technology,Hangzhou 310014,Zhejiang,China)
Metal ions have a significant impact on the environment and the growth and development of organism,therefore,the recognition and detection of metal ions in the environment and organism is gaining widespread attention. Among different analytical methods,fluorescence analysis has the advantages of high sensitivity,good selectivity,real-time andin situdetection,etc.,which is a good tool to achieve the recognition and detection of metal ions in the environment and organism. This paper is aimed to review the coumarin-based fluorescent sensors for the recognition and detection of heavy metal ions (Hg2+、Pb2+、Cd2+、Ni2+、Ag+),biologically important transition metal ions (Cu2+、Zn2+、Fe3+) and their applications in recent five years,focusing on the design and synthesis of sensors,recognition mechanism,sensing characteristics and applications. With the higher requirement for metal ions detection,the design of coumarin-based fluorescent sensors will be developed for better performance with higher sensitivity,selectivity and stronger anti-interference in the future. In addition,applications of coumarin-based fluorescent sensors in biological detection are expected to be further developed.
coumarin; sensor; selectivity; complex
TP 212.2
A
1000-6613(2014)12-3144-13
10.3969/j.issn.1000-6613.2014.12.004
2014-03-18;修改稿日期:2014-05-08。
国家自然科学基金(20807037)及浙江省自然科学基金(LY12B07010)项目。
舒杰明(1987—),男,硕士研究生。联系人:高云玲,博士,副教授,主要研究方向为超分子化学及光化学分子传感器的合成及检测、生物识别。E-mail gaoyl@zjut.edu.cn;姚克俭,教授,主要研究方向为传质与分离。E-mail yaokj@zjut.edu.cn。
