高岭土界面电化学性能及其对重金属的吸附研究
2014-07-05张树芹路福绥姜林
张树芹,路福绥,姜林
山东农业大学化学与材料科学学院,山东泰安271018
高岭土界面电化学性能及其对重金属的吸附研究
张树芹,路福绥,姜林
山东农业大学化学与材料科学学院,山东泰安271018
分别采用质量滴定法(MT)、电势滴定法(PT)测定了荷结构负电荷的高岭土的零电荷点,MT法与PT法的实验结果分别为:3.70±0.05和2.16,质量滴定法结果明显高于电位滴定法。结合表面络合模型推算了表面位密度(Ns)及各特征络合平衡常数pK、pK、pK。研究了Pb2+在高岭土上的吸附性能,考察了pH值、离子强度等因素对吸附量的影响,并探讨了吸附机理。高岭土吸附Pb2+的动力学曲线符合准二级动力学方程,吸附等温线符合Langmuir方程。Pb2+同时以内层络合和外层络合形式吸附,其相对量与pH有关;在pH小于4和大于8的范围内,内层络合物为主,而pH在4~8范围内外层络合物比例增大。
质量滴定;电位滴定;高岭土;Pb2+;吸附
随着工业生产的发展,污染物的排放已使环境日趋恶化,直接或间接地对各种生物造成了危害,并给人类健康带来威胁。重金属污染是环境中最为严重的污染之一,特别是铜、铅、铬、镉、汞等重金属离子,甚至在一些地区,重金属的污染已严重破坏了生态平衡,直接威胁到人类的生存[1]。重金属污染土壤的修复及废水的处理已成为环境科学与工程领域的研究热点之一。重金属在固-液界面的吸附行为是了解重金属的地球化学过程和环境生态效应、开发污染土壤修复及废水处理技术的基础。相关研究已很多[2-7],但由于其复杂性,至目前为止对其行为和机理的认识还很模糊,特别是对其内在规律的了解还很肤浅。固-液界面电化学行为是涉及环境化学、黏土化学和水化学等研究领域的最基本现象之一。科学认识黏土-水界面电化学行为,对了解和控制黏土环境污染物的形态分布、迁移转化及归宿等具有十分重要的意义。
1 材料与方法
1.1仪器与试剂
用Omniorp100 cx型比表面积和孔径分布分析仪(美国Coulter公司)测定样品的比表面积和平均孔径。采用IRIS ADVANTAGE型电感耦合等离子体发射光谱仪(美国THERMO JARRELLASH公司)测定样品的化学组成。采用Zetasizer3000型粒度分布分析仪(英国Malverrn公司)测定样品的平均粒径。
测定样品的化学组成。采用Zetasizer3000型粒度分布分析仪(英国Malverrn公司)测定样品的平均粒径。
高岭土:上海三浦化工有限公司出品,化学纯,配成悬浮体备用。分析表明,其化学组成式为(Si1.95Al0.05)(Al1.94Mg0.02Fe0.04)O5(OH)4Na0.04K0.04,平均粒径为1.26 μm;比表面积11.20 m2/g,平均孔径4.13 nm。100 mg/L的铅元素标准储备液由国家标准物质研究中心提供;吸附实验所用的Pb2+溶液由分析纯Pb(NO3)2加适量的去离子水配制;硝酸、氢氧化钠均为优级纯,其他试剂均为分析纯;实验用水为去离子水。
1.2阳离子交换容量测定[8]
准确称量1.0000 g样品,加入50.00 mL浓度为0.5 mol/LNH4Cl的C2H5OH溶液(V(C2H5OH):V (H2O)=1:1),搅拌30 min,老化4 h,过滤,用20 mL C2H5OH溶液洗涤沉淀,滤液和洗液一并转移到100 mL容量瓶中定容。
抽取待测液5.00 mL,滴入2滴甲基红指示剂,用碱溶液滴定呈黄色后,加入10 mL体积百分含量为37%中性甲醛,再加入2滴酚酞指示剂,煮沸,立即用NaOH标准溶液滴定,溶液颜色由玫瑰红色→浅红→橙红色为止,消耗NaOH标准溶液的体积为V1mL。移取0.5 mol/L NH4Cl的C2H5OH溶液5.00 mL,同样滴定至终点消耗NaOH标准溶液的体积为V2mL,则样品的阳离子交换容量(CEC)为:

1.3零电荷点测定
电势滴定(Potentiometric titration)参考文献[9]:分别称取2.000 g的土样于若干带刻度的50 mL离心管中,并分成三组,向各组离心管中分别加入浓度为0.2 mol·L-1、0.02 mol·L-1和0.002 mol·L-1的电解质(NaNO3)溶液10 mL,然后在离心管中加入适量0.1 mol·L-1的HNO3溶液,以调节离心管间具有不同的pH值,用蒸馏水补充至总溶液体积为20 mL。将所有离心管放入恒温振荡器中(控温25±0.2°C)震荡24 h后,测定体系的pH值以获得吸附平衡时的[H+]和[OH-]。同时作空白实验(不加土样和HNO3溶液)。吸附质子电荷(Adsorbed proton charge)密度(mmol·g-1)可通过下式计算:
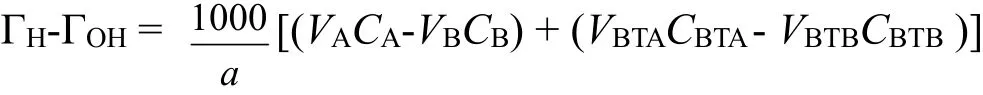
式中,a是体系的土样质量(g),CA和CB为体系中加入酸或碱的浓度(mol·L-1)。VA、VB为体系中加入酸或碱的体积(mL),以ΓH-ΓOH对体系平衡pH值作图,即得电势滴定曲线。
质量滴定(Mass titration)参考文献[10]:取一定量的浓度分别为0.001、0.01和0.1 mol·L-1的NaNO3溶液,用HNO3或NaOH溶液调节初始pH,加入一定量的土样,恒温25±0.2°C下振荡15 min,测定悬浮体的平衡pH。以pH对固体浓度(Cs)作图即得质量滴定曲线。
所有的滴定实验均在氮气保护下进行,以避免空气中CO2干扰。
1.4吸附实验方法
在100 mL的聚丙烯离心管中,分别加入设计量的黏土悬浮体、NaNO3溶液和Pb2+溶液,混合均匀,用硝酸和氢氧化钠溶液调节pH值,加蒸馏水使吸附体系的总体积为20 mL,高岭土的固含量恒为5.0 g·L-1。放入THZ-82恒温振荡器(常州国华电器有限公司)中,在25℃和180 r/min条件下振荡一定时间(t),用离心机(上海安亭科学仪器厂)在12000 rpm下离心20 min。上层清液经0.45 μm滤膜过滤、酸化后用电感耦合等离子体发射光谱仪(ICP,美国热电公司)测定Pb2+浓度,同时做空白(不加吸附剂)实验。根据吸附前后浓度的变化计算Pb2+的吸附量(q)。
2 结果与分析
2.1零净电荷点
图1是高岭土在NaNO3浓度分别为0.002、0.02和0.2 mol·L-1时的电势滴定曲线,可见电势滴定曲线间的确存在一个公共交点,与理论分析一致,由其对应的pH可知所研究土样的零净电荷点pHPZNC为2.16。
根据质量滴定法的原理,固体颗粒样品加入到pH值不等于样品的pHPZNC时,因颗粒表面对H+或OH-的吸附而将改变体系的pH值;当液体介质的pH值高于pHPZNC时,因颗粒表面对OH-的净吸附而使pH值降低,反之,当液体介质的pH值低于pHPZNC时,因颗粒表面对H+的净吸附而使pH值升高。因此,悬浮体的pH值将随固含量的增加而将向pHPZNC移动,固含量达到一定值之后体系的pH值将与pHPZNC相等,随后体系的pH值将与固含量无关,即在质量滴定曲线上将有一平台,对应的pH值为固体颗粒的pHPZNC。图2是不同离子强度下不同初始pH值时的质量滴定曲线,在pH=3.70±0.05的范围内出现一个平台,证明离子强度(或电解质浓度)对荷结构电荷胶体的pHPZNC没有影响,所研究高岭土样品的pHPZNC在3.7左右。
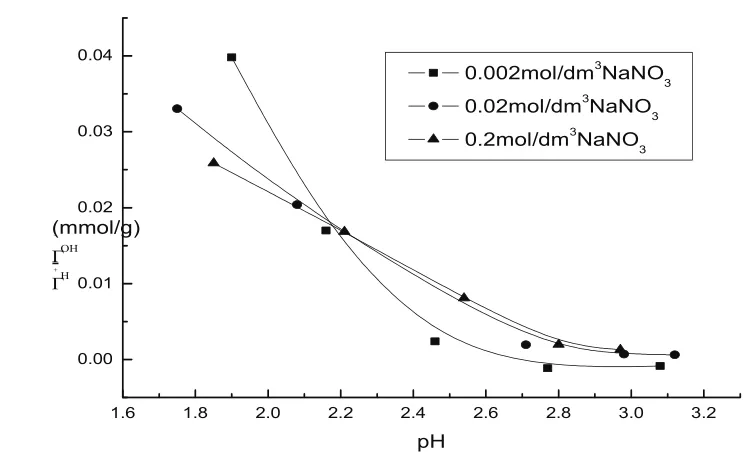
图1 高岭土的电势滴定曲线Fig.1 Potentiometric titration curves of kaolinite at different ionic strengths

图2 高岭土在不同离子强度和不同初始pH值时的质量滴定曲线Fig.2 Mass titration curves of kaolinite at different ionic strengths and initial pH values
对比电势滴定、质量滴定所测定的高岭土样品的pHPZNC值可知,而质量滴定法的结果明显高于电势滴定法,可能与固含量高时pH值的测定误差较大有关。相比较而言,质量滴定法操作简单、快捷,电势滴定法相对繁琐。高固含量时pH值测定困难使质量滴定法的应用受到限制。
图3为高岭土体系中粒子的Zeta电位随pH值的变化。低pH时,Zeta电位为正值;pH值增大,Zeta电位逐渐变为负值。对于纯高岭土分散体系:pH在3~6范围内,随pH值的增加粒子的Zeta电位迅速下降;pH在6~9范围内Zeta电位变化不大;pH在9~12范围内随pH值的增加粒子的Zeta电位又迅速下降。纯高岭土分散体系粒子的等电点IEP在pH=4左右。
2.2表面质子活性位密度的估算

图3 高岭土体系中粒子的Zeta电位Fig.3 Zeta potential of kaolinite particles
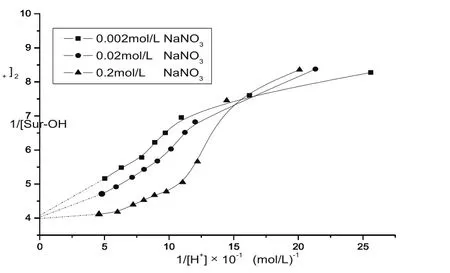
图4 高岭土样品在不同电解质浓度时的1/[Sur-O]~1/[H+]曲线Fig.4 Plots of 1/[Sur-O]~1/[H+]for kaolinite at at various electrolyte concentrations
2.3特征界面反应平衡常数
实验测得高岭土样品的CEC为89 μmol/g。黏土的CEC可看作有效结构电荷密度,即所研究的高岭土样品的有效结构电荷密度σst为-89 μmol/g。根据实验测定的pHPZNC、Ns和σst值直接计算得出高岭土的特征界面反应平衡常数,即1-pK模型中的pK、2-pK模型中的pK和pK分别为2.93,1.90和3.97。
2.4吸附实验结果
2.4.1 吸附动力学分别测定了不同pH值、不同Pb2+初始浓度(co)下,Pb2+在高岭土上的吸附动力学曲线,图5是pH6.0、25℃、co=150 mg·L-1时的实验结果,其它条件下的结果与之相似。可以看出,吸附过程可分两个阶段,即初始的快速吸附阶段和后期的缓慢吸附阶段。为使吸附体系充分达到平衡,在测定平衡吸附量(qe)的实验中,吸附时间定为24 h。采用常用的动力学方程,即准一级动力学方程、准二级动力学方程、Elovich方程、双常数方程和抛物线扩散方程,对动力学吸附过程进行了拟合,发现准二级动力学方程可很好地描述Pb2+在高岭土上的吸附动力学曲线。拟合结果见图6。

图5 Pb2+在高岭土上的吸附动力学曲线Fig.5 Sorption kinetics of Pb2+on kaolinite at 25℃,pH=6.0,co=150 mg·L-1.
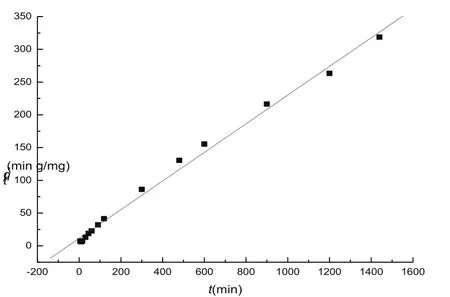
图6 Pb2+在高岭土上准二级动力学方程拟合曲线Fig.6 Pseudo-second order kinetic model plots for Pb2+on kaolinite
2.4.2 吸附等温线图7是pH=6.0、25℃条件下,Pb2+在高岭土上的吸附等温线,可明显看出是Langmuir型等温线。Langmuir直线式为:ce/qe=1/(kqmax)+ce/qmax,式中ce是Pb2+的平衡浓度,qe是平衡吸附量,qmax是饱和吸附量,k是与吸附能有关的常数。以ce/qe对ce作图均得到良好的直线。根据直线的斜率和截距得到的Langmuir等温线参数qmax和k。高岭土的qmax为8.33 mg/g,但若换算成单位面积上的吸附量,为0.74 mg/m2。高岭土的结构负电荷密度为0.008 mmol/m2。
2.4.3 pH值和离子强度对吸附的影响图8为25℃、初始浓度co为250 mg·L-1时,起始pH值和离子强度对吸附量的影响。可以看出,随pH值的增大吸附量逐渐升高,在pH小于4范围内升高幅度较大,pH在4~8范围内变化较小,而在pH大于8后升高幅度又有所增大。电势滴定实验证明,高岭土的零净电荷点(point of zero net charge,pHPZNC)为2.2,根据界面电离模型和扩散静电模型模拟,高岭土的零净质子电荷点(point of zero net proton charge,pHPZNPC)在8左右。在所研究的pH范围内,随pH值的增大,净负电荷密度增大,同时表面-O-基团密度也增大,因而吸附量逐渐增大。在pHPZNC附近(pH小于4范围内),净负电荷密度随pH值增大而增大的幅度较大,因而吸附量增大的幅度也较大;在pH高于pHPZNPC后,表面-O-基团的密度随pH值增大而增大的幅度也较大,因而吸附量随pH值增大又有较大的增高。pH在4~8范围内,净负电荷密度变化幅度不大,而表面羟基以-OH2+形式为主,因而吸附量变化不大。
黏土颗粒界面相的pH可由Boltzmann分布方程和Nernst方程推算。
Boltzmann分布方程为:[H+]s=[H+]exp(-eψ0/κT)
Nernst方程为:ψ0=(2.30κT/e)(pHPZNC–pH)
式中,[H+]s和[H+]分别表示界面相和本体溶液中H+的活度,e是电子电荷,κ是Boltzmann常数,T是绝对温度,ψ0是表面电势。由Boltzmann分布方程和Nernst方程可以得出黏土颗粒表面相的pH与pHPZNC相近,而与本体溶液的pH值无关。高岭土的pHPZNC很低,在pH 2~2.5范围内,所以在所研究的Pb2+浓度范围内不会发生表面沉淀。
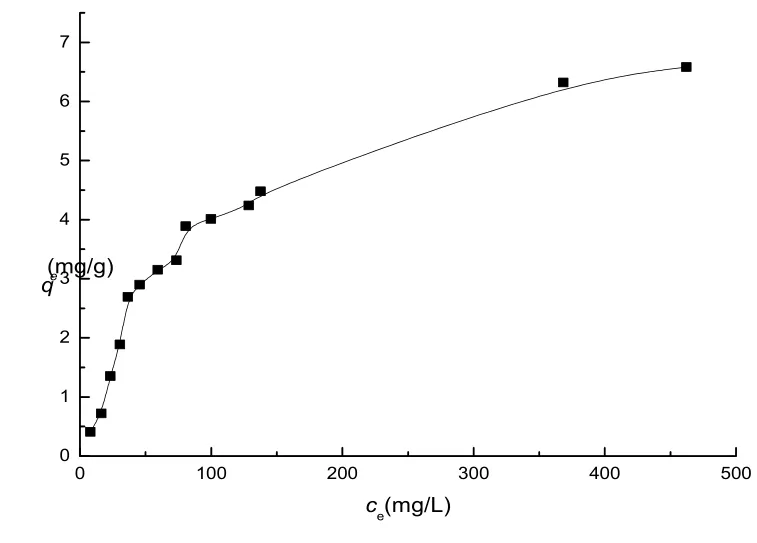
图7 Pb2+在高岭土上的吸附等温线(pH=6.0,25℃) Fig.7SorptionisothermsofPb2+onkaolinite (pH=6.0,25℃)
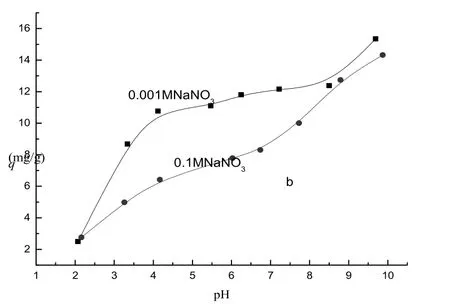
图8 pH和离子强度对Pb2+在高岭土上吸附的影响Fig.8 The effects of pH and ionic strength on the adsorption of Pb2+on kaolinikte(initial Pb2+concentration 250 mg·L-1, pH=6.0 and 25℃at adsorbent dose 2.5 g·L-1
可以看出离子强度(NaNO3浓度)对吸附量有明显影响,离子强度增大,吸附量降低。有关离子强度对重金属在黏土表面吸附的影响已有很多报道[13-15],O’Day[15]等人发现离子强度增大吸附量降低,而Echeverrıa[16]等人的实验结果证明离子强度变化对吸附量影响很小。为了解释离子强度对吸附量的影响,Sposito[17]等人提出了吸附层在微观上可分为“内络合层”和“外络合层”的假设,其合理性被双电层模型数值模拟结果所证实[18]。重金属离子与固体粒子表面的作用可分为两个方面:其一是化学键合作用,即重金属离子与表面功能基团(如-O-基团)键合形成内络合层,其反应式可表示为Sur-OH +Pb2+⇌Sur-O-Pb-OH2++H+;其二是静电作用,重金属离子分布在离固体粒子表面一定距离上形成外络合层。内络合层吸附具有强的选择性和不可逆性,不受离子强度的影响;外络合层吸附没有选择性,具有较强的可逆性,受离子强度的影响较大。离子强度增大,能屏蔽重金属离子与黏土颗粒间的静电引力作用,故可降低外络合层的吸附量。因而,通过考察离子强度对吸附量的影响可判别重金属离子的吸附形态[19]。图8离子强度对吸附量有明显影响的结果表明Pb2+在黏土表面的吸附存在外层络合形式。进一步分析图8结果还可以发现,在pH小于4和大于8的范围内离子强度的影响相对较小,而在pH4~8范围内影响较大,这预示pH对Pb2+在黏土表面的吸附形态有影响。由此可以假设,Pb2+在黏土表面的吸附也存在内层络合形式,即Pb2+同时以内层络合和外层络合的形式吸附在黏土表面上。在pH小于4和大于8的范围内,Pb2+主要以内层络合的形式吸附,而在pH4~8范围外层络合物的比例增高。Daniel[13]曾报道过吸附形态与pH有关的研究结果。在pH小于4的范围内,因接近粘土的pHPZNC,净负电荷密度较低,Pb2+与黏土表面的静电引力较小,故Pb2+主要以内层络合方式吸附;在pH大于8的范围内,黏土表面羟基以-O-形式为主,高密度的-O-基团的存在有利于内层络合的形成;在pH4~8范围内较高的净负电荷密度导致较高比例的外层络合物的形成。
3 结论
采用电势滴定法、质量滴定法所测得的高岭土样品的pHPZNC值分别为2.16和3.70±0.05,质量滴定法的结果明显高于电势滴定法,可能与固含量高时pH值的测定误差较大有关。相比较而言,质量滴定法操作简单、快捷,电势滴定法相对繁琐。高岭土样品的Ns值为0.25 mmol/g,其各特征界面反应平衡常数pK、pK、pK分别为2.93、1.90、3.97。高岭土吸附Pb2+的动力学曲线符合准二级动力学方程,吸附等温线符合Langmuir方程。pH增高,吸附量增高;离子强度增大,吸附量下降。Pb2+同时以内层络合和外层络合形式吸附,其相对量与pH有关;在pH小于4和大于8的范围内,内层络合物为主,而pH在4~8范围内外层络合物比例增大。
[1]Berninger K,Pennanen J.Heavy metals in perch from two acidified lakes in the salpausselka esker area in Finland[J].Water,Air and Soil Pollution,1995,81(3-4):283-294
[2]Krishna G B,Susmita S G.pb(Ⅱ)uptake by kaolinite and montorrillonite in aqueous medium[J].Colloids and Surfaces A,2006,277(1-3):191-200[3]Serrano S,Garrido F,Campbell C G,et al.Competive sorption of cadmium and lead in acid soils of cen tral spain[J]. Geoderma,2005,124:91-104
[4]Susmita S G,Krishn G B.Interaction of metal ions with clays:I.A case study with Pb(II)[J].Applied Clay Science, 2005,30(3):199-208
[5]Hizal H,Apak R.Modeling of copper(II)and lead(II)adsorption on kaolinite-based clay minerals individually and in the presence of humic acid[J].J Colloid Interface Sci,2006,295(1):1-13
[6]Heidmann I,Christl I,Kretzschmar R.et al.Adsorption of Cu and Pb to kaolinite-fulvic acid colloids:Assessment of sorbent interactions[J].Geochimica et Cosmochimica,2005,69(7):1675-1686
[7]Cynthia A C,Raymond N Y.Aspects of kaolinite characterization and retention of Pb and Cd[J].Applied Clay Science, 2002,22(1-2):39-45
[8]张乃娴.粘土矿物研究方法[M].北京:科学出版社,1990
[9]熊毅.土壤胶体:第二册[M].北京:科学出版社,1985:404-425
[10]Preocanin T,Kallay N.Application of“mass titration”to determination of surface charge of metal oxides[J].Croat ChemActa,1998,71:1117-1125
[11]Mustafa S,Dilara B,Neelofer Z,et al.Temperature effect on the surface charge properties of Al2O3[J].J Colloid Interface Sci,1998,204:284-293
[12]Tari G,Olhero S M,Ferreira J M F.Influence of Temperature on Stability of Electrostatically Stabilized Alumina Suspensions[J].J Colloid Interface Sci,2000,231(2):221-227
[13]Daniel G,Strawn and Donald L.The Use of XAFS to Distinguish between Inner-and Outer-Sphere Lead Adsorption Complexes on Montmorillonite[J].J Colloid Interface Sci,1999,216(2):257-269
[14]Papelis C,Hayes K F.Distinguishing between interlayer and external adsorption sites of clay minerals using X-ray absorption spectroscopy[J].Colloids Surf,1996,107:89-96
[15]O’Day P,Parks G A,Brown G E.molecular structure and binding sites of cobalt surface complexes on kaolinite from x-ray adsorption spectroscopy[J].Clays Clay Miner,1994,42(3):337-355
[16]Echeverrıˊa J,Indurain J,Churio E,et al.Simultaneous effect of pH,temperature,ionic strength,and initial concentration on the retention of Ni on illite[J].J Colloids and Surfaces A,2003,218:175-187
[17]Sposito G.The chemistry of soil[M].New York:Oxford University Press,1989
[18]Rahnemaie R,Hiemstra T,Riemsdijk W H.Inner and outer sphere complexation of ions at the goethite solution interface[J].J Colloid Interface Sci,2006,297(2):379-388
[19]Anne M L,Kraepiel,Klaus K,et al.AModel for Metal Adsorption on Montmorillonite[J].J Colloid Interface Sci,1999, 210(1):43-54
Interface Electrochemical Characteristics in Kaolinite and Its Effect on the Adsorption Properties to Heavy Metal
ZHANG Shu-qin*,LU Fu-sui,JIANG Lin
College of Chemistry and Material Science,Shandong Agricultural University,Shandong Taian271018,China
The point of zero charge of the kaolinite with structural negative charge was measured by mass titration and potentiometric titration.Result shows that the rage of PZC for MT method was 3.70±0.05 which was significantly higher than PT method(2.16).According to the surface complexation model the surface site density and intrinsic surface reaction equilibrium constants(pK、pKt、pK、)were calculated.Adsorption properties of Pb2+on kaolinite were studied,the influence of solution pH and ion strength on the adsorption of Pb2+were investigated,and the adsorption mechanism was discussed.The adsorption kinetics of Pb2+on kaolinite can be described by the pseudo-second-order kinetics equation,the adsorption isotherms fitted well with Langmuir.The adsorption mechanism of Pb2+on kaolinite is the surface complex mechanism,simultaneously forming inner-sphere surface complexes and outer-sphere surface complexes.The relative content of outer-sphere surface complexes is dependent of pH,and that in the pH range of 4~8 is higher than in the pH ranges of lower than 4 and higher than 8,respectively.
Mass titration;potentiometric titration;kaolinite;Pb2+;adsorption
O647
A
1000-2324(2014)05-0675-05
2011-03-09
2011-03-22
山东省自然科学基金(ZR2009DM032);山东省博士基金(2008BS07016);山东农业大学青年创业基金(23621)
张树芹(1969-),女,副教授,从事污染物防治及农药稳定性研究.
