甲缩醛合成反应及其动力学研究进展
2014-07-05魏焕梅李臻
魏焕梅,李臻
(1中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000;2中国科学院大学,北京 100039)
进展与述评
甲缩醛合成反应及其动力学研究进展
魏焕梅1,2,李臻1
(1中国科学院兰州化学物理研究所羰基合成与选择氧化国家重点实验室,甘肃 兰州 730000;2中国科学院大学,北京 100039)
针对甲缩醛的合成方法,一方面以催化剂类型为主线,对醇醛缩合法、甲醇直接氧化法、二甲醚氧化法等进行了综述,并指出目前方法中存在的问题,如原料转化率低、产物纯度不高、催化剂稳定性差、工艺复杂等,进而指明甲缩醛合成应向着简化工艺、采用环保型催化剂、提高转化率和产品纯度的方向发展;另一方面,综述了国内外在甲缩醛合成反应动力学研究方向的进展情况,指出甲缩醛合成反应动力学的研究从模型的建立到装置的选择上都越来越接近工业生产的实际情况,对于工业化生产更具参考价值。甲缩醛合成动力学研究正在向着更加趋近于工业化生产的方向发展,可以为甲缩醛生产工艺和装置的建立提供更加有效的参考。
甲缩醛;催化剂;合成;醇醛缩合;动力学
甲缩醛,学名二甲氧基甲烷(简称DMM),结构式为CH3OCH2OCH3,作为甲醇的下游衍生产品,用途广泛。DMM具有良好的理化性能,如溶解性好、沸点低、与水相溶性好等,可以作为溶剂被广泛应用于橡胶工业、空气清新剂、化妆品、杀虫剂、药品、汽车行业用品、涂料行业添加剂等领域中[1]。DMM 还具有良好的去油能力和挥发性,作为清洁剂可以替代F11、F13及含氟溶剂,是替代氟里昂、减少挥发性有机物(VOCs)排放、降低大气污染的环保产品[2]。此外,DMM还是重要的化工中间体和反应溶剂,如DMM可用于制备高浓度甲醛[3],然后进一步合成聚甲醛。DMM具有较高的含氧量(42%)和碳/氢比,且可与柴油100%溶解。DMM作为一种良好的柴油添加剂[4-5],可以提高柴油的燃烧效率,减少NOx等废气的排放,近年来备受瞩目。
合成DMM的传统工艺方法是以甲醇和甲醛为原料的醇醛缩合法,这也是目前工业上普遍采用的方法。醇醛缩合的工艺路线比较成熟,但是能耗较高,设备投资比较大,污染比较严重,不利于DMM的廉价化和广泛应用。近年来以甲醇为单一原料的一步法DMM生产路线由于具有工艺简单、设备投资少、生产成本低的优势而颇受关注。从制备DMM所使用的原料角度来划分,可以将DMM的合成方法划分为以下几种:甲醇和甲醛(三聚甲醛或者多聚甲醛)为原料的合成方法、甲醇直接氧化法、二甲醚氧化法等。本文按照此分类方法对DMM的合成研究进展进行总结和评述。近年来,有关 DMM合成反应动力学的研究正在受到重视,因此在对DMM合成方法综述的基础上,本文对DMM合成反应动力学研究现状也进行了综述,希望能对DMM 合成新工艺开发和工业化生产流程的设计提供一定的参考。
1 甲缩醛的合成
1.1 醇醛缩合反应制备甲缩醛
在DMM的合成方法中,醇醛缩合反应是一种比较传统且工艺较为成熟的方法。甲醇与甲醛的缩合是一个平衡限制反应[6],平衡转化率一般都在50%以下,因此需要在催化剂的作用下才能达到理想的反应速率,其反应方程式如式(1)。
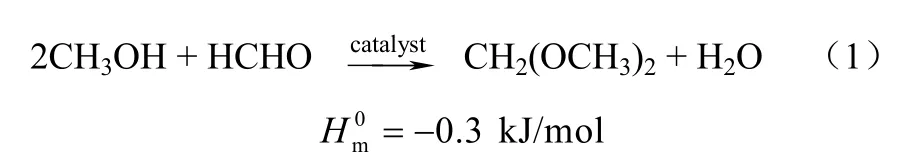
此方法对催化剂的要求不高,但是由于原料中水含量较高,反应转化率普遍较低。
随着DMM合成技术的发展,DMM的合成原料由甲醇和甲醛逐渐发展到甲醇和三聚甲醛或者多聚甲醛。雷艳华等[7]从热力学角度分析了三聚甲醛或多聚甲醛作为DMM合成反应原料的可行性。相比于甲醛水溶液,聚甲醛以固体形式存在,减少了原料中的水含量,有利于DMM合成反应的进行。以下根据使用的催化剂不同分别对这些研究进展进行综述。
1.1.1 硫酸催化剂
在早期的研究中,硫酸、氢氟酸等无机酸是常用的催化甲醇与甲醛水溶液反应制备DMM的催化剂[8],这种方法虽然操作简单,但是反应转化率较低,催化剂与生成物分离困难,无机酸的强酸性和强氧化性增加了设备成本,生产中产生了大量废液,化学工艺上难以实现连续生产,与当前所倡导的绿色可持续化学不相符,将逐渐被淘汰。为了开发新的DMM合成途径,许春梅等[9]以多聚甲醛替代甲醛水溶液,研究了硫酸催化甲醇和多聚甲醛合成DMM 的反应过程。反应采用甲苯作为溶剂,考察了反应温度、原料配比、催化剂用量对甲醇转化率的影响。实验结果表明,在适宜的工艺条件下,甲醇的平衡转化率为 84.6%,DMM的选择性达到97.9%。为进一步提高甲醇的转化率和 DMM的收率,将精馏技术应用到甲醇与多聚甲醛反应合成DMM的过程中,生成的DMM以DMM、甲醇和水的共沸物形式蒸出,甲醇的平衡转化率达91.8%,DMM的选择性为99.4 %,精馏产品的质量组成为DMM 91.1 %、甲醇6.8 %、水2.1 %。由此可见,采用精馏技术后,DMM收率升高,同时使后处理过程简化,是值得推广应用的便捷方法。催化精馏是20世纪中期发展起来的一种新技术,它是通过精馏塔将催化反应和精馏过程有机地结合起来,并将化学反应和产物精馏集于一体的化工单元操作[11-12]。由于间歇式和半连续式反应工艺存在原料消耗高、能耗大和产品质量差等缺点,因此,近年来催化精馏技术被广泛应用到醇醛缩合制备 DMM的反应中。在甲醛和甲醇反应合成DMM的反应体系中,各组分相对挥发度的大小为:DMM>甲醇>甲醛>水,由于产物DMM具有最大的相对挥发度,因此精馏的作用是将反应产物不断从系统中分离出去,促使反应平衡向生成DMM的方向移动,可以大幅度提高甲醛的平衡转化率,通过精馏直接从塔顶得到含量大于98%的DMM。
史高峰等[10]在自行搭建的反应精馏装置上研究了无溶剂体系,硫酸催化甲醇和多聚甲醛合成DMM 的反应。作者采用正交实验确定了最优条件为:n(甲醇)/ n(多聚甲醛)= 1.9,反应温度70 ℃,反应时间2.75 h,催化剂加入量为甲醇体系的3.5%。该装置通过分水器将反应体系中的水不断移除,降低了体系中的水含量,从而提高DMM产率,甲醇转化率达到99.32%,DMM产率达到99.88%。此方法产生废液量小,制备的DMM纯度高、含水量低,较适合作为燃油添加剂使用。
褚效中[13]研究了以甲醇和甲醛为原料,以98%的浓硫酸为催化剂,通过催化精馏工艺制备 DMM的可行性,重点考察了进料醇醛摩尔比、进料总流量和催化剂含量对该过程的影响。研究表明,在回流比为 6、催化剂含量为 1%、甲醛的体积流量为2.8 mL/min、甲醇的体积流量为3.0 mL/min的条件下,塔顶产品DMM的质量分数达96.6%,该工艺可应用于制备DMM,但DMM的纯度不高。王志宏[14]以甲醇和甲醛为原料,硫酸为催化剂,研究了催化精馏与反应一体化连续合成DMM的过程。优化的反应条件为 n(甲醇)∶ n(甲醛)= 2∶1,精馏回流比为(8~10)∶1,催化剂加入量为甲醇质量的15%,DMM含量≥98%,收率≥91%。稀硫酸经过连续提浓后返回继续应用于反应催化,从而以低成本的方法得到高含量的 DMM,具有产业化应用前景。
1.1.2 固体酸催化剂
与传统的液体酸催化剂相比,固体酸催化剂具有无腐蚀、活性高、产物易分离的优势,是一种新型绿色环保型催化剂。近年来,使用固体酸催化剂制备DMM引起人们的广泛关注,到目前为止,已经开发出固载化液体酸、简单氧化物、硫化物、金属盐、沸石固体酸、杂多酸固体酸、阳离子交换树脂、黏土矿和固体超强酸9类固体酸。醇醛缩合反应中常用的固体酸催化剂主要有阳离子交换树脂、沸石分子筛、杂多酸等。
Zhang等[15]使用大孔酸性阳离子交换树脂作为催化剂,采用催化精馏柱合成 DMM。系统研究了操作条件对反应的影响,得到最佳反应条件为:回流比为5,总加料速率为3.10 kg/h,甲醇与甲醛的摩尔比为 2.5,催化剂的质量为 0.51 kg,甲醛水溶液浓度为 35.5%。在此条件下,甲醛的平均转化率达到99.6%,产物纯度为 92.1%。由于反应精馏技术结合了反应和精馏两个过程的优点,能将反应生成物DMM及时从反应区移走,从而打破化学平衡的制约,提高反应的转化率,因此在固体酸催化DMM 合成中这种高新技术也被大量采用。催化反应精馏工艺所使用的聚合物固体酸催化剂必须满足几点要求:①具有孔结构和适度的活性和选择性;②具有足够大的外表面以保证床层的低压力降;③外部浸湿效率应该趋于一致。传统的聚苯乙烯基树脂(直径为 0.5~1.2 mm)虽然可视为优良的非均相催化剂,但是不能满足精馏工艺的要求。为克服这些问题,研究人员尝试多种途径对树脂类固体酸催化剂进行修饰。Kolah等[16]详细研究了固体酸催化甲醛与甲醇缩醛化反应制备DMM的过程,并在连续催化精馏工艺中采用了一种低成本的新型硅胶担载阳离子交换树脂催化剂。研究表明,采用连续反应精馏工艺,甲醛的转化率可以达到99% 以上,而新型的硅胶担载型有机催化剂具有粒径大小可调控的优点,可直接用于连续精馏反应过程,而不会产生严重的压降问题。
Satoh 等[17]的专利公开了一种以离子交换树脂、氟化碱性树脂磺酸基衍生物或结晶沸石为固体酸催化剂,催化精馏法制备DMM的工艺。该工艺所采用的反应精馏装置连有6个装填固体酸催化剂的反应器,含有甲醇、甲醛溶液和水的反应液在精馏塔和反应器之间循环,精馏塔和各个反应器之间不断发生气-液和固-液交换,从而使蒸气相中的DMM浓度不断提高,最终获得高的DMM收率。采用这种工艺,塔顶溜出液中DMM含量高达98%,甲醇和水的含量分别为0.4% 和1.2%,以甲醛为基准计算的DMM收率为99.9%,并且反应可以连续稳定运行1000 h。
通常的强酸性阳离子交换树脂虽然不溶于水,反应后易与反应液分离,但很容易受到反应体系中金属离子的污染,稳定性不好,因此在工业化应用上受到一定限制[18]。王志亮等[19]采用液-固溶剂法将大孔阳离子交换树脂的磺酸基团与 TiCl4络合,形成新的不会被阳离子交换而失活的 Lewis酸中心,制备了金属改性D72-Ti树脂催化剂,并应用于合成DMM的反应体系。评价结果表明,以甲醇和甲醛水溶液为原料,采用间歇反应精馏塔,未改性的D72 催化合成DMM的反应收率为78.4%,而采用改性后的 D72-Ti催化剂,DMM的收率达到了92%,并且无需处理可多次重复使用。由此可见,经过金属离子改性后的 D72树脂催化剂对合成DMM反应的催化性能明显提高。吾满江·艾力等[20]利用酸和碱对LSCA-30、D-001、LSA-10型树脂进行改性,制备了改性的树脂催化剂,采用催化精馏和萃取精馏耦合的精馏塔装置,以甲醇和甲醛为原料实现了连续生产高纯度DMM(纯度>98%)。
秦建华、曹海波等[21-23]针对填料塔的不足,提出了三相流态化催化精馏的设想,并建立了一种新型催化精馏装置,即流化催化精馏塔。该装置采用筛孔板作为塔板,将强酸性离子交换树脂散放于塔板之上,在气液两相作用下,使催化剂散式流化,实现了DMM的连续催化精馏合成。在流化催化精馏塔中,催化剂流化状态良好,运行稳定,具有较大的操作弹性,完全可以满足DMM连续催化精馏合成的需要。
王淑娟等[24]在间歇反应方式下,研究了以甲醛和甲醇为原料合成DMM反应所需的催化剂。通过反应评价,从 HZSM-5、HY、HM、Hβ、γ-Al2O3中筛选出合成DMM的适宜催化剂HZSM-5分子筛。对于DMM合成反应,催化剂的表面酸分布及酸性强度是影响催化活性的主要因素,为此,他们比较了不同Si/Al比和酸交换度的HZSM-5催化活性,结果显示,Si/Al 比为 38,与酸交换 4次的HZSM-5的催化剂效果最好。采用该催化剂,在间歇反应方式下,以甲醇和甲醛为原料合成 DMM,在优化条件下,DMM平均收率以甲醛计达到53%,选择性为100%[25]。
杂多酸及其盐具有独特的酸性、氧化还原性和“假液相”行为,是一类重要的酸催化剂。将杂多酸负载在合适的载体上可提高其比表面积,改善其催化性能。负载后的杂多酸不但能使均相催化反应多相化,产物易分离、催化剂易回收,而且能使生产工艺简化,如利用催化蒸馏新工艺等。金明善等[26]以Al2O3、SiO2、TiO2、ZrO2、ZrO2-SiO2为载体制备了负载型磷钨杂多酸催化剂及 CsxH3-xPW12O40(x=1,1.5,2,2.5,3)磷钨杂多酸铯盐催化剂,考察了这些催化剂在甲醇与甲醛缩合制DMM反应中的催化活性。以 SiO2、ZrO2、ZrO2-SiO2为载体制备的固载化杂多酸催化剂具有良好的催化活性,而 Al2O3、TiO2负载的杂多酸催化剂活性很差。杂多酸铯盐CsxH3-xPW12O40的催化活性则随Cs+离子含量的增加而升高,Cs2.5H0.5PW12O40具有最高的催化活性,DMM产率可达到40%。
硅酸铝固体酸催化剂由于硅铝比在10以上,比一般固体酸表现出较强的疏水性能,甲醛溶液中的水和反应生成的水不影响其酸强度,因而催化活性高、反应选择性好。与阳离子交换树脂相比,还具有机械强度高、耐热性能好等优点。曾崇余等[27]采用不同制备方法制备了4种不同组成的硅酸铝固体酸催化剂,在间歇操作方式下,筛选获得了适宜于DMM 合成反应的硅酸铝固体酸催化剂,在优化的工艺条件下,催化剂表现出良好的催化性能,DMM合成反应的选择性达到97%以上。
1.1.3 离子液体催化剂
近年来,酸性离子液体作为一种新型的环境友好催化剂,受到广泛的关注,它具有传统催化剂不可比拟的优点:酸性可调、低挥发性、腐蚀性小、易分离、无废酸排放。耿丽等[28]在[Hmim]HSO4离子液体催化作用下,以甲醇和甲醛为原料合成DMM,在间歇反应工艺方式下,考察了反应温度、原料摩尔比、催化剂用量、反应时间、催化剂循环利用等因素对反应的影响。在优化的反应条件下,甲醛的转化率和 DMM的收率分别达到 83%和55%。离子液体催化剂在重复使用3次后仍能保持较好的催化活性。
杨洁等[29]制备并表征了[Epy]HSO4酸性离子液体,用浸渍法和溶胶-凝胶法对其进行负载,并将此固载化离子液体应用于催化甲醇与甲醛缩合生成DMM 的反应。结果表明,以溶胶-凝胶法固载的[Epy]HSO4作为催化剂效果最佳,选择性为100%,反应产率达到67.4%,重复使用5次后催化活性没有下降。
目前采用离子液体为催化剂的DMM合成反应研究还不多见,随着更多结构新颖、性能优异的新型功能化离子液体的设计合成,利用离子液体催化改善DMM合成反应过程、提高反应效率将是制备高纯度DMM的可行途径。
1.2 甲醇直接氧化法制备甲缩醛
目前,工业上采用的醇醛缩合法生产DMM的原料是甲醇和甲醛,而甲醛也是由甲醇部分氧化生产的。因此为得到 DMM,必须先将甲醇氧化为甲醛,然后甲醛再与甲醇进行反应生成 DMM。这种两步反应不但成本偏高,而且生产工艺路线也较长,同样吨位的生产装置投资规模较大。甲醇直接氧化制备 DMM,是将甲醇的氧化和缩合反应进行耦合一步反应得到 DMM,这在经济和环境上都是有利的,如式(2)~式(4)。
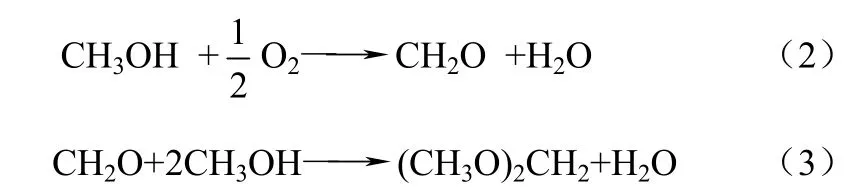
总反应:
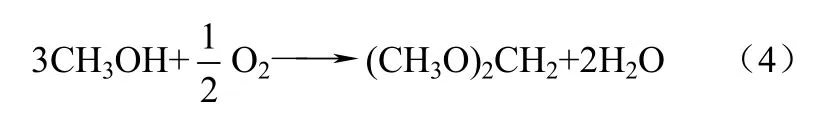
与现行的甲醇两步法生产路线相比,甲醇选择氧化一步法生产DMM工艺可以减少投资,降低生产成本,因此近几年此类研究的报道逐渐增多[30-38]。由于甲醇选择氧化产物与催化剂的酸碱性密切相关,因此一步氧化法工艺对催化剂要求较高,所需催化剂应具备相互匹配的氧化还原中心和酸性中心,既能将甲醇氧化、缩合生成 DMM,又不至于将其深度氧化生成 COx或深度脱水生成二甲醚(DME)。甲醇选择氧化一步法合成DMM的催化剂主要包括钒基氧化物催化剂、杂多酸催化剂和贵金属氧化物催化剂等。
1.2.1 钒基氧化物催化剂
钒基氧化物催化剂包括 V2O5/TiO2催化剂和其他不同载体的钒基氧化物如 VOx/Al2O3、VOx/ZrO2和VOx/MgO3等催化剂。关于甲醇在V2O5/TiO2催化剂上的氧化反应已有大量文献报道,氧化产物因催化剂制备方法和反应条件的不同而有很大变化[39-44]。在传统 V2O5/TiO2催化剂的催化作用下,反应温度较低时,DMM的选择性较高,但是甲醇的转化率较低;提高反应温度虽然可以提高反应的转化率,但却导致DMM的选择性大幅度降低,而副产品甲醛和甲酸甲酯的选择性却大大提高。若再进一步提高反应温度,则会发生甲醇的深度氧化。这说明传统的 V2O5/TiO2催化剂的氧化还原中心较强而酸中心相对较弱。所以通过提高 V2O5/TiO2催化剂的表面酸性来提高甲醇选择氧化生产DMM选择性是有效的解决途径。
钒钛催化剂的制备方法对其结构、表面酸性、氧化性、反应性能有较大影响。Guo等[45-46]比较了快速燃烧法(RC)、浸渍法(IM)和机械混合法(PM)制备的钒钛催化剂对甲醇氧化制备DMM反应性能的影响,发现快速燃烧法(RC)制备的钒钛催化剂具有较小的颗粒、较高的钒分散度、较强的氧化还原能力和较多的酸性中心,因而具有更好的合成DMM 性能。这一研究结果表明,钒钛催化剂中钒氧化物呈单层分散时,有利于酸性中心的形成,此时催化剂的氧化还原能力较强,催化活性和选择性最高。郭荷芹等[38,47]的研究也证明,在钒钛催化剂制备过程中,通过控制硫添加量和焙烧温度,可以实现钒氧化物和硫酸盐的高度分散,从而使得到的催化剂具有较强氧化还原能力和较多的弱酸性中心。弱酸中心数的增加显著提高了DMM的选择性及其收率,并明显抑制了氧化产物甲酸甲酯的生成,DMM 选择性和甲醇转化率分别达 91.76% 和48%。此外,由于S和钒钛之间较强的相互作用,使S具有较好的稳定性,催化剂结构、组成成分和酸性中心在反应前后无太大变化。
Fu等[43]和Lu等[48]分别采用浸渍法制备了硫酸改性的 V2O5/TiO2催化剂,研究发现酸改性后的钒钛催化剂相比于单纯的钒钛催化剂而言,DMM选择性和甲醇的转化率均有提高。Fu等[43]用硫酸根对V2O5/TiO2催化剂的表面进行了酸性修饰,以 10%的 V2O5/TiO2通过等体积浸渍不同的硫酸盐,使用的硫酸盐包括Ti(SO4)2、(NH4)2SO4、K2SO4和稀硫酸等。研究发现,采用酸性硫酸盐 Ti(SO4)2、(NH4)2SO4和稀硫酸时,都显著提高了 V2O5/TiO2上甲醇选择氧化的甲醇转化率和DMM的选择性,而采用K2SO4浸渍时却抑制了V2O5/TiO2的活性。
研究表明,在含有硫酸根离子的 V2O5/TiO2催化剂中含有+6价态的酸性硫氧化物。氮微量吸附和吡啶的红外吸附光谱结果表明,V2O5/TiO2催化剂的表面酸性与载体相关,而与 V2O5的含量无关。Brönsted酸性位和Lewis酸性位均存在于催化剂表面。甲醇氧化反应的结果表明,硫酸根修饰后,催化剂的表面酸性加强,从而促进了甲醇转化和DMM 的生成。修饰后的催化剂在同样的反应温度下,甲醇的转化率和 DMM的选择性分别提高到60%和88%。
Lu等[48]采用浸渍法制备了硫酸修饰的V2O5/TiO2催化剂,经修饰后的催化剂表面酸性显著增强,其中,w(V2O5)15%/w(S)15%催化剂兼具氧化性和酸性,表现出很高的催化活性。在150 ℃下,甲醇的转化率和 DMM的选择性分别达到了49.0%和93.0%。
Sun 等[49]在研究共沉淀法制备的4%S-V-Ti-O催化剂,催化甲醇氧化制DMM的过程中发现,温度对产物DMM的选择性有较大影响,温度升高催化剂催化活性降低。为解决这一问题,作者在催化剂制备过程中通过加入SiO2来调变V-Ti-O催化剂表面酸性和氧化还原性能。研究发现,在483 K时,Si-V-Ti-O催化剂可达到66%甲醇转化率和93%的DMM选择性,证明了SiO2的加入可以有效降低催化剂表面酸性和氧化还原能力,提高了催化剂在较高温度下的催化活性和选择性。
由于普通TiO2的比表面积较低(一般低于100 m2/g),导致催化剂分散性较差。介孔 TiO2具有较大的孔径和比表面积,使用以介孔 TiO2为载体的V2O5/TiO2催化剂,在423 K下甲醇转化率为55%,生成DMM收率达到85%[50]。Liu等[35]采用蒸发诱导-氨水后处理方法制备了具有较高比表面的介孔VOx-TiO2催化剂,其孔径为4 nm,负载量为30%的VOx可以在催化剂的表面呈高度分散,在423 K时 S/30%VOx-TiO2催化甲醇氧化的活性达到57%甲醇转化率和83% DMM选择性。
Liu等[36]报道了新型介孔 V-Ce-Ti-O催化剂对甲醇选择性氧化合成DMM反应的影响,结果表明,V-Ce-Ti-O催化剂对DMM的合成有表面酸性和氧化还原性质的双功能特性。同时,当在 V-Ce-Ti-O中加入V2O5和S后,双功能特性显著增强。在423 K时,S-V2O5/V-Ce-Ti-O 催化剂可达到72%的甲醇转化率和85%的DMM选择性。接着又使用水热法合成的介孔二氧化钛纳米管(TNT,比表面积> 300 m2/g)为载体制备钒钛催化剂,增加了催化剂的比表面积,6% S/20% V2O5/TNT对甲醇选择性氧化合成DMM表现出强的表面酸性和氧化还原性能,在403 K时,甲醇转化率达到64%,DMM选择性达到90%[44]。TNT比表面积大,可以在单层分散容量下负载更多的钒氧化物,且与活性相之间有较强的相互作用,这些都有利于提高单位质量催化剂的活性。因此,经过酸修饰的V2O5/TiO2在甲醇选择氧化合成 DMM反应中,甲醇转化率高、DMM 选择性好、反应温度低、催化剂制备简单、成本低,该催化体系对甲醇选择氧化生产DMM有潜在的工业应用价值。
Zhao等[51-52]针对钒钛硫催化剂开展了钒负载量和制备方法对催化性能影响的研究,结果表明,钒负载量高于15%(质量分数)时,催化剂表面会出现 V2O5晶体颗粒;氧化还原循环实验表明单分子钒物种易还原、难氧化。分别采用共沉淀、溶胶-凝胶、机械混合3种方法制备钒钛硫催化剂,发现催化剂表面同时存在L酸和B 酸,采用共沉淀法制备的催化剂表现出最高的反应活性,423 K时,DMM选择性为86%,甲醇转化率达到61%。在此基础上,他们研究发现,水洗会移除硫酸盐,进而会使部分B酸转变为L酸,高硫酸盐含量增加了催化剂表面B酸数目,但是减小了B 酸强度,焙烧温度和硫酸盐含量是影响 DMM生成的两个关键因素[37]。
除钒钛催化剂外,其他类型钒基催化剂也被用于甲醇一步氧化制备DMM。Zeng等[53]采用NMR技术研究了VOx/Al2O3、VOx/ZrO2和VOx/MgO3中催化剂钒物种与酸性位及其对甲醇氧化反应的影响,结果表明,在VOx/Al2O3催化剂较强的酸性位上,产物中DMM、甲醛、甲酸的选择性几乎相等,在 VOx/ZrO2催化剂较弱的酸性位上有利于甲醛生成,在碱性载体VOx/MgO上有利于甲酸盐生成。武建兵等[54]分别采用共沉淀法制备了 V2O5-TiO2、V2O5-ZrO2复合氧化物载体、等体积浸渍法制备了V2O5/TiO2-ZrO2催化剂,对催化剂在温和条件下甲醇选择氧化生成 DMM进行研究。研究发现,V2O5/TiO2-ZrO2相比于V2O5-TiO2、V2O5-ZrO2两种复合氧化物载体而言有着更高的 DMM选择性(93.3%)和甲醇转化率(51.1%)。同时研究发现,复合物中 V2O5含量影响复合氧化物催化剂的表面酸性和氧化还原性,含量在5%~10%的复合氧化物的催化活性较好。
Zhao等[55]同时研究了载体对钛基及钛硫基催化剂的影响,分别制备了V2O5-TiO2、V2O5-ZrO2、V2O5-Al2O3和V2O5-CeO2催化剂和相应的硫酸盐,研究发现,硫酸盐与载体之间的相互作用取决于载体的性质,作用强度按照 CeO2>Al2O3>ZrO2>TiO2依次减小。在加入硫酸盐后,V2O5-TiO2表现出最佳的反应活性,DMM的选择性增加。
郭荷芹[56]考察了钒铈催化剂在甲醇氧化制DMM 反应中的应用,发现钒铈酸性较弱,氧化还原能力较强,抑制了脱水产物DME的生成。钒铈催化剂影响产物分布的主要因素是氧化还原性和酸性,且较强的氧化还原能力和较多的酸性中心有助于DMM的合成。V2O5质量分数为15%时,钒氧化物单层分散,催化剂氧化还原能力最强,酸性中心最多,DMM选择性最高。助剂钛的加入增强了催化剂氧化还原能力,增加了催化剂酸性中心,提高了甲醇转化率和DMM 选择性。
Sun等[57]采用浸渍法制备了 V2O5/NbP催化剂,发现V2O5负载量低于15%时,可以很好地分散于载体上,并削弱了催化剂表面酸性强度,从而增加了弱酸位的比例。通过进一步表征发现,由于NbP占据表面酸性,同时也削弱了 V2O5的氧化还原能力。由于适宜的酸性与氧化还原性的匹配,甲醇在V2O5/NbP催化作用下,反应的主要产物为DMM。
陈爽[58]采用浸渍法制备了以钛硅分子筛(TS-1)为载体的VOx催化剂,并通过硫酸根和磷酸根对其进行酸改性。与其他载体相比较,TS-1具有高比表面积、高有序度、孔道尺寸均一、稳定性强的优点,同时存在大量的表面弱酸性中心,对甲醇氧化合成 DMM起到促进作用。磷酸根改性的VOx/TS-1-P催化剂对于甲醇氧化反应和酸性缩合反应同时的促进作用使得 VOx/TS-1-P催化剂具有良好的反应活性和选择性,获得了较高的DMM收率。此外,制备的介孔Al-P-V-O催化剂在甲醇选择氧化合成DMM的反应中表现出良好的催化活性,甲醇的转化率可达到55%,DMM的选择性也在 80%以上。研究表明,与传统负载型 V-P/ Al2O3催化剂相比,Al-P-V-O材料趋向于无定形态,具有高比表面积和较大孔体积的介孔结构特点。改变Al-P-V-O催化剂中Al/V/P的比例可以调节催化剂的酸性分布及其氧化还原能力。因此可通过调节Al/V/P的比例来控制甲醇的氧化反应,当催化剂中磷和钒的含量适宜时,催化剂具有大量的弱酸性位点,并与其较高的氧化还原能力相匹配,从而获得较高的DMM收率。
1.2.2 杂多酸催化剂
杂多酸具有较强的氧化还原性和酸性,Liu等[32]研究发现,H3+nPVnMo12-nO40能够催化甲醇氧化合成DMM,且经SiO2负载后效果更好,同时发现利用V改性后的杂多酸催化剂具有较高的DMM选择性,提出利用双功能催化剂催化甲醇直接合成DMM 的思路:催化剂上的金属中心催化甲醇氧化反应,酸性载体催化缩醛反应。在已有工作基础上,Liu等研究了不同载体(SiO2、ZrO2、TiO2、Al2O3)负载的H5PV2Mo10O40在DMM合成反应中的差异性,发现H5PV2Mo10O40负载在SiO2上的主要产物是DMM,负载在ZrO2和TiO2的主要产物是甲酸甲酯,负载在Al2O3上的主要产物是DME,从而进一步证实了适宜的酸性载体有助于DMM的生成。由于杂多酸的酸性较强,易生成较多的副产物如DME,为此Liu等[33]利用有机碱对H3+nPVnMo12-nO40(n=0~4)杂多酸催化剂进行质子化滴定优化催化剂上酸中心的密度,从而抑制DME的生产,提高DMM 的选择性。经有机碱选择性优化后的杂多酸催化剂上,DMM选择性可提高到80%,而DME的选择性可降低到 12% 以下,但是这种催化剂的总体催化活性较低。
Guo等[59]以SBA-15分子筛负载的杂多酸为催化剂,考察了催化剂制备方法、H3PMo12O40含量和催化剂焙烧温度对于催化剂结构及催化甲醇制DMM反应活性的影响。发现 H3PMo12O40/SBA-15催化剂氧化还原性较弱,酸性较强,主要副产物为DME。控制产物分布的主要因素是催化剂表面酸性,且酸性中心的减少有利于DMM的合成,质量分数为 13.2% 的 H3PMo12O40/SBA-15催化剂具有较好的催化性能。
1.2.3 贵金属催化剂
利用贵金属氧化物良好的氧化还原性质和酸性,可实现甲醇一步法制备DMM,其DMM产率和选择性均较好。
Yuan等[60]通过研究 SbRe2O6、Sb4Re2O13和SbOReO4·2H2O等催化剂上甲醇选择氧化合成DMM,发现只有 SbRe2O6对于催化甲醇一步合成DMM 有着良好的选择性,在 573 K时转化率为6.5%,选择性可达 93.5%。SbRe2O6的氧化性能可归因于与Sb-O链相连的Re氧化物的八面体结构。但是结晶氧化物 SbRe2O6的比表面积太小(1 m2/g),因而甲醇的转化率很低,不利于在催化过程中的应用。在以上工作的基础上,Yuan等[61]又将SbRe2O6负载于一系列不同的氧化物载体上,考察了载体对铼氧化物催化甲醇合成DMM的影响。在较低的温度下(513 K),获得了较高的甲醇转化率和DMM选择性,其中以Re/γ-Fe2O3催化剂的催化性能最好,甲醇的转化率显著提高,达到48%,DMM的选择性可达91%,主要副产物是甲醛和甲酸甲酯。Yuan等认为,载体的引入一方面增大了催化剂的比表面积;另一方面,通过 Re物种与载体的相互作用,使得Re更容易保持+6价,从而有利于保持催化剂的氧化还原性能。此外,Re氧化物适宜的Lewis酸性也是必要的。
曹虎等[62-63]通过调变操作条件探索了负载型铼催化剂在催化甲醇合成DMM中的反应规律,考察了催化剂表面铼物种以及酸性性质,认为ReOx/SiC与ReOx/ZrO2催化剂表面酸碱性的不同决定了产物选择性之间的差异。负载型ReOx/ZrO2催化剂可在495 K下达到43.4%的转化率和81.9%的DMM选择性。李欢等[64]利用CuO负载Re,并添加Mn作为助剂得到催化剂,考察了其催化甲醇一步合成DMM 的反应性能。结果表明,在一定的温度范围内,较高的反应温度有利于提高甲醇的转化率和DMM选择性;加入少量Mn(2%)之后的Re、Cu氧化物催化剂有较好的反应特性,可达到高转化率和较高的DMM选择性。在非临氧条件下,催化剂表面的晶格氧可以参与反应,将甲醇氧化并最终得到DMM。Mn可以作为结构调变助剂改善催化剂表面Cu的分散度,同时能调变氧化还原能力以及酸碱性,适度的氧化还原能力和较多的弱酸性中心能够提高DMM的选择性。
Liu等[65]研究发现,在较低的反应温度下,以RuO2作为催化剂催化甲醇一步合成 DMM具有较高的反应活性。在 300~400 K,RuO2/SiO2、RuO2/Al2O3和RuO2/ZrO2催化剂上,DMM的选择性在56%以上。他们详细对比了以Al2O3和TiO2为载体的催化剂的反应性能,认为两种催化剂上DMM 选择性的高低是由于载体酸性强弱导致,因此构建双功能催化剂时应适宜选择酸性载体。
Sécordel等[66]采用热扩散的方法制备了TiO2和SiO2负载的铼催化剂,与常规的湿法制备技术相比,这一方法可以有效减少铼酸盐组分的挥发。利用此方法制得的Re/TiO2催化剂可获得较高的DMM选择性。
Nikonova等[67]以醇盐分子作为前体制备了一种新型的铼钽氧化物,并将其成功负载于介孔TiO2上。研究发现,Re主要通过氧桥以高铼酸盐的形式与载体表面相连。甲醇选择氧化反应结果表明,反应选择性与催化剂前体分子的性质关系密切,ReOx/TiO2主要得到甲醛,ReO3/TaO5/TiO2主要得到DMM,选择性达 90%。作者认为,在甲醇一步法制备DMM的反应中,双金属催化剂表现出的良好催化性能源于氧化性(高铼酸盐)和酸性(氧化钽)组分之间的协同作用。
尽管负载型贵金属催化剂在甲醇选择氧化合成DMM 的反应中表现良好,但由于贵金属的价格昂贵,制约了这类催化剂的应用。另外,Re的高价氧化物在高温下易挥发,在实际使用中可能存在困难,这些也限制了Re催化剂体系的应用。
1.2.4 其他类型催化剂
法国ARKEMA公司的Dubois等[68]在专利中报道了一种含有Mo和V的复杂的无定形复合氧化物催化剂,可用于低碳醇部分氧化反应,尤其适合于甲醇的选择氧化。在随后发表的论文中,他们[69]以Mo12V3W1.2Cu1.2Sb0.5Ox表示这种无定形复合氧化物,该复合氧化物以简单的共沉淀法制备,比表面积低于10 m2/g,具有较好的甲醇氧化性能和DMM选择性。研究发现,活化条件对该催化剂的性能影响很大,在纯氧气氛中处理的催化剂具有很高的甲醇氧化活性,533 K时甲醇转化率达64%,DMM选择性为89%。而未经活化的催化剂上不但甲醇转化率低(35%),DMM选择性也很低(2%)。据称,ARKEMA公司已进行了该催化剂的工业规模制备,推测他们正计划或已经在用该催化剂进行甲醇选择氧化制取DMM的中试研究。
近期 Gornay等[70]报道了采用 FeMo催化剂[MoO3-Fe2(MoO4)3]直接氧化甲醇制DMM,可以得到非常高的产率[4.6 kgDMM/(h·kgcat),553 K],这是至今文献报道的最好结果。此催化剂在工业上一般是应用于甲醇的选择性氧化制甲醛,通过改变反应条件,如增加反应进料中甲醇的比例,可以在很大程度上调变催化剂表面酸性,从而达到改变催化剂选择性的目的,得到较高的DMM收率。
1.3 二甲醚氧化法制备甲缩醛
Liu等[32]首次采用 SiO2负载或未负载的具有Keggin结构的H3+nVnMo12-nPO40催化剂在453~513 K下研究了一步氧化甲醇或者DME得到DMM的反应。该催化剂具有合成DMM所需的氧化还原位和B酸位的双功能活性位,氧化还原位可以催化氧化DME转化为HCHO,而酸性位则催化HCHO和CH3OH生成DMM。以SiO2为载体的催化剂因其较高的表面单层分布,有效提高了DMM的生成速率和选择性,降低COx收率,得到甲缩醛的选择性为56.8%,但是二甲醚的转化率仅为1.8%。反应原料气中加入部分水,因其可以促进 DME水解得到CH3OH,而CH3OH 是生成DMM必须的中间产物之一,故而可以提高DMM的生成速率。此外,作者还详细研究了保留时间、反应物浓度以及反应温度对催化反应的影响。
张清德等[71-73]采用浸渍法制备了 H4SiW12O40/ SiO2杂多酸催化剂,并分别用MnCl2、SnCl4和CuCl2进行修饰。在常压连续流动固定床反应器中考察了催化剂对DME选择氧化制备DMM的催化活性。作者进一步研究了不同载体和杂多酸的影响,发现5% MnCl2修饰的H4SiW12O40/SiO2催化剂的催化活性最好,在593 K时,DME的转化率为8.6 %,DMM选择性为39.1 %。MnCl2的修饰明显降低了催化剂的酸强度和酸中心数目,有利于DME分解为甲氧基,避免了DME的深度氧化,减少了COx的生成,另外,MnCl2的加入也提高了催化剂的氧化活性。硫酸锰、乙酸锰、氯化锰和硝酸锰不同前体的锰盐修饰的催化剂活性顺序为:MnCl2H4SiW12O40/SiO2>Mn(NO3)2H4SiW12O40/SiO2>MnSO4H4SiW12O40/SiO2>Mn(AC)2H4SiW12O40/SiO2。该作者认为,MnCl2的修饰效果好的原因在于,硅钨酸经改性后形成二氧化锰形式的氧化物,该氧化物的存在有利于 DME选择氧化生成DMM,推测DME氧化制备DMM的机理如图1。
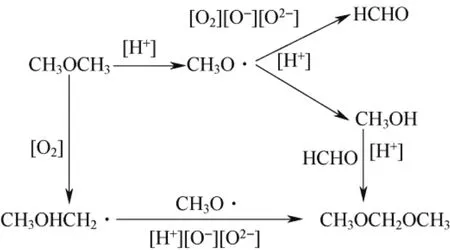
图1 DME生成DMM的反应路线
以二甲醚为原料,一步法制备DMM的工艺路线反应原料易得,但是要解决甲醇产能过剩的问题,还要再多加以甲醇为原料合成二甲醚的工艺,因此增加了设备投资。此外,Liu和张清德的研究都表明该路线二甲醚的转化率和 DMM的选择性都较低,还需要在催化材料和工艺等方面加大研究力度,才有可能获得重要突破。
1.4 二溴甲烷合成甲缩醛
二溴甲烷是甲烷转化为大宗化学化工产品的中间体,单永奎等[74]以二溴甲烷、氢氧化钾、无水甲醇为原料,建立了一种合成DMM的新方法。在常压和强烈的搅拌下,将氢氧化钾溶解于无水甲醇中,加入二溴甲烷,在40~65 ℃温度下搅拌2~10 h,经过蒸馏后即可得到 DMM。此方法成本低、环境友好、反应所得DMM稳定性高、重复性好,较好地实现了甲烷下游产品的高附加值转化,适用于工业化生产,为合成DMM方法的研究开拓了新思路。
2 甲缩醛合成反应的动力学研究进展
2.1 国内甲缩醛合成反应动力学研究进展
乔旭等[75]以粒径1~3 μm的粉末状硅酸铝为催化剂,在间歇反应釜中催化甲醇与甲醛合成DMM,考察了不同的甲醛初始浓度、不同甲醇甲醛摩尔比、不同催化剂用量下泡点温度与时间的关系。在此催化条件下,DMM合成反应速度较快,用传统的动力学研究方法研究该反应的动力学较难实现。而本文动力学研究是根据催化精馏过程中反应体系处于沸腾状态的特点和简单快速反应的特性,认为体系的泡点温度与反应转化率存在一一对应关系。乔旭等发现,在DMM合成反应中,随着反应的进行,反应混合物泡点温度不断下降,从而提出了反应动力学数据快速测定法——测温法。该方法首先绘制出标准曲线,确定泡点温度与反应时间的关系,然后测定反应体系在各个时间点的温度变化,从而得到DMM合成反应的动力学数据。得到的速率模型如式(5)。
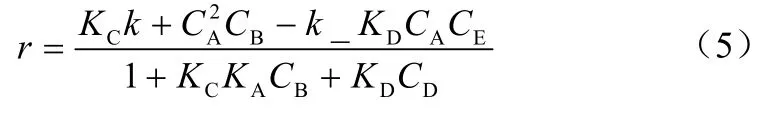
式中,KC=KKc';CA、CB、CD分别为甲醇、甲醛、DMM的浓度,mol/L。
实验数据与模型计算相吻合,DMM生成速率与甲醇和甲醛浓度分别为1.75级和1.12级。这种测温法与传统动力学数据测定方法(测浓法)相比,具有简单、精度高的优点,适用于DMM合成反应精馏塔的设计,是一种测定简单快速反应动力学规律的有效手段。
乔旭等[76]又以国产D001型离子交换树脂作为DMM合成反应的催化剂,在与文献[75]相同的实验装置上,采用测温法研究了DMM合成反应本征动力学。该作者测得5种初始组成和3种离子交换树脂催化剂含量条件下的 DMM合成反应温度-反应时间关系,并直接根据反应温度-反应时间关系估计动力学参数,所得本征动力学模型为式(6)。

式中,CM、CF、CD、CW分别为甲醇、甲醛、DMM、水的浓度,mol/L。
所得的经验模型具有简单、直观、参数个数少的优点,可为DMM合成反应宏观动力学研究以及催化精馏塔的设计放大提供一定的依据。
秦学洵等[77]在玻璃釜中以酸性阳离子交换树脂为催化剂,对甲醛、甲醇合成DMM的反应动力学进行了研究。作者假定DMM的生成机理与乙缩醛的生成机理相同,将DMM的合成反应看成是液相中的拟均相反应,确定了动力学方程的表达式如式(7)。
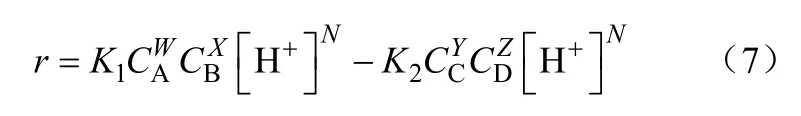
该作者在排除了内外扩散影响的条件下,测定了不同反应温度、不同催化剂浓度下甲醛浓度随时间的变化关系,并对实验数据进行回归,通过比较发现回归结果与实验值的相对误差均< 1%。根据实验数据,用最小二乘法回归动力学方程式中的W、X、Y、Z、N、K1和K2,得到甲醛消失的反应速率方程为式(8)。
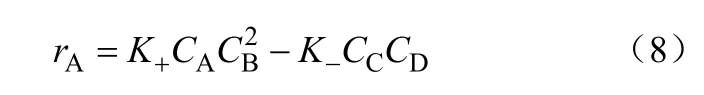
之后,根据甲醛与DMM的化学计量关系,求得生成DMM的速率,并通过实验数据与模型拟合,得到DMM生成速率方程如式(9)。
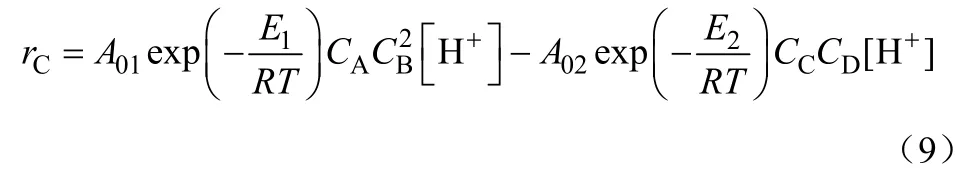
式中,CA、CB、CC、CD分别为甲醛、甲醇、DMM、水的浓度,mol/L;正逆反应的频率因子A0和活化能E分别为:A01=1.7285×104,E1=6862 J/mol;A02=4.975×108,E2=9169 J/mol。这项研究工作为建立DMM合成中试装置提供了参考数据。
乔旭等[78]通过改进实验装置,对H-型大孔强酸性苯乙烯系阳离子交换树脂催化下,甲醇和甲醛合成DMM的宏观动力学进行了测定。改进的装置实现了物料的连续进出,从而避免了间歇测定过程中反应-扩散方程的求解困难问题。在原料组成一定(CM0= 9.529 mol/ L,β = 2.0)的条件下,分别测定反应器内温度随空时的变化,采用甲醛-甲醇-DMM-水四元体系的 UNIQUAC相平衡方程[79]转换得到反应器出口转化率与空时的关系。该作者引入催化剂有效因子的等效温度法,最终求得有效因子并求出宏观反应速率,得到一定原料组成和空时下反应器出口组成的计算值。在有效扩散系数计算中,将有效扩散系数与温度和相应组分分子量的开方关系直接代入到模型中,不仅使参数估计过程大大简化,还保证参数具有明确的物理意义和一定的精度。但由于反应速率是通过计算反应器进出口浓度差得到的,从而使得宏观反应速率的计算值与实验值偏差较大。
李柏春等[80]以强酸型阳离子交换树脂为催化剂,甲醇和稀甲醛为原料在间歇反应釜中合成DMM,研究催化精馏过程的宏观动力学。Jayadeokar等[81]发现,除扩散控制外,树脂催化过程动力学一般与均相催化反应具有相同的反应机理[77]。因而李柏春等采用拟均相模型对实验数据进行拟合,考察了313 K、318 K、323 K、328 K这4个温度下的正逆反应速率。实验结果表明,采用拟均相模型对实验线性拟合,线性关系显著,验证了假设的反应机理,并回归得到了在313~328 K 下的指前因子k0、活化能Ea及宏观动力学方程,见式(10)。
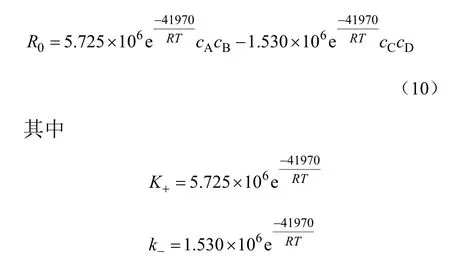
从式(10)中可以看出,在313~328 K下,以强酸型阳离子交换树脂为催化剂,甲醇与稀甲醛合成DMM的反应表现级数为二级。此动力学方程较好地描述了间歇精馏操作中DMM合成反应的宏观动力学。
2.2 国外甲缩醛合成反应动力学研究进展
Masamoto等[82]在非连续管式固定床反应器中进行了DMM合成的动力学实验,考察了停留时间、甲醛和甲醇的初始浓度及反应温度对于DMM反应速率的影响。根据反应机理和对实验结果的分析,确定DMM生成速率与甲醛和甲醇的浓度关系均为一级。在对实验结果的分析中,没有排除内外扩散对反应的影响,数据计算中各物质的浓度也不是溶液中物质的真实浓度。另外,该作者也没有对实验模型和实验数据进行拟合,因此最终模型不具有可靠性,不能作为催化精馏塔模拟放大的模型参考。
Kolah等[83]采用连续反应精馏的工艺完成了DMM 合成反应中实验结果与模型的拟合。该作者在真实组分浓度的基础上建立了基于活度的实验模型,并进行了专门的动力学实验,反应结果以图表形式展现。但只考虑了甲醛溶液中第一个半缩醛的生成,没有进行反应精馏实验与模型之间的比较,因此无法证明该作者的模型及实验数据的正确性。
Danov等[84]以杂多酸H4SiW12O40为催化剂,对以甲醇和甲醛为原料合成DMM的反应动力学关系进行了研究。该作者求得真实速率常数k与有效速率常数k’以及催化剂浓度c关系如式(11)。
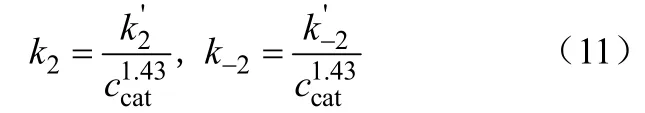
该作者利用 Arrhenius方程得到速率常数与温度之间的关系如下:

通过速率常数与水初始浓度的关系得到如下表达式:

这些结果表明,正逆反应速率常数不但与反应混合物的组成密切相关,还与水的初始浓度有关。
Drunsel等[85]以酸性离子交换树脂为催化剂,在管式固定床反应器中进行了催化甲醇、多聚甲醛合成DMM的实验和相关动力学模型研究。该作者分别考察了液体流速、不同温度、不同催化剂量、不同甲醇甲醛比对于DMM生成速率的影响。反应温度控制在323~343 K较低的区间,可减少副产物的生成。为方便检测反应全程物料的变化,在装置九段反应管均有取样分析口,且在取样口外有冷却装置,避免了DMM的气化,保证取样结果的准确性。各段反应管内组分i的摩尔分数的变化表达式为式(12)。

其中,平衡常数和活度因子UNIFAC模型均参考文献[86-87]。在DMM速率方程式求算中,DMM的生成步骤为决速步骤。实验模型能很好地解释所得实验数据,其数据与热力学计算相吻合,可同时描述反应精馏和相平衡过程,为工业化放大生产提供了依据。
综上所述,DMM合成反应动力学研究经历了从初期实验数据与模型的单独考虑,到后来的数模拟合,从而得到更加准确的DMM合成反应动力学方程。在实验装置的选择上,从初期的单一间歇反应釜,到后来的管式连续反应釜,逐步接近于工业化模拟生产,得到的动力学方程对于DMM工业化生产的设计具有更好的参考性。
3 结 语
DMM 用途广泛,市场潜力巨大,作为甲醇的重要下游产品之一,其合成与应用研究将会对我国煤化工、能源化工和碳一化工的发展起到积极的促进作用。目前,相对成熟的DMM合成工艺是以甲醇和甲醛为原料的生产技术。这一技术路线利用了甲醇与甲醛在酸性条件下发生羟醛缩合反应的原理,由于是一个平衡反应,反应的收率会因副产物的水而受到限制,因此副产水的处理是工业上较严峻的问题。为获得高纯的 DMM,简化副产物水的处理流程,在催化剂种类、反应原料和工艺设计等方面仍然存在很大的改进空间。甲醇一步氧化法生产DMM具有工艺流程短、生产成本低的特点,该过程催化剂体系的研究已经引起国内外的关注。目前的报道显示,酸修饰的钒钛催化剂和无定形氧化物催化剂具有可工业化开发的价值。但是如何实现在较为温和的条件下,同时满足催化剂的高稳定性、DMM的高产率和高选择性是一步法制备DMM的瓶颈问题,由此可见对甲醇选择氧化反应的认识仍需要进行大量的研究工作。
伴随着对DMM合成反应动力学研究的不断深入,人们对于DMM的合成过程与机理将会有更加全面与深刻的认识,从而为解决DMM工业化生产工艺设计中的一些问题提供一定的参考依据。
[1] 杨丰科,李金芝,曹伟丽. 甲缩醛的研究进展[J]. 应用化工,2011,40(10):1833-1836.
[2] 颜康. DMM——一个值得重视的甲醇下游产品[J]. 化工时刊,2010,24(10):59-60.
[3] Łojewska J,Wasilewski J,Terelak K,et al. Selective oxidation of methylal as a new catalytic route to concentrated formaldehyde:Reaction kinetic profile in gradientless flow reactor[J]. Catalysis Communications,2008,9(9):1833-1837.
[4] 张光德,夏新祥,乔信起,等. 甲缩醛燃料添加剂对柴油机性能的影响[J]. 内燃机工程,2005,26(2):37-39.
[5] Vertin K D,Ohi J M,Naegeli D W,et al. Methylal and methylal-diesel blended fuels from use in compression-ignition engines[R]. National Renewable Energy Lab.,Golden,CO (US),1999.
[6] Liu H,Gao H,Ma Y,et al. Synthesis of high-purity methylal via extractive catalytic distillation[J]. Chemical Engineering & Technology,2012,35(5):841-846.
[7] 雷艳华,孙清,陈兆旭,等. 合成聚甲醛二甲基醚反应热力学的理论计算[J]. 化学学报,2009,67(8):767-772.
[8] 李峰. 甲醛及其衍生物[M]. 北京:化学工业出版社,2006:266-279.
[9] 许春梅,张明森. 甲醇与多聚甲醛反应制备甲缩醛[J]. 石油化工,2008,37(9):896-899.
[10] 史高峰,陈英赞,罗凯,等. 高纯度甲缩醛的制备方法[J]. 精细化工,2012,29(2):178-181.
[11] Doherty M F,Buzad G. Reactive distillation by design[J]. Chemical Engineering Research & Design,1992,70(A5):448-458.
[12] DeGarmo J L,Parulekar V N,Pinjala V. Consider reactive distillation[J]. Chemical Engineering Progress,1992,88(3):43-50.
[13] 褚效中. 催化精馏法制备甲缩醛[J]. 淮阴师范学院学报:自然科学版,2009,1:17.
[14] 王志宏. 连续催化合成 DMM 工艺研究[J]. 精细化工中间体,2012,42(2):38-40.
[15] Zhang X M,Zhang S F,Jian C H. Synthesis of methylal by catalytic distillation[J]. Chemical Engineering Research and Design,2010,584:8-15.
[16] Kolah A K,Mahajani S M,Sharma M M. Acetalization of formaldehyde with methanol in batch and continuous reactive distillation columns[J]. Industrial & Engineering Chemistry Research,1996,35(10):3707-3720.
[17] Satoh S,Tanigawa Y. Process for producing methylal:US,6379507[P]. 2002-04-30.
[18] 赵鸣玉. DMM和缩醛法[J]. 中国化工,1998(7):42-44.
[19] 王志亮,贾菲,孟祥发,等. TiCl4改性离子交换树脂催化合成DMM[J]. 山东化工,2011,40(11):7-8.
[20] 吾满江·艾力,刘洪忠,高志贤. 一种DMM的制备方法:中国,102351665[P]. 2012-02-15.
[21] 秦建华,乔旭,曾崇余. 流化催化精馏过程汽液传质系数的测定[J].南京化工大学学报,1996,18(4),14-19.
[22] 曹海波,乔旭,曾崇余. 流化催化精馏合成DMM技术[J]. 南京化工大学学报,1998,20(3):19-22.
[23] 秦建华. 单板塔反应精馏合成DMM的研究[J]. 化学工程与装备,2011,4:27-29.
[24] 王淑娟,陶克毅. 不同类型分子筛对DMM的催化性能[J]. 吉林大学学报:理学版,2002,40(3):320-323.
[25] 王淑娟. HZSM-5催化甲缩醛反应的研究[J]. 辽宁大学学报:自然科学版,2003(2):20.
[26] 金明善,翁永根,董和泉,等. 改性杂多酸催化剂的制备及其在DMM 合成中的催化活性[J]. 复旦学报:自然科学版,2003,42(3):280-284.
[27] 曾崇余,乔旭. DMM合成用催化剂的筛选与工艺条件[J]. 南京化工学院学报,1993,15(7):8-12.
[28] 耿丽,余加祐,王少君,等. 功能性酸性离子液体[Hmim]+HSO4-催化甲缩醛反应的研究[J]. 大连工业大学学报,2009,28(1):30-32.
[29] 杨洁,赵地顺,申晓冰,等. 固载化离子液体催化合成 DMM 反应的研究[C]//中国化学会第27届学术年会第01分会场摘要集,2010.
[30] Yuan Y Z,Iwasawa Y. Performance and characterization of supported rheniumoxide catalysts for selective oxidation of methanol to methylal[J]. Journal of Physical Chemistry B,2002,106(17):4441-4449.
[31] Iwasawa Y,Yuan Y,Shido T,et al. Process for preparing partial oxidates of lower alcohols:US,6403841[P]. 2002-06-11.
[32] Liu H,Iglesia E. Selective one-step synthesis of dimethoxymethane via methanol or dimethyl ether oxidation on H3+nVnMo12-nPO40keggin structures[J]. Journal of Physical Chemistry B,2003,107(39):10840-10847.
[33] Liu H,Bayat N,Iglesia E. Site titration with organic bases during catalysis:Selectivity modifier and structural probe in methanol oxidation on Keggin clusters[J]. Angewandte Chemie International Edition,2003,42(41):5072-5075.
[34] Royer S,Sécordel X,Brandhorst M,et al. Amorphous oxide as a novel efficient catalyst for direct selective oxidation of methanol to dimethoxymethane[J]. Chemical Communications,2008(7):865-867.
[35] Liu J W,Sun Q,Fu Y C,et al. Preparation and characterization of mesoporousVOx-TiO2complex oxides for the selective oxidation of methanol todimethoxymethane[J]. Journal of Colloid and Interface Science,2009,335(2):216-221.
[36] Liu J W,Sun Q,Fu Y C,et al. Preparation of mesoporous V-Ce-Ti-O for theselective oxidation of methanol to dimethoxymethane[J]. Catalysis Letters,2008,126(1-2):155-163.
[37] Zhao H Y,Bennici S,Shen J Y,et al. Nature of surface sites of V2O5-TiO2/Scatalysts and reactivity in selective oxidation of methanol to dimethoxymethane[J]. Journal of Catalysis,2010,272:176-189.
[38] Guo H Q,Li D B,Jiang D,et al. Characterization and performance of sulfated VOx-TiO2catalysts in the one-step oxidation of methanol to dimethoxymethane[J]. Catalysis Communications,2010,11(5),396-400.
[39] Tronconi E,Elmi A S,Ferlazzo N,et al. Methyl formate from methanol oxidation over coprecipitated V-Ti-O catalysts[J]. Industrial and Engineering Chemistry Research,1987,26(7):1269-1275.
[40] Forzatti P,Tronconi E,Tittarelli P. Oxidation of methanol to methyl formate over V-Ti oxide catalysts[J]. Catalysis Today,1987,1(1):209-218.
[41] Elmi A S,Tronconi E,Cristiani C,et al. Mechanism and active sites for methanol oxidation to methyl formate over coprecipitated vanadium-titanium oxide catalysts[J]. Industrial and Engineering Chemistry Research,1989,28(4):387-393.
[42] Briand L E,Bonetto R D,Sanchez M A,et al. Structural modelling of coprecipitated VTiO catalysts[J]. Catalysis Today,1996,32(1-4):205-213.
[43] Fu Y,Shen J. Selective oxidation of methanol to dimethoxymethane under mild conditions over V2O5/TiO2with enhanced surface acidity[J]. Chemical Communications,2007(21):2172-2174.
[44] Liu Y,Fu Q,Sun J,et al. TiO2nanotubes supported V2O5for the selectiveoxidation of methanol to dimethoxymethane[J]. Micropor. Mesopor. Mater,2008,116(1-3):614-621.
[45] Guo H Q,Li D B,Jiang D,et al. Characterization and performance of V2O5-TiO2catalysts prepared by rapid combustion method[J]. Catalysis Today,2010,158(3):439-445.
[46] Guo H Q,Li D B,Jiang D,et al. The one-step oxidation of methanol to dimethoxymethane over nanostructure vanadium-based catalysts[J]. Catalysis Letters,2010,135(1-2),48-56.
[47] 郭荷芹,李德宝,姜东,等. 纳米钒钛硫催化剂催化甲醇氧化一步合成二甲氧基甲烷[J]. 天然气化工:C1化学与化工,2010,35(2):1-5.
[48] Lu X,Qin Z,Dong M,et al. Selective oxidation of methanol to dimethoxymethane over acid-modified V2O5/TiO5catalysts[J]. Fuel,2011,90(4):1335-1339.
[49] Sun Q,Liu J W,Cai J X,et al. Effect of silica on the selective oxidation of methanol to dimethoxymethane over vanadiatitania catalysts[J]. Catalysis Communications,2009,11(1):47-50.
[50] Zhan E S,Li Y,Liu J L,et al. A VOx/meso-TiO2catalyst for methanol oxidation to dimethoxymethane[J]. Catalysis Communications,2009,10:2051- 2055.
[51] Zhao H,Bennici S,Cai J,et al. Effect of vanadia loading on the acidic-redox and catalytic properties of V2O5-TiO2and V2O5-TiO2/Scatalysts for partial oxidation of methanol[J]. Catalysis Today,2010,152(1-4):70-77.
[52] Zhao H,Bennici S,Shen J,et al. Surface and catalytic properties of V2O5-TiO2/Scatalysts for the oxidation of methanol prepared by various methods[J]. Journal of Molecular Catalysis A:Chemical,2009,309(1-2):28-34.
[53] Zeng D,Fang H,Zheng A,et al. Selective oxidation of methanol over supported vanadium oxide catalysts as studied by solid-state NMR spectroscopy[J]. Journal of Molecular Catalysis A:Chemical,2007,270(1):257-263.
[54] 武建兵,王辉,秦张峰,等. V2O5/TiO2-ZrO2催化剂上甲醇选择氧化制甲缩醛[J]. 燃料化学学报,2011,39(1):64-68.
[55] Zhao H,Bennici S,Cai J,et al. Influence of the metal oxide support on the surface and catalytic properties of sulfated vanadia catalysts for selective oxidation of methanol[J]. Journal of Catalysis,2010,274(2):259-272.
[56] 郭荷芹. 甲醇氧化一步法合成二甲氧基甲烷催化体系研究[D]. 太原:中国科学院山西煤炭化学研究所,2010.
[57] Sun Q,Fang D M,Wang S M,et al. Structural,acidic and redox properties of V2O5/NbP catalysts[J]. Applied Catalysis A:General,2007,327(2):218-225.
[58] 陈爽. 钒系催化剂催化甲醇选择性氧化合成二甲氧基甲烷[D]. 天津:天津大学,2012.
[59] Guo H Q,Li D B,Xiao H C,et al. Methanol selective oxidation to dimethoxymethane on H3PMo12O40/SBA-15 supported catalysts[J]. Kor. J.Chem. Eng.,2009,26(3):902-906.
[60] Yuan Y,Liu H,Imoto H,et al. Performance and characterization of a new crystalline SbRe2O6catalyst for selective oxidation of methanol to methylal[J]. Journal of Catalysis,2000,195(1):51-61.
[61] Yuan Y Z,Shido T,Iwasawa Y. Performance and characterization of supported rhenium oxide catalysts for selective oxidation of methanol to methylal[J]. Journal of Physical Chemistry B,2002,106:4441-4449.
[62] 曹虎. 负载型铼催化剂上一步合成DMM的研究[D]. 太原:中国科学院山西煤炭化学研究所,2006.
[63] 曹虎,郑岩,李军平,等. ReOx/ZrO2催化甲醇一步合成二甲氧基甲烷的研究[J]. 燃料化学学报,2007,35(3):334-338.
[64] 李欢,李军平,肖福魁,等. Mn/Re/Cu体系催化剂催化甲醇一步合成二甲氧基甲烷的研究[J]. 燃料化学学报,2009,37(5):613-617.
[65] Liu H C,Iglesia E. Selective oxidation of methanol and ethanol on supported ruthenium oxide clusters at low temperatures[J]. Journal of Physical Chemistry B,2002,109(6):2155-2163.
[66] Sécordel X,Yoboué A,Berrier E,et al. Supported oxorhenate catalysts prepared by thermal spreading of metal Re0for methanol conversion to methylal[J]. Journal of Solid State Chemistry,2010.DOI:10.1016/j.jssc.2010.08.003.
[67] Nikonova O A,Capron M,Fang G,et al. Novel approach to rhenium oxide catalysts for selective oxidation of methanol to DMM[J]. Journal of Catalysis,2011,279(2):310-318.
[68] Dubois J L,Brandhorst M,Capron M,et al. Process for preparing partial oxidation products of lower alcohols by direct oxidation of a lower alcohol and catalysts for use in that process:US,7759525[P]. 2010-07-20.
[69] Royer S,Sécordel X,Brandhorst M,et al. Amorphous oxide as a novel efficient catalyst for direct selective oxidation of methanol to dimethoxymethane[J]. Chemical Communications,2008(7):865-867.
[70] Gornay J,Sécordel X,Tesquet G,et al. Direct conversion of methanol into1,1-dimethoxymethane:Remarkably high productivity over an FeMo catalystplaced under unusual conditions[J]. Green Chemistry,2010,12(10):1722-1725.
[71] 张清德,谭猗生,杨彩虹,等. MnCl2-H4SiW12O40/SiO2催化氧化DME制取甲缩醛[J]. 催化学报,2006,27(10):916-920.
[72] 张清德,谭猗生,杨彩虹,等. 不同前驱体制备的Mn-H4SiW12O40/ SiO2催化剂对二甲醚催化氧化制取甲缩醛反应性能的影响[J]. 燃料化学学报,2007,35(2):207-210.
[73] Zhang Q D,Tan Y S,Yang C,et al. Research on catalytic oxidation of dimethyl ether to dimethoxymethane over MnCl2modified heteropoly acid catalysts[J]. Catalysis Communications,2008,9(9):1916-1919.
[74] 单永奎,孔爱国,王平. 一种合成甲缩醛的方法:中国,CN101550068A[P]. 2009-10-07.
[75] 乔旭,曾崇余. 测温法研究甲缩醛合成反应动力学[J]. 南京化工学院学报,1993(A07):1-7.
[76] 乔旭,曾崇余. 在离子交换树脂作用下甲缩醛合成反应本征动力学[J]. 高校化学工程学报,1998,12(2):157-161.
[77] 秦学洵,潘晓红. 甲缩醛合成的本征动力学研究[J]. 华东理工大学学报:自然科学版,1995,21(1):23-29.
[78] 乔旭,崔咪芬,曾崇余,等. 连续测温法研究催化精馏过程宏观动力学[J]. 南京化工大学学报,2000,22(2):1-5.
[79] Shan Z,Wang Y,Qiu S,et al. Vapor liquid equilibria for the quaternary system of formaldehyde (1)-methanol (2)-methylal (3)-water (4)[J]. Fluid Phase Equilibria,1995,111(1):113-126.
[80] 李柏春,巢飞,徐敬瑞. 甲缩醛催化精馏过程宏观动力学研究[J].化学工程,2012,40(6):64-67.
[81] Jayadeokar S S,Sharma M M. Ion exchange resin catalysed etherification of ethylene and propylene glycols with isobutylene[J]. Reactive Polymers,1993,20(1):57-67.
[82] Masamoto J,Matsuzaki K. Development of methylal synthesis by reactive distillation[J]. Journal of Chemical Engineering of Japan,1994,27(1):1-5.
[83] Kolah A K,Mahajani S M,Sharma M M. Acetalization of formaldehyde with methanol in batch and continuous reactive distillation columns[J]. Industrial & Engineering Chemistry Research,1996,35(10):3707-3720.
[84] Danov S M,Kolesnikov V A,Logutov I V. Kinetic relationships in synthesis of dimethoxymethane[J]. Russian Journal of Applied Chemistry,2004,77(12):1994-1996.
[85] Drunsel J O,Renner M,Hasse H. Experimental study and model of reaction kinetics of heterogeneously catalyzed methylal synthesis[J]. Chemical Engineering Research and Design,2012,90(5):696-703.
[86] Kuhnert D I C. Dampf-Flüssigkeits-Gleichgewichte in mehrkomponentigen form aldehydhaltigen systemen[D]. PhD Dissertation,Technische Universität Kaiserslautern,Shaker:Aachen,Germany,2004.
[87] Kuhnert C,Albert M,Breyer S,et al. Phase equilibrium in formaldehyde containing multicomponent mixtures:Experimental results for fluid phase equilibria of [formaldehyde + (water or methanol) + methylal)] and (formaldehyde + water + methanol + methylal) and comparison with predictions[J]. Industrial & Engineering Chemistry Research,2006,45(14):5155-5164.
Advances in synthesis methods and kinetics of methylal
WEI Huanmei1,2,LI Zhen1
(1State Key Laboratory for Oxo Synthesis and Selective Oxidation,Lanzhou Institute of Chemical Physics,Chinese Academy of Sciences,Lanzhou 730000,Gansu,China;2University of Chinese Academy of Sciences,Beijing 100039,China)
Aiming at the synthesis methods of methylal,this paper reviews advances of acetalization,direct oxidation of methanol,and oxidation of dimethy ether,with respect to the types of catalysts. The existing problems are commented,such as low feed conversion,low product purity,etc. Development of synthesis methods should aim at simplification of process,environmentally friendly catalysts,improving conversion and product purity. On the other hand,the research progress of the kinetics of synthesizing methylal is summarized. The kinetics research is getting closer to the actual situation of industrial production from establishing models to choice of device,which is more valuable for industrial production.
methylal;catalyst;synthesis;aldol condensation;kinetics
TQ 22
A
1000-6613(2014)02-0272-13
10.3969/j.issn.1000-6613.2014.02.002
2013-05-24;修改稿日期:2013-06-20。
国家973计划项目(2011CB201404)。
魏焕梅(1987—),女,硕士研究生。E-mail weihuanmei @126.com。联系人:李臻,博士,研究员。E-mail zhenli@licp.cas.cn。
