草莓斑驳病毒的分子杂交检测
2014-07-02李丽丽杨洪一
李丽丽,杨洪一
(1.黑龙江省林业科学研究所,黑龙江 哈尔滨 150081;2.东北林业大学生命科学学院,黑龙江 哈尔滨150040)
草莓斑驳病毒的分子杂交检测
李丽丽1,杨洪一2*
(1.黑龙江省林业科学研究所,黑龙江 哈尔滨 150081;2.东北林业大学生命科学学院,黑龙江 哈尔滨150040)
为探索分子杂交技术在草莓斑驳病毒(Strawberry mottle virus, SMoV)检测中的运用,利用CTAB法从草莓叶片中提取总核酸,并以此为模板,利用特异引物扩增SMoV非编码区序列,经克隆、测序获得SMoV非编码区序列。系统进化分析结果显示:本研究中的分离物与GenBank中已报道的分离物的亲缘关系较远,独立形成1个小的进化支。以带有病毒特异片段的质粒为模板,运用PCR技术制备了地高辛标记的cDNA探针。以草莓感染SMoV叶片为试材,利用地高辛标记探针可有效检测草莓叶片中的SMoV,草莓总核酸样品稀释10倍后仍可有效检测。
草莓斑驳病毒;分子杂交技术;cDNA探针
草莓斑驳病毒(Strawberry mottle virus, SMoV)是一种严重危害草莓生产的潜隐病毒,是分布最广泛的草莓病毒之一[1]。SMoV病毒粒子为球形,直径28~30 nm[2]。SMoV基因组包含2条单链RNA分子,3′末端均带有Poly(A)尾,每个RNA分子编码1个多聚蛋白[3-4]。草莓病毒的早期检测方法主要为指示植物法。该方法检测周期长,灵敏度较低[1]。草莓病毒在草莓植株中的分布量较少,且分布不均,常规的血清学技术难以应用于草莓病毒检测[5]。基于基因组学的发展,国内外研究人员已获得了SMoV、草莓皱缩病毒(Strawberry crinkle virus, SCrV)、草莓镶脉病毒(Strawberry vein banding virus, SVBV)和草莓轻型黄边病毒(Strawberry mild yellow edge virus, SMYEV)的基因组序列[5],并以此为基础,基于PCR技术对草莓病毒检测进行了探索[6–7]。由于高质量草莓核酸的提取较困难,导致运用PCR技术检测草莓病毒的结果不稳定[6–7]。利用RT–PCR技术检测SMoV时,不同核酸提取方法检测结果的差异较大[6]。分子杂交技术是将少量变性的核酸固定在固体支持膜上,用专一性检测互补核酸序列的标记探针与样品进行杂交的技术,再通过放射自显影或酶标颜色反应进行检测。分子杂交技术检测灵敏度高,特异性强,目前已成为检测植物病毒的重要手段。在草莓病毒检测中,目前已有利用分子杂交技术检测SVBV的报道[5],但尚无利用分子杂交技术检测SMoV的报道。笔者对此进行研究,旨在建立一种可快速、有效检测SMoV的技术体系。
1 材料和方法
1.1 材 料
感染SMoV的草莓植株取自黑龙江庆安农村庭院草莓园,保存在东北林业大学微生物实验室。
1.2 方 法
1.2.1 草莓叶片总核酸提取
将感染SMoV的草莓幼嫩叶片在液氮中研碎,取约0.05 g加入到盛有500 µL CTAB提取缓冲液的1.5 mL Eppendorf管中,65 ℃水浴15 min。用500 µL体积比24∶1的氯仿、异戊醇抽提2次,上清液中加入1/4体积的10 mol/L LiCl。加入400 µL无菌水,14 000离心5 min,取上清。再加入400 μL体积比24∶1的氯仿、异戊醇,离心5 min。将上清液转入新的离心管中,加入 1/10体积 0.3 mol/L CH3COONa(pH5.2)、3倍体积无水乙醇,–20 ℃10 000 r/min离心10 min,弃上清。用70%乙醇洗涤沉淀2次,放置于超净工作台上吹干,加入50 μL DEPC水溶解。
1.2.2 RT–PCR反应程序
引物D2、D3位于SMoV基因组的非编码区,具体序列参见文献[5]。引物由TaKaRa公司合成。
检测SMoV的RT反应体积为20 μL,其中包括模板1 μL,正义引物(10 μmol/L)1 μL,其他反应成分与操作步骤参考Invitrogen反转录酶说明书,反转录时间2.5 h。PCR反应程序:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火60 s,72 ℃延伸60 s,循环35次;72 ℃延伸5 min。
1.2.3 特异片段的克隆和测序
利用琼脂糖凝胶回收试剂盒(TaKaRa)回收目的片段,与pMD18–T载体(TaKaRa)连接,然后转化大肠杆菌感受态细胞。经蓝白斑筛选,挑取白色菌落培养,提取质粒,通过PCR鉴定阳性克隆之后进行测序[8]。利用BLAST工具,在GenBank中进行相似性分析。利用DNAman软件进行系统进化分析。
1.2.4 分子杂交技术检测
利用DIG DNA标记试剂盒(深圳莱伯克生物技术公司),采用PCR技术制备cDNA探针。反应体系共20 μL,包括正义引物(100 pmol/L)和反义引物(100 pmol/L)各 1 μL,DNA模板 1 μL,10×PCR Buffer 2 μL,Dig–dUTP标记混合物2 μL,Taq DNA聚合酶2 U/μL。反应程序与RT–PCR反应程序相同。
以草莓感染SMoV的叶片为试材,利用CTAB法提取总核酸,利用地高辛标记探针对感染SMoV样本进行杂交检测。杂交后加入抗地高辛碱性磷酸酶标记的抗体,利用碱性磷酸酶和化学底物的作用检测杂交信号。杂交检测包括总核酸提取、预杂交、杂交、洗膜、信号检测等步骤,按深圳莱伯克生物技术公司的杂交试剂盒说明书进行操作。对总核酸样品分别进行10、100倍稀释,分析分子杂交检测的灵敏度。
2 结果与分析
2.1 利用RT–PCR技术扩增SMoV非编码区
经电泳分析,RT–PCR产物大小约220 bp,与预期片段大小一致(图1)。2.2 RT–PCR扩增产物的克隆测序及序列分析
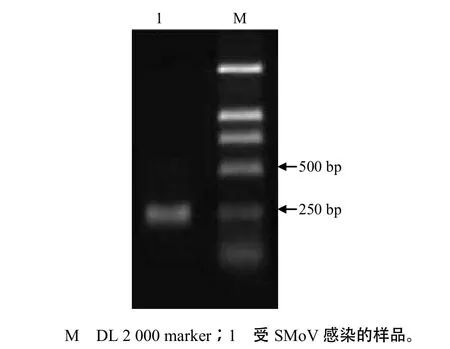
图1 SMoV非编码区片段的RT–PCR扩增结果Fig.1 Result of agarose ge l e lectrophoresis for am plified t he fragment of non-coding region of SMoV
测序结果表明,质粒中插入的DNA片段的大小为219 bp。BLAST结果显示,质粒中插入的DNA片段仅与GenBank中SMoV的非编码区序列有同源性;与GenBank收录号为AJ311875、AJ498586 和AJ496589的SMoV分离物的序列同源性最高,为97%,与GenBank收录号为AJ496588 的SMoV分离物同源性最低,为92%。利用DNAman软件进行系统进化分析,结果显示,本研究中获得的分离物的非编码区序列(ZX–SMoV)与 GenBank中已报道的分离物的亲缘关系较远(图 2),独立形成 1个小的进化支。
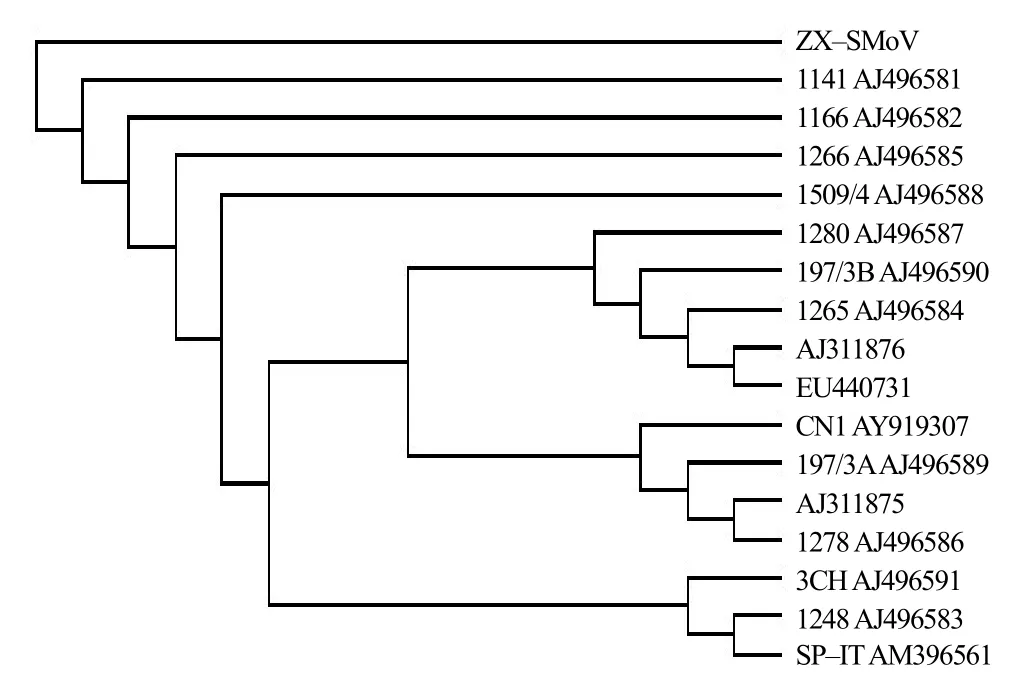
图2 基于SMoV部分非编码区核苷酸序列的不同分离物的系统发育树Fig.2 Phylogenetic tree of the nucleotide sequence in non-coding region of SMoV from different isolates
2.3 SMoV的分子杂交技术检测结果
琼脂糖凝胶电泳检测结果显示,探针电泳条带清晰整齐,并且探针条带与RT–PCR产物的电泳条带基本处于同一位置,表明得到的探针与RT–PCR产物的长度相近(图3)。由于探针中含有地高辛,与RT–PCR产物相比,探针电泳略慢。电泳结果显示,合成的探针与预期的相符。
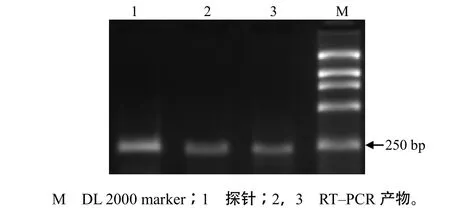
图3 地高辛标记探针的琼脂糖凝胶电泳图谱Fig.3 Result of agarose gel electrophoresis of the Digoxigenin labeled probe
如图4所示,在草莓感染SMoV叶片核酸位置显示黑色的化合物,证明有 SMoV的存在,阴性对照中未见杂交信号,总核酸稀释10倍后仍可有效检测,总核酸稀释100倍后仍可见弱的杂交信号,说明整个探针及杂交体系是有效的,且灵敏度较高。

图4 地高辛标记cDNA探针检测草莓叶片中SMoV的点杂交结果Fig.4 Result o f dot-hybridization for de tection of SMoV i n leaves of strawberry by digoxigenin labeled cDNA probe
3 结论与讨论
PCR技术是检测植物病毒最常用的技术之一,检测灵敏度较高。草莓组织中富含次级代谢产物,如丹宁、多酚、多糖类物质,这些次级代谢产物在提取核酸的过程中难以去除,抑制DNA聚合酶的功效,因而影响PCR反应的稳定性。在检测草莓病毒的研究中,Thompson等[6]系统研究了RNA提取方法对RT–PCR检测结果的影响,发现使用Qiagen公司RNA提取试剂盒提取的核酸为模板,不同反转录反应、不同PCR反应的结果不同。本研究中核酸提取方法尽管步骤较繁琐,但经过多次沉淀和溶解,可将核酸中的大部分杂质去除,因而RT–PCR结果较稳定。
本研究中获得的草莓病毒分离物是当地农民多年以匍匐茎无性繁殖扩繁获得的植株。中国早期栽培的草莓可能是自俄罗斯经黑龙江传入中国的[9]。本研究中草莓植株是否来源于此尚不确切。系统进化分析显示,本研究中的SMoV分离物的非编码区序列与GenBank中已报道的分离物的亲缘关系较远,独立形成1个小的进化支,因而该分离物可能是一个独特的中国分离物。
SMoV株系变异复杂,其核苷酸序列变异也极为复杂,因而即使在其基因组保守区域(如非编码区)设计PCR引物也较困难,一些基于其他基因片段设计的引物仅能有效检测部分株系[10]。分子杂交技术受病毒株系变异及核苷酸序列变异的影响较小,因而对所有分离物一般都可有效检测。本研究结果表明,利用地高辛标记的cDNA探针可有效检测草莓叶片中的SMoV。分子杂交的缺点在于检测成本略高,但近年来非放射性标记物的价格正逐步下降。随着新标记物的不断开发及已有标记物价格的快速下降,分子杂交将在病毒检测中发挥更大的作用。
本研究中技术体系的缺陷在于一次杂交反应仅能检测一种病毒,当前病毒检测的总体发展趋势是同时检测多种病毒。早期研究中,Saade等[11]利用分子杂交同时检测3种植物病毒,即将苹果花叶病毒(Apple mosaic virus, ApMV)、李属坏死环斑病毒(Prunus necrotic ringspot virus, PNRSV)和洋李矮缩病毒(Prune dwarf virus, PDV)的探针混合后进行杂交反应,阳性杂交结果则说明检测样品含有上述3种病毒中的1种或多种。受探针浓度、杂交反应体系的影响,3种探针混合降低了探针的浓度,从而可能影响检测的灵敏度。基因芯片(DNA chip)技术本质上也是基于分子杂交原理,其可同时检测多种病毒,理论上可将所有的植物病毒整合在一张芯片上进行检测,但其灵敏度、稳定性尚有待提高[12]。为了建立同时检测多种病毒的技术体系,在本研究的基础上,东北林业大学微生物实验室正探索将不同草莓病毒的基因序列连接后制备成1个探针,以同时检测多种草莓病毒。
[1] Frazier N W,Thresh J M,Varney E H.Virus Diseases of Small Fruits and Grapevines[M].California:University of California Press,1970:4–8.
[2] Yoshikawa N,Converse R H.Purification and some properties of Strawberry mottle virus[J].Anuals of Appied Biology,1991,118(3):565–576.
[3] Thompson J R,Leone G,Lindner J L,et al. Characterization and complete nucleotide sequence of Strawberry mottle virus:A tentative member of a new family of bipartite plant picorna–like viruses[J].Journal of General Virology,2002,83:229–239.
[4] Mayo M A.Changes to virus taxonomy[J].Archives of Virology,2005,150:189–198.
[5] Martin R R,Tzanetakis I E.Characterization and recent advances in detection of Strawberry viruses[J].Plant Disease,2006,90(4):384–396.
[6] Thompson J R,Wetzel S,Klerks M M,et al.Multiplex RT–PCR detection of four aphid-borne Strawberry viruses in Fragaria spp.in combination with a plant mRNA specific internal control[J].Journal of Virological Methods,2003,111:85–93.
[7] Posthuma K I,Adams A N,Hong Y,et al.Detection of Strawberry crinkle virus in plants and aphids by RT–PCR using conserved L gene sequences[J].Plant Pathology,2002,51:266–274.
[8] 迪芬巴赫,德维克斯勒.PCR技术实验指南[M].黄培堂,余炜源,陈添弥,等译.北京:科学出版社,1998.[9] 张运涛.草莓研究进展(二) [M].北京:中国林业出版社,2006.
[10] Thompson J R,Jelkmann W.The detection and variation of Strawberry mottle virus[J].Plant Disease,2003,87(4):385–390.
[11] Saade M,Aparicio F,Sanche–navarro J A,et al. Simultaneous detection of the three Illaviruses affecting stone fruit trees by nonisotopic molecular hybridization and multiplex reverse–transcription polymerase chain reaction[J].Phytopathology,2000,90:1330–1336.
[12] 杨洪一,李丽丽,张志宏.果树病毒核酸检测技术研究进展[J].中国农学通报,2007,23(2):350–354.
责任编辑:王赛群
英文编辑:王 库
Detection of Strawberry mottle virus by molecular hybridization
LI Li-li1, YANG Hong-yi2*
(1.Institute of Forestry Science of Heilongjiang Province, Harbin 150081, China; 2.College of Life Science, Northeast Forestry University, Harbin 150040, China)
To validate the technique of molecular hybridization on the detection of Strawberry mottle virus (SMoV), total nucleic acid, which extracted from strawberry leaves using CTAB approach, was adopted as a template to be amplified with specific primers in non-coding region of SMoV. And then, sequences of SMoV were obtained after cloning and sequencing phases. The results of phylogenetic analysis indicated that there was a far relative between the isolate in this research and the reported isolates in GenBank, the isolate in the study formed a small unattached branch in phylogenetic tree. Using plasmid DNA with viral specific fragment as a template, a cDNA probe labeled with digoxigenin was prepared by PCR. SMoV could be efficiently detected by the cDNA probe in the test material of strawberry leaves infected by SMoV, as well as in the extreme case with 10 folds dilution solution of total nucleic acid. To our knowledge, this is the first report on the detection of SMoV by cDNA probe.
Strawberry mottle virus; molecular hybridization; cDNA probe
S668.4
A
1007−1032(2014)03−0273−04
10.13331/j.cnki.jhau.2014.03.010
投稿网址:http://www.hunau.net/qks
2013–10–16
中央高校基本科研业务费项目(DL13EA06–3)
李丽丽(1978—),女,辽宁阜新人,博士,助理研究员,主要从事微生物学研究;*通信作者,yhyi1@sohu.com
