羧甲基琼胶寡糖钒络合物抗氧化及抑制BEL-7402癌细胞增殖的研究
2014-06-28刘广洋冯大伟靳志明刘胜一衣悦涛
刘广洋 ,冯大伟靳志明 ,刘胜一 ,衣悦涛
(1.中国科学院 烟台海岸带研究所,山东 烟台 264003;2.中国科学院大学,北京 100049)
琼胶寡糖一般是琼脂糖经水解后得到的聚合度为 2~10的低聚糖,包括琼寡糖和新琼寡糖[1]。琼胶寡糖具有较强的抗癌、抗氧化、抗炎等生理特性[2],此外,还具有良好的生物相容性和可降解性,具有易溶、易吸收和无毒副作用等特点,是一种新型的海洋功能性低聚糖。钒是生命体的一种必需微量元素,具有降血糖、类胰岛素、抗癌、抗炎、杀精子等作用。早在19世纪,钒的无机盐就被用于治疗贫血、营养不良、肺结核等疾病[3]。考虑到无机钒的脂溶性小、生物利用度低、毒性较高、副作用大,故对有机钒配合物的研究应运而生。有机钒配合物多样的生理活性特别是类胰岛素效应和抗癌作用,吸引了众多研究者的注意。近年来研究表明[4-6],有机钒配合物在体内、体外都表现出抗肿瘤活性,有潜力开发成新的抗肿瘤药物。海藻多糖钒络合物的降糖作用[7]已有研究,但钒氧海藻寡糖的抗氧化及抗癌活性的研究尚未见报道。
基于这样的研究背景下,作者以具有抗癌、抗氧化、抗炎等生理特性的海洋琼胶寡糖为原料,通过羧甲基化得到羧甲基琼胶寡糖,再与钒氧离子络合,首次制备了羧甲基琼胶寡糖钒络合物并研究其抗氧化及抑制人肝癌BEL-7402细胞增殖的活性。
1 材料和方法
1.1 仪器和药品
TU-1810紫外可见分光光度计,北京普析通用化学有限责任公司;FTIR-4100红外光谱仪,日本Jasco;ELAN DRC II电感耦合等离子体质谱仪,PerkinElmer(Hong Kong)Ltd;琼胶糖,北京康倍斯科技有限公司;DPPH,日本wako;Vc(99.7%),天津市红岩化工厂: 其他试剂均为分析纯。
1.2 羧甲基琼胶寡糖钒络合物的制备
琼胶寡糖的制备: 参考文献[8]制备琼胶寡糖混合物,平均分子质量的测定方法采用端基法。
羧甲基琼胶寡糖的制备: 参考文献[9]制备羧甲基琼胶寡糖。
羧甲基琼胶寡糖钒络合物的制备: 将羧甲基琼胶寡糖溶于NaOH稀溶液并调pH到12,30 ℃水浴下搅拌0.5 h。加入0.25 g VOSO4,反应4~8 h至溶液变澄清透明,在整个反应过程中始终保持溶液pH≥12。反应液浓缩醇沉,沉淀用70 %乙醇洗涤多次。粗产物溶于少量水,加入丙酮沉淀,抽滤,用无水乙醇洗涤多次,45 ℃真空干燥24 h得固体产品。
1.3 羧甲基琼胶寡糖钒络合物结构的鉴定及其钒含量的测定
取样品1~2 mg,KBr压片,在FTIR-4100红外光谱仪上进行红外分析。
按照ICP-MS水/废水中低含量金属离子的测定标准测定羧甲基琼胶寡糖钒络合物中钒的含量。
1.4 琼胶寡糖及其衍生物抗氧化活性实验
羟基自由基(·OH)清除率的测定: 参照文献[10]并稍作调整,反应体系含有 1 mL磷酸缓冲溶液(0.15 mmol/L、pH 7.4),1 mL番红花红(80 mg/L),1 mL H2O2(0.03%),1 mL EDTA-FeⅡ(0.945 mmol/L),0.5 mL 不同浓度的样品溶液,混合均匀后在 37℃水浴锅内恒温0.5 h,然后以蒸馏水调零测定520 nm处吸光值,每个浓度做3次平行。羟基自由基的清除率E(%)的计算公式为:

式中: A1为加入样品溶液后的吸光值,A2为以对应体积的蒸馏水代替样品溶液的吸光值,A3为以对应体积的蒸馏水代替EDTA-Fe(Ⅱ)和样品溶液的吸光值。
DPPH自由基清除率的测定: 参照文献[11,12]并稍作调整,用95%的乙醇配制浓度为2×10-4mol/L的DPPH溶液,取2 mL的DPPH溶液,2 mL不同浓度的样品溶液加入10 mL比色管中。混合均匀后避光放置0.5 h,然后以95%乙醇做参比测定525 nm处吸光值,每个浓度做3次平行。DPPH自由基的清除率F(%)的计算公式为:
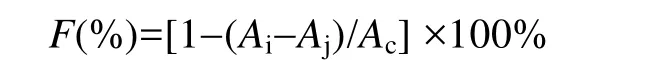
式中: Ai为加入样品溶液后的吸光值,Aj为以对应体积的95%乙醇代替DPPH溶液的吸光值,Ac为以对应体积的95%乙醇代替样品溶液的吸光值。
1.5 羧甲基琼胶寡糖钒络合物对人肝癌BEL-7402细胞增殖的影响
采用磺酰罗丹明B(sulforhodamine B SRB)蛋白染色法[13]对人肝癌细胞BEL-7402进行筛选。胰蛋白酶消化生长良好的人肝癌细胞 BEL-7402,然后用10%牛血清 1640悬浮 200 µL,调整细胞数为2×105/mL,加至 96孔板,0.1 mL/孔,将化合物稀释成不同梯度溶液(16,63,250,1 000,4 000 mg/L)分别加入细胞孔中,每一稀释度设4孔,37℃,5%CO2作用72 h。经过药物暴漏后,细胞用 12%的三氯乙酸固定,并用磺酰罗丹明B染色,然后用酶标仪测515 nm处的OD值。抑制率(Inhibition ratio,I)计算公式如下:
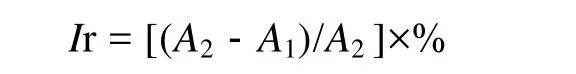
式中: A1为加入样品溶液后的OD值,A2为对照组的OD值。
2 结果与讨论
2.1 羧甲基琼胶寡糖钒络合物结构的鉴定
图1为琼胶寡糖及其衍生物的红外光谱图,在琼胶寡糖红外谱中3 424.96 cm−1处的吸收峰为羟基的伸缩振动,929.52 cm−1处吸收峰为α-3,6-内醚-L-半乳糖的醚键伸缩振动,890.95 cm−1处的吸收峰为β型糖苷键特征峰。对比琼胶寡糖的红外光谱可以发现,羧甲基琼胶寡糖的红外光谱中1 600.63 cm−1处的羧酸盐的羰基非对称伸缩振动吸收峰和1 419.35 cm−1处羧酸盐的羰基对称伸缩振动吸收峰均明显变宽增强,表明琼胶寡糖成功羧甲基化。

图1 琼胶寡糖及其衍生物红外光谱图Fig.1 IR of agaro-oligosaccharides and its derivatives
对比羧甲基琼胶寡糖的红外光谱可以发现,羧甲基琼胶寡糖钒络合物的羟基吸收峰移向高波数,可能是羟基与钒氧离子络合,使得羟基的氢键缔合作用减弱,羟基的吸收峰增强;羧酸盐的羰基非对称伸缩振动峰和羧酸盐的羰基对称伸缩振动峰均减弱,说明羧基中的氧原子与钒氧离子的络合: 查阅文献[14,15]确定在 941.09 cm−1处出现新的强吸收峰为V O的伸缩振动: 以上分析表明,钒氧离子与羧甲基琼胶寡糖以化学键的形式结合,即成功合成了羧甲基琼胶寡糖钒络合物。 ICP-MS测定钒在羧甲基琼胶寡糖钒络合物中的含量为4.6 %。
2.2 琼胶寡糖及其衍生物的抗氧化活性
2.2.1 琼胶寡糖及其衍生物对羟基自由基的清除作用
多糖清除羟基自由基的机理可能是醇羟基络合产生·OH 的必需金属离子,抑制·OH 的产生或多糖的醇羟基的氢原子和·OH直接作用[16-17]。由图 2可知,3种样品的浓度与其羟基自由基清除率均成正比关系。当样品浓度为 0.22~ 1.11 g/L 时,琼胶寡糖对·OH的清除率为19.6 %~ 40.9 %,羧甲基琼胶寡糖的清除率为33.3 %~ 60.4 %,羧甲基琼胶寡糖钒络合物的清除率为57.8 %~ 80.5 %。钒氧络合修饰后,羧甲基琼胶寡糖钒络合物清除·OH的能力得到显著提高。这可能是由于钒是过渡金属元素,d轨道电子容易得到或失去,羧甲基琼胶寡糖钒络合物中的钒元素可以在V(Ⅳ)和V(Ⅴ)两种价态之间进行转换[18]。钒的这种特性使得羧甲基琼胶寡糖钒络合物中的钒具有清除自由基的作用[19]。
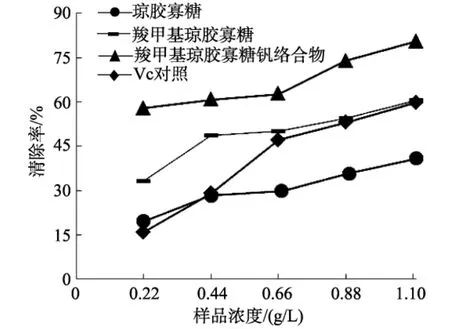
图2 琼胶寡糖及其衍生物清除羟基自由基Fig.2 Hydroxyl radical scavenging activity of agaro-oligosaccharides and its derivatives
2.2.2 琼胶寡糖及其衍生物对DPPH自由基的清除作用
多糖清除 DPPH自由基的机理可能与多酚类化合物清除 DPPH自由基的机理相似[20],即化合物提供氢原子或者提供单电子与 DPPH自由基配对,达到清除目的。由图3可知,三种样品对DPPH自由基的清除能力随它们的浓度增大而增强。在测定浓度0.5~2.5 g/L内,琼胶寡糖对DPPH自由基的清除率为19.5%~78.0%,羧甲基琼胶寡糖对DPPH自由基的清除率为 24.5%~79.2%,羧甲基琼胶寡糖钒络合物对 DPPH自由基的清除率为 66.8%~92.2%。与羧甲基琼胶寡糖相比,羧甲基琼胶寡糖钒络合物清除DPPH自由基的能力有明显的提高。这可能是由于钒是过渡金属元素,羧甲基琼胶寡糖钒络合物中钒的d轨道电子可以与DPPH自由基直接作用。
2.3 羧甲基琼胶寡糖钒络合物抑制人肝癌BEL-7402细胞增殖的活性
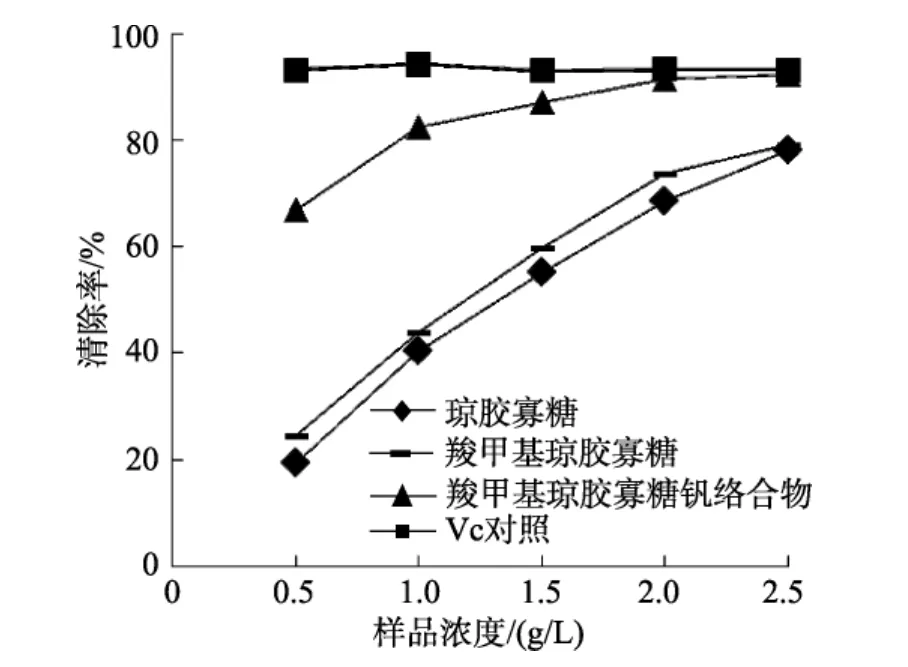
图3 琼胶寡糖及其衍生物清除DPPH自由基Fig.3 DPPH radical scavenging activity of agaro-oligosaccharides and its derivatives
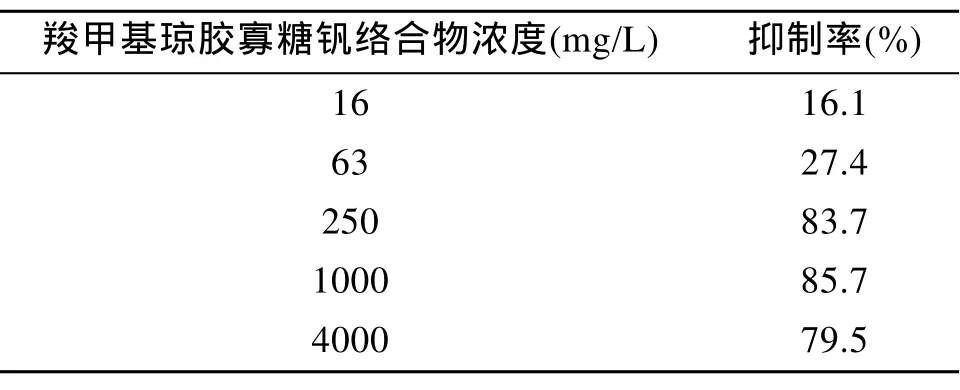
表1 羧甲基琼胶寡糖钒络合物对BEL-7402细胞生长的抑制Tab.1 Antiproliferation effects of vanadyl Carboxymethyl agaro-oligosaccharides on BEL-7402 cells
由表1可知,羧甲基琼胶寡糖钒络合物对人肝癌BEL-7402细胞具有一定的抑制作用,当样品浓度为16~1 000 mg/L时,抑制率随样品浓度的增加而增加,有剂量依赖关系,到一定程度后,随着样品浓度的增加抑制率开始下降。以上分析表明,羧甲基琼胶寡糖钒络合物在16~1 000 mg/L浓度范围内有较好的抑制人肝癌BEL-7402细胞增殖的活性。
3 结论
本研究首次制备了羧甲基琼胶寡糖钒络合物并研究其抗氧化及抑制人肝癌 BEL-7402细胞增殖的活性。经红外光谱法表征,表明钒氧离子与羧甲基琼胶寡糖以化学键的形式结合,利用 ICP-MS测定钒氧羧甲基琼胶寡糖中钒含量分别为 4.6 %。抗氧化实验表明羧甲基琼胶寡糖络合钒氧离子后,其清除·OH的能力和DPPH自由基的能力均得到显著提高。经磺酰罗丹明B蛋白染色法测试,进一步发现羧甲基琼胶寡糖钒络合物在 16~1000 mg/L浓度范围内对人肝癌 BEL-7402细胞的增殖有较好的抑制作用,为羧甲基琼胶寡糖钒络合物抗癌活性的应用奠定了基础。
[1]Kazłowski B,Pan C L,Ko Y T.Separation and quantification of neoagaro-and agaro-oligosaccharide products generated from agarose digestion by β-agarase and HCl in liquid chromatography systems [J].Carbohydrate Research,2008,343(14): 2443-2450.
[2]Mei J,Shao J,Wang Q,et al.Separation and quantification of neoagaro-oligosaccharides [J].Journal of Food Science and Technology,2013,50(6): 1217-1221.
[3]Shechter Y,Karlish S J D.Insulin-like stimulation of glucose oxidation in rat adipocytes by vanadyl (IV)ions [J].Nature,1980,284: 556-558.
[4]Thompson K H,Orvig C.Boon and bane of metal ions in medicine [J].Science,2003,300(5621): 936-939.
[5]Crans D C,Smee J J,Gaidamauskas E,et al.The chemistry and biochemistry of vanadium and the biological activities exerted by vanadium compounds [J].Chemical Reviews-Columbus,2004,104(2): 849-902.
[6]Hwang J H,Larson R K,Abu-Omar M M.Kinetics and mechanistic studies of anticarcinogenic bisperoxovanadium (V)compounds: Ligand substitution reactions at physiological pH and relevance to DNA interactions[J].Inorganic Chemistry,2003,42(24): 7967-7977.
[7]Zhang H,Yi Y,Feng D,et al.Hypoglycemic Properties of Oxovanadium (IV)Coordination Compounds with Carboxymethyl-Carrageenan and Carboxymethyl-Chitosan in Alloxan-Induced Diabetic Mice [J].Evidence-Based Complementary and Alternative Medicine,2011,doi:10.1155/2011/691067.
[8]Chen H M,Zheng L,Yan X J.The preparation and bioactivity research of agaro-oligosaccharides [J].Food Technology and Biotechnology,2005,43(1): 29-36.
[9]Sun T,Yao Q,Zhou D,et al.Antioxidant activity of N-carboxymethyl chitosan oligosaccharides [J].Bioorganic &medicinal chemistry letters,2008,18(21):5774-5776.
[10]Guo Z,Xing R,Liu S,et al.The synthesis and antioxidant activity of the Schiff bases of chitosan and carboxymethyl chitosan [J].Bioorganic &medicinal chemistry letters,2005,15(20): 4600-4603.
[11]Ajisaka K,Agawa S,Nagumo S,et al.Evaluation and comparison of the antioxidative potency of various carbohydrates using different methods [J].Journal of agricultural and food chemistry,2009,57(8):3102-3107.
[12]Chung Y C,Chang C T,Chao W W,et al.Antioxidative activity and safety of the 50 ethanolic extract from red bean fermented by Bacillus subtilis IMR-NK1 [J].Journal of Agricultural and Food Chemistry,2002,50(8): 2454-2458.
[13]Iwasa K,Moriyasu M,Yamori T,et al.In vitro cytotoxicity of the protoberberine-type alkaloids [J].Journal of Natural Products,2001,64(7): 896-898.
[14]Etcheverry S B,Williams P A M,Baran E J.Synthesis and characterization of oxovanadium (IV)complexes with saccharides [J].Carbohydrate Research,1997,302(3): 131-138.
[15]Baran E J.Review: spectroscopic studies of oxovanadium coordination compounds [J].Journal of Coordination Chemistry,2001,54(3-4): 215-238.
[16]Shon M Y,Kim T H,Sung N J.Antioxidants and free radical scavenging activity of Phellinus baumii (Phellinus of Hymenochaetaceae)extracts [J].Food Chemistry,2003,82(4): 593-597.
[17]Wang J,Zhang Q,Zhang Z,et al.Antioxidant activity of sulfated polysaccharide fractions extracted from Laminaria japonica [J].International Journal of Biological Macromolecules,2008,42(2): 127-132.
[18]Willsky G R,White D A,McCabe B C.Metabolism of added orthovanadate to vanadyl and high-molecularweight vanadates by Saccharomyces cerevisiae [J].Journal of Biological Chemistry,1984,259(21): 13273-13281.
[19]Mohammadi M,Yazdanparast R.Radical scavenging abilities and hepatoprotective effect of [N,N′-Bis (salicylidene)ethane-1,2-diaminato]oxovanadium (IV)complex in CCl4-treated rats [J].Experimental and Toxicologic Pathology,2010,62(5): 533-538.
[20]Kishk Y F M,Al-Sayed H.Free-radical scavenging and antioxidative activities of some polysaccharides in emulsions [J].LWT-Food Science and Technology,2007,40(2): 270-277.
