冷冻消融治疗椎旁恶性间叶组织肿瘤疼痛疗效研究
2014-06-28邢文阁王海涛杨雪玲刘长富
李 勇 郭 志 邢文阁 王海涛 杨雪玲 刘长富
冷冻消融治疗椎旁恶性间叶组织肿瘤疼痛疗效研究
李 勇 郭 志 邢文阁 王海涛 杨雪玲 刘长富
目的:评价冷冻消融对于椎旁恶性间叶组织肿瘤疼痛治疗的有效性及安全性。方法:收集31例伴随疼痛的椎旁恶性间叶组织肿瘤患者,均不能或不能耐受手术切除,其疼痛使用传统的止痛治疗效果不佳。肿瘤直径3~20 cm。使用简明疼痛量表(BPI),对患者术前基线水平及冷冻消融治疗后1天、1周、1个月、3个月的疼痛进行评估。结果:BPI的分数被分为两类:疼痛的严重程度和疼痛对生活的影响,在冷冻消融术后,均呈现下降的趋势。疼痛严重程度评分在术后1天及1个月下降明显(P= 0.001,t=3.862;P=0.031,t=2.261),疼痛影响评分在术后1天及1周下降明显(P=0.016,t=2.566;P=0.036,t=2.195)。2例患者(6.45%)出现轻微并发症,无严重并发症发生。结论:对于合并癌性疼痛的不能手术切除的椎旁恶性间叶组织肿瘤患者,冷冻消融治疗是一种风险低,耐受性好的局部治疗手段,具有较好的疼痛治疗效果。
冷冻消融 椎旁 间叶组织肿瘤 疼痛
椎旁恶性间叶组织肿瘤患者常合并较为严重的疼痛,虽然有许多姑息性治疗手段可供选择,但大部分治疗方法都具有难以回避的不良反应或作用效果有限。阿片类和非阿片类镇痛药的不良反应随着剂量增加而变得难以忍受。姑息性放疗、化疗或外科手术由于肿瘤的特殊位置,往往因为辐射剂量,化疗药物毒性以及患者不耐受手术而受到限制。顽固性癌痛的患者需要其他的治疗选择,以最大限度地提高疼痛控制和减少痛苦。多种微创治疗技术已经被应用于疼痛的治疗,其中神经毁损是患者缓解疼痛的主要原因[1-2]。
冷冻消融治疗为癌性疼痛的治疗提供了一种新方法,已经成功应用于前列腺癌等恶性肿瘤的临床治疗超过10年[3],有报道使用冷冻消融治疗能够有效抑制骨转移癌患者的疼痛[4],但对于椎旁恶性间叶组织肿瘤引起的疼痛,使用冷冻消融治疗是否能够获得理想的效果鲜见报道。本研究的目的是评估冷冻消融治疗对于椎旁恶性间叶组织肿瘤疼痛的短期疗效和安全性。
1 材料与方法
1.1 基本资料
从2002年1月至2012年12月,本研究纳入患者共计31例,其中男性12例(38.71%)、女性19例(61.29%)。年龄25~72岁,平均年龄55.93岁,中位年龄58岁。患者均为使用常规药物止痛治疗后仍伴有较严重的疼痛,要求进一步治疗的难治性疼痛患者。患者疼痛评分中,术前平均疼痛严重程度评分6.3,中位疼痛严重程度评分6.0,术前平均疼痛影响程度评分5.3,中位疼痛严重程度评分5.0。
病理类型包括:脂肪肉瘤13例,纤维肉瘤5例,恶性纤维组织增生症5例,滑膜肉瘤4例,粘液样纤维肉瘤1例,炎性肌纤维母细胞瘤1例,癌样肉瘤1例,恶性骨巨细胞瘤1例。
肿瘤直径为3~20 cm,肿瘤直径≤5 cm的患者占16.13%(5/31),5~10 cm的占48.39%(15/31),肿瘤直径>10 cm的患者占35.48%(11/31),平均肿瘤直径为9.26 cm。肿瘤分期:Ⅱa期16.13%(5/31),Ⅱb期38.71%(12/31),Ⅲ期29.03%(9/31),Ⅳ期16.13%(5/31)。
1.2 方法
1.2.1 主要治疗设备仪器 美国Endocare公司氩氦冷冻治疗系统;日本东芝公司16排螺旋CT。
1.2.2 治疗方法 局部冷冻消融治疗:本组全部采用局部麻醉方法,起效后,取俯卧位,常规消毒铺无菌巾。根据肿瘤大小及位置,选择直径为2 mm冷冻探针2~4个,采用CT影像导引技术,经皮穿刺,使多个冷冻探针在肿瘤内适形,评估并确认冷冻消融范围可覆盖肿瘤。在冷冻消融过程中,每5 min行CT平扫检查。根据CT平扫结果调整输出功率,控制冷冻消融冰球的进展速度及覆盖范围。将冷冻消融温度控制在-80℃~-120℃(测温探针温度)。冷冻消融持续15 min复温5 min,完成第一次循环治疗。复温5 min后,使用上述方法进行第二次循环治疗。全部操作均在心电、呼吸、脉搏、血氧饱和度监测下进行。
1.2.3 随访与效果评价 使用简明疼痛量表(BPI)对患者术前基线水平及冷冻消融治疗后1天、1周、1个月、3个月的疼痛进行评估。随访详细记录患者术后并发症。患者术前、术后1个月、及术后3个月均行强化MR或强化CT检查,结合影像学检查结果,根据改良RECIST标准进行疗效评价。
1.3 统计学处理
统计学分析采用GraphPad Prism 5统计分析软件包。样本均数分析采用Wilcoxon检验,P<0.05为差异具有统计学意义。
2 结果
2.1 BPI评分统计
在每个分类项的具体评分中,对于所有的问题,都体现出逐渐下降的趋势(表1)。
本组数据表明,对比冷冻消融治疗术前疼痛的严重程度,术后1天患者疼痛严重程度的缓解,差异具有统计学意义(P=0.001,t=3.862)。术后1周患者的疼痛程度评分较于术后1天有所降低,但差异无统计学意义(P=0.052,t=2.020)。术后1个月,患者的疼痛程度评分较于术后1周显著降低(P=0.031,t=2.261)。术后3个月周患者的平均疼痛程度评分及中位疼痛程度评分较于术后1个月有所降低,但平均疼痛程度评分的差异无统计学意义(P=0.070,t=1.876)。在疼痛影响的评价结果中,术后1天及术后1周,患者的疼痛影响评分均出现了显著下降(P=0.016,t=2.566;P=0.036,t=2.195)。术后1个月及术后3个月的患者疼痛影响评分均有所下降,但差异无统计学意义(P=0.051,t=2.035;P=0.092,t= 1.742,图1)。

表1 冷冻术后BPI评分汇总Table 1 BPI scores after cryoablation

图1 冷冻消融后疼痛评分Figure 1 Pain scores after cryoablation
2.2 肿瘤疗效评价
结合患者影像学检查结果,根据改良RECIST标准进行疗效评价(表2)。
2.3 典型病例
病例1女,24岁,诊断恶性骨巨细胞瘤根治性切除术后复发,切除术中行腰椎内支架固定术。该患者冷冻治疗术前,平均疼痛程度评分9.00分,平均疼痛影响评分8.14分,由于持续疼痛长期卧床。为治疗疼痛,行椎旁肿物冷冻消融治疗,冷冻冰球范围并未覆盖全部肿瘤。术后1个月,患者疼痛明显缓解,平均疼痛程度评分2.25分,平均疼痛影响评分2.28分,停止使用止痛药物,并恢复行走功能。进行强化CT随访,发现肿瘤内部大部分坏死,坏死范围超过冷冻消融范围,仅余周边部分组织伴轻度强化(图2)。患者病情稳定,长期随访至今已超过4年,患者病情稳定,肿瘤未见明显变化。
病例2女,56岁,诊断为左侧胸腔椎旁肿物,针吸活检病理结果为癌样肉瘤。冷冻治疗术前,平均疼痛程度评分6.75分,平均疼痛影响评分6.00分。为治疗疼痛,行椎旁肿物冷冻消融治疗,冷冻冰球范围并未覆盖全部肿瘤。术后1周该患者疼痛即出现明显缓解,平均疼痛程度评分3.14分,平均疼痛影响评分3.25分,患者疼痛逐渐减轻。术后1个月进行强化CT随访,示肿瘤内部大部分坏死,坏死范围超过冷冻消融范围,肿瘤体积缩小(图3)。3个月短期随访示患者疼痛基本消失,病情稳定。
2.3 冷冻消融治疗安全性评价
冷冻消融治疗椎旁恶性间叶组织肿瘤的安全性较高,术后并发症少见。本组患者中仅有2例患者出现术后轻微并发症(6.45%)。1例患者在术后第2天出现体温升高,达39℃,实验室检查不支持感染诊断,予对症处理后体温恢复正常。1例患者出现少量气胸,未予处理,后自行缓解。

表2 冷冻消融治疗疗效评价Table 2 Efficiency evaluation of cryoablation

图2 病例1冷冻消融过程及随访结果Figure 2 Cryoablation procedure and follow-up result of case 1
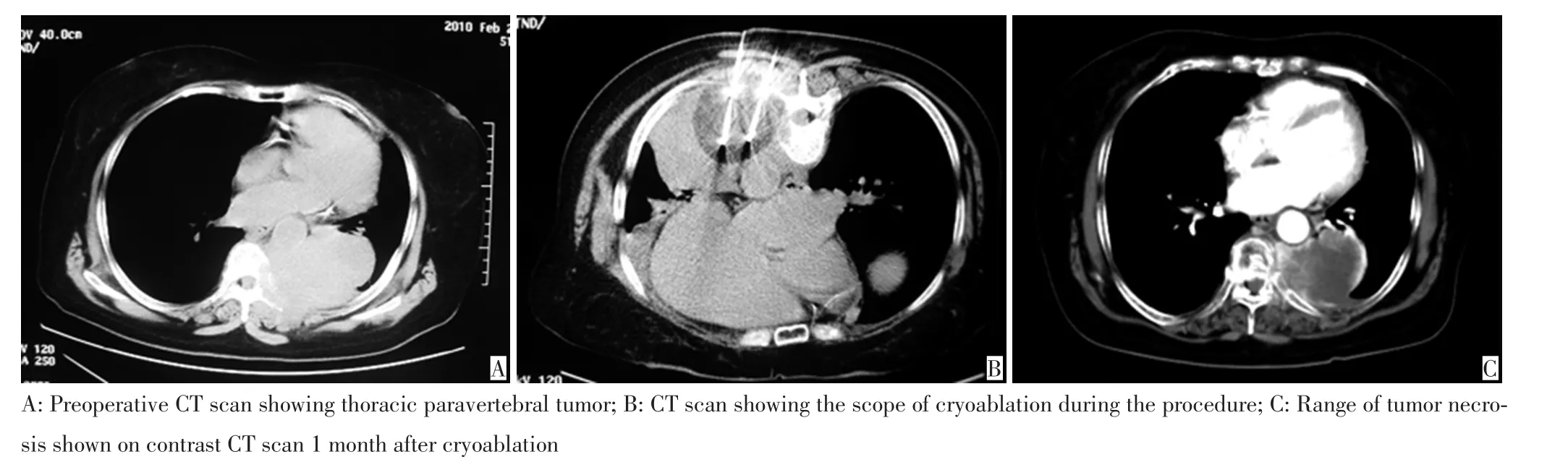
图3 病例2冷冻消融过程及随访结果Figure 3 Cryoablation procedure and follow-up result of case 2
3 讨论
90年代初,美国最早将氩氦冷冻消融治疗应用于前列腺癌放疗、内分泌治疗失败后的补救性治疗。经过十余年临床实践与探索,现已成为前列腺癌首选治疗方法[4],并逐渐扩展至不可手术切除的肝癌等其他抗肿瘤领域,在原发性肝癌、非小细胞肺癌及肾癌等实体性肿瘤的治疗中体现了不可或缺的价值[5-7]。
椎旁恶性间叶组织肿瘤由于所处的特殊解剖位置和病理类型,容易造成局部骨质破坏、反应性肌肉痉挛、局部和血液钙离子浓度升高,以及肿瘤坏死因子(TNF2α)、前列腺素(PG)、内皮素21(ET21)等炎性介质的释放,这些条件都参与了疼痛的产生,并可能造成较为严重的难治性疼痛出现[8-9]。本组研究结果表明,经皮穿刺冷冻消融方式治疗椎旁恶性间叶组织肿瘤疼痛的患者,术后的平均疼痛程度评分以及平均疼痛影响评分均呈现下降趋势。说明冷冻消融治疗能够有效杀伤肿瘤组织,获得肿瘤相关性疼痛控制,与既往使用物理消融治疗肿瘤性疼痛的研究结果相类似。一项治疗疼痛性骨转移的多中心研究显示[10],95%(41/43)的患者在使用射频消融治疗后的1~4周内疼痛获得了明显减轻。另一项使用冷冻消融技术治疗疼痛性骨转移的多中心研究[11],显示69例患者的疼痛评分在术后的1~24周中获得明显降低。在冷冻术后3个月的随访中,患者的疼痛程度评分及疼痛影响评分均呈现出逐渐下降的趋势,说明冷冻消融治疗椎旁肉瘤疼痛,能够获得较长时间的疼痛控制效果,这与既往报道的结果一致[12-13]。疼痛控制的原因,主要是由于消融导致局部组织坏死,间质或瘤体内的压力减低,减轻了对相邻解剖结构的压迫,炎性因子及细胞毒素释放减少,并破坏了局部的神经纤维组织,减少了疼痛信号的传导。
本组研究结果表明,通过经皮穿刺冷冻消融方式治疗椎旁恶性间叶组织肿瘤疼痛的患者,平均疼痛程度评分以及平均疼痛影响评分均在术后第1天获得最大的降幅。说明冷冻消融治疗能够在短时间内有效杀伤肿瘤组织,获得快速的肿瘤相关性疼痛控制。有研究报道,1组使用射频消融技术治疗软组织肿瘤疼痛的病例,疼痛显著缓解时间发生在术后1周,并且在术后1天常出现射频消融治疗引发的疼痛或不适感[1]。在射频消融的手术过程中,由于治疗增加患者的疼痛,通常需要使用静脉麻醉,并且在术中及术后的数小时内提高患者的疼痛级别[1,14]。根据本中心经验,经皮穿刺冷冻消融治疗,通常只在局部浸润麻醉下完成,术中不会因为冷冻消融治疗增加患者的疼痛[15]。此外,冷冻消融术后,患者也未出现由于治疗所引发的疼痛或不适感,这与既往报道结果相一致[16]。考虑到射频消融等高温消融技术,由于热效应引起局部的热损伤或周围组织的水肿,所以对比于冷冻消融需要较长的时间进行正常组织修复[11]。
随着消融治疗设备的不断进步,以及CT等影像学设备的辅助,使得能够使用物理消融方式处理较大体积的间叶组织肿瘤[17-19],并获得较少的术后并发症。本组31例患者中,只有2例患者出现了轻微的术后并发症,给予对症处理后,并发症都获得了较好的控制。Livraghi等[14]报道,小于4.7%的患者,在射频消融治疗后出现并发症,并认为其原因是由于消融的位置表浅或靠近膈肌等重要器官。Dupuy等[11]报道,在使用射频消融治疗疼痛性骨转移的患者中,4%(2/55)的患者出现了神经损伤等术后并发症。根据以往报道,冷冻消融和射频消融所产生的术后并发症的发生率均较低,两者无明显差异[15]。但是相对于射频消融,冷冻消融所形成的冰球范围能够在CT平扫中清楚显示,这有助于控制冷冻消融治疗的范围,从而减少非目标组织的消融损伤。本组资料使用冷冻消融治疗,针对缓解肿瘤性疼痛。作为一种姑息性的治疗方法,冷冻消融在部分患者中获得了意外的肿瘤治疗效果,肿瘤坏死范围超过冷冻消融范围,如病例1。根据改良RECIST标准进行疗效评价,冷冻消融治疗椎旁恶性间叶组织肿瘤可以获得较高的部分缓解率(PR)。提示冷冻消融治疗对于恶性间叶组织肿瘤不单具有疼痛治疗效果,也具有一定的肿瘤治疗效果。
恶性肿瘤患者的生存质量与疼痛情况密切相关。本研究使用BPI量表来考查椎旁恶性间叶组织肿瘤患者冷冻术后疼痛程度及疼痛影响变化的情况,能够较为全面地对癌性疼痛进行评估,是目前公认癌痛的最佳评估工具之一[20],信度及效度均较为可靠。使用生存质量评分更加详细的专项问卷调查,是否能够更好地定义和了解冷冻消融对于椎旁恶性间叶组织肿瘤疼痛治疗的影响和耐久性,尚有待进一步研究加以证实。
1 Locklin JK,Mannes A,Berger A,et al.Palliation of soft tissue cancer pain with radiofrequency ablation[J].J Support Oncol,2004,(5):439-445.
2 Thacker PG,Callstrom MR,Curry TB,et al.Palliation of painful metastatic disease involving bone with imaging-guided treatment:comparison of patients'immediate response to radiofrequency ablation and cryoablation[J].AJR Am J Roentgenol,2011,197(2):510-515.
3 Cohen JK,Miller RJ,Ahmed S,et al.Ten-year biochemical disease control for patients with prostate cancer treated with cryosurgery as primary therapy[J].Urology,2008,71(3):515-518.
4 Callstrom MR1,Atwell TD,Charboneau JW,et al.Painful metastases involving bone:percutaneous image-guided cryoablation-prospective trial interim analysis[J].Radiology,2006,241(2):572-580.
5 Manenti G,Scarano AL,Pistolese CA,et al.Subclinical Breast Cancer:Minimally Invasive Approaches.Our Experience with Percutaneous RadiofrequencyAblation vs.Cryotherapy[J].Breast Care(Basel),2013,8(5):356-360.
6 Niu LZ,Li JL,Zeng JY,et al.Combination treatment with comprehensive cryoablation and immunotherapy in metastatic hepatocellular cancer[J].World J Gastroenterol,2013,19(22):3473-3480.
7 Li H,Tang K,Niu L,et al.Carcinoembryonic antigen as prognostic factor for metastatic non-small cell lung cancer by percutaneous cryosurgery[J].Cancer Biomark,2013,13(5):337-343.
8 Clohisy DR,Mantyh PW.Bone cancer pain[J].Cancer,2003,97(3 Suppl):866-873.
9 Shi Heling,Li Xuebing,Zhang Tongmei,et al.Clinical analysis of standardized drug treatment of cancer pain at the pain clinic[J]. Chin J Clin Oncol,2013,40(24):1506-1508.[史鹤玲,李雪冰,张同梅,等,癌痛患者疼痛门诊药物治疗的临床效果分析[J].中国肿瘤临床,2013,40(24):1506-1508.]
10 Goetz MP,Callstrom MR,Charboneau JW,et al.Percutaneous image-guided radiofrequency ablation of painful metastases involving bone:a multicenter study[J].J Clin Oncol,2004,22(2):300-306.
11 Dupuy DE,Liu D,Hartfeil D,et al.Percutaneous radiofrequency ablation of painful osseous metastases:a multicenter American College of Radiology Imaging Network trial[J].Cancer,2010,116(4):989-997.
12 Callstrom MR,Dupuy DE,Solomon SB,et al.Percutaneous image-guided cryoablation of painful metastases involving bone:Multicenter trial[J].Cancer,2013,119(5):1033-1041.
13 Li Aimin,Cao Xuchen.Research progress on the clinical classification and treatment of metastatic Spinal Tumors[J].Chin J Clin Oncol,2013,40(14):869-872.[李爱民.脊柱转移性肿瘤的评分和局部治疗[J].中国肿瘤临床,2013,40(14):869-872.]
14 Livraghi T,Solbiati L,Meloni MF,et al.Treatment of focal liver tumors with percutaneous radio-frequency ablation:complications encountered in a multicenter study[J].Radiology,2003,226(2):441-451.
15 Thacker PG,Callstrom MR,Curry TB,et al.Palliation of painful metastatic disease involving bone with image-guided treatment:comparison of patients immediate response to radiofrequency ablation and cryoablation[J].AJR Am J Roentgenol,2011,197(2):510-515.
16 Nishida H,Yamamoto N,Tanzawa Y,et al.Cryoimmunology for malignant bone and soft-tissue tumors[J].Int J Clin Oncol,2011, 16(2):109-17.
17 Tsuchiya H,Nishida H,Srisawat P,et al.Pedicle frozen autograft reconstruction in malignant bone tumors[J].J Orthop Sci,2010,15(3):340-349.
18 Nishida H,Tsuchiya H,Tomita K.Re-implantation of tumour tissue treated by cryotreatment with liquid nitrogen induces anti-tumour activity against murine osteosarcoma[J].J Bone Joint Surg Br, 2008,90(9):1249-1255.
19 Kawano M,Nishida H,Nakamoto Y,et al.Cryoimmunologic antitumor effects enhanced by dendritic cells in osteosarcoma[J].Clin Orthop Relat Res,2010,468(5):1373-1383.
20 Li Xiaomei,Li Hongyi,Xiao Wenhua,et al.Application of pain assessment tools in cancer pain patients[J].Chin J Clin Oncol,2013, 40(24):1482-1486.[李小梅,李虹义,肖文华.癌症患者疼痛量表的应用[J].中国肿瘤临床,2013,40(24):1482-1486.]
(2014-01-15收稿)
(2014-05-30修回)
(本文编辑:周晓颖)
Treatment of malignant paravertebral and mesenchymal tumor pain with cryoablation
Yong LI,Zhi GUO,Wenge XING,Haitao WANG,Xueling YANG,Changfu LIU
Zhi GUO;E-mail:cjr.guozhi@vip.163.com
Department of Interventional Therapy,Tianjin Medical University Cancer Institute and Hospital,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China
Objective:This study aimed to analyze the feasibility,safety,and efficacy of cryoablation in treating pain caused by malignant paravertebral and mesenchymal tumor.Methods:Cryoablation was performed in 31 patients with unresectable and painful malignant paravertebral and mesenchymal tumors whose pain was poorly controlled by conventional treatment methods.Tumors ranged in size from 3 cm to 20 cm.Pain experienced by the patient was assessed using the Brief Pain Inventory(BPI)at 0,1 day, 1 week,1 month,and 3 months post-cryoablation.Results:BPI scores were divided into two categories,i.e.,the influence and the severity of pain.Both categories showed downward trend after cryoablation.Pain severity score significantly decreased(P=0.001,t= 3.862;P=0.031,t=2.261)1 day and 1 month after cryoablation.Pain influence score also significantly decreased(P=0.016,t=2.566;P= 0.036,t=2.195)1 day and 1 week after cryoablation.Two patients(6.45%)had mild complications,and no serious complication was observed.Conclusion:Cryoablation is a low-risk and well-tolerated topical treatment for pain caused by unresectable malignant paravertebral and mesenchymal tumors.
cryoablation,paravertebral,mesenchymal tumor,pain

10.3969/j.issn.1000-8179.20140204
天津医科大学肿瘤医院介入治疗科,国家肿瘤临床医学院研究中心,天津市肿瘤防治重点实验室(天津市300060)
郭志 cjr.guozhi@vip.163.com
李勇 博士,主治医师。专业方向为肿瘤微创与介入治疗的临床和基础研究。
E-mail:liyongman2000@163.com
