多糖合剂的制备及体外间接抗肿瘤活性
2014-06-27叶伶艳齐燕飞
叶伶艳,任 明,吕 琳,李 丽,齐燕飞,李 娟,徐 坤
(吉林大学公共卫生学院卫生检验学教研室,吉林长春 130021)
多糖合剂的制备及体外间接抗肿瘤活性
叶伶艳,任 明,吕 琳,李 丽,齐燕飞,李 娟,徐 坤
(吉林大学公共卫生学院卫生检验学教研室,吉林长春 130021)
目的:分别从人参、松茸和香菇中提取分离人参多糖(GPS)、松茸多糖(PTM)和香菇多糖(PLE), 对GPS、PTM和PLE进行分析鉴定并制备合剂,探讨3种多糖不同比例合剂体外间接抗肿瘤活性。方法:采用水提醇沉法提取分离3种多糖,采用苯酚-硫酸法测定总多糖水平,间羟基联苯法测定糖醛酸水平,国标法测定淀粉水平,应用光谱法和化学法对3种多糖进行分析鉴定。采用正交试验法研究3种多糖的最佳配比。通过细胞毒性T淋巴细胞(CTL)实验,采用LDH释放法检测GPS、PTM和PLE组成的多糖合剂对CTL杀伤活性的影响及对小鼠肥大细胞瘤P815细胞间接杀伤作用。结果:GPS、PTM和PLE的提取率分别为8.85%、9.40% 和10.50%,总多糖水平分别为62.96%、59.13%和33.86%,糖醛酸水平分别为16.44%、9.37%和4.77%,淀粉水平分别为7.26%、2.80%和3.77%。光谱法和化学法鉴定,提取到的物质为多糖。3种多糖质量配比为1∶1∶1、浓度为600 mg·L-1时,CTL杀伤活性最强。结论:获得3种多糖化合物,并进行了表征和鉴定,多糖合剂能够增强CTL杀伤活性,对小鼠肥大细胞瘤P815细胞的增殖具有间接抑制作用。
人参多糖;松茸多糖;香菇多糖;多糖合剂;抗肿瘤活性
肿瘤是当前严重危害人类健康的重大疾病之一,常用的抗肿瘤化学治疗药物不良反应较大,且疗效并不理想,因此寻找效果优良且不良反应较小的抗肿瘤药物是目前医学界研究的热点。多糖因其不良反应小且具有多种药理作用而受到人们的广泛关注,近年来研究[1-3]表明:多糖具有抗肿瘤、肿瘤辅助治疗、增强机体免疫力、抗病毒、抗氧化、降血糖和降血脂的作用。
人参多糖(ginseng polysaccharide,GPS)、松茸多糖(polysaccharides of tricholoma matsutake, PTM)和香菇多糖(polysaccharide of lentinus edodes,PLE)单独使用均有辅助肿瘤治疗及增强免疫力作用,但作用机制不完全相同[4-7]。目前对多糖合剂抗肿瘤作用的研究报道较少,国内有研究[1]表明:多糖复合抗肿瘤作用效果优于单味多糖,具有显著的抗肿瘤、提高免疫功能的作用,且不同多糖之间的药理作用呈现协同性。为了阐明GPS、PTM和PLE合剂的体外间接抗肿瘤活性,本实验以人参、松茸和香菇为原料,提取多糖,对3种多糖分析鉴定,并研究3种多糖不同比例合剂对细胞毒性T淋巴细胞(CTL)杀伤活性的影响及对小鼠肥大细胞瘤P815增殖的间接抑制作用,为其临床应用提供理论依据。
1 材料与方法
1.1 原料、标准品和实验动物人参产地为吉林省长白山地区,松茸和香菇产地为黑龙江省伊春市康宝山,经吉林大学公共卫生学院卫生检验学教研室鉴定为人参、松茸和香菇。人参多糖标准品(吉林省宏久生物科技股份有限公司,批号:070602-D),松茸多糖标准品(南京泽朗医药科技有限公司,批号:ZL20110316),香菇多糖标准品(南京泽朗医药科技有限公司,批号:111109)。实验用健康C57小鼠,动物合格证号:SCXK(吉2007-0003),由吉林大学基础医学院实验动物中心提供。小鼠肥大细胞瘤P815细胞株由吉林大学基础医学院馈赠。
1.2 多糖的提取分离按文献[4-9]采用水提醇沉法提取分离3种多糖。GPS:料液比1∶20; PTM:料液比1∶30;PLE:料液比1∶30,提取温度100℃,提取3次,每次2 h,过滤,滤液10 000 r·min-1离心5 min,取上清液,加4倍体积95%乙醇,4℃醇沉过夜,抽滤,沉淀依次用无水乙醇、丙酮和乙醚洗涤,干燥,称质量。
1.3 3种多糖中成分水平测定粗多糖中总多糖水平采用苯酚-硫酸比色法[10]和紫外可见分光光度计进行测定。多糖中糖醛酸水平按文献[11]采用间羟基联苯法测定。多糖中淀粉经过预处理后,按文献[11]还原糖的测定方法DNS比色法进行测定。
1.4 粗多糖的精制按文献[12-13]采用Sevage法除去粗多糖中蛋白,采用氧化法(H2O2法)脱色素。
1.5 鉴 定红外光谱分析:10 mg样品与溴化钾压片,在4 000~500 cm-1范围内进行扫描,与购买的标准品[14-15]进行对照。Fehling实验:供试品溶液酸水解,调p H为中性,加入等量的碱性酒石酸铜溶液,沸水浴10 min,观察溶液的变化。Molish实验:取供试品溶液适量,加入10% α-萘酚乙醇溶液2~3滴,摇匀,沿试管壁滴加浓硫酸,观察溶液的变化。
1.6 多糖合剂的制备及CTL杀伤活性检测选择GPS、PTM和PLE 3种多糖,以CTL杀伤活性为依据,采用L9(34)正交实验法对3种多糖的复合组方[16]进行研究。见表1。无菌取出小鼠脾脏,将其磨碎,过200目细胞筛,氯化氨裂解红细胞后, PBS洗3次,离心弃上清。加入含10%FBS的RPMI-1640培养基制备脾淋巴细胞悬液,将多糖与淋巴细胞共同孵育24 h,用培养液调整细胞浓度为1×107m L-1,分离脾细胞,将脾细胞悬液加入96孔板中,每孔100μL。以小鼠肥大细胞瘤P815细胞作为检测CTL杀伤活性的靶细胞,按照效靶比20∶1设杀伤实验孔,同时设有靶细胞自然释放孔和最大释放孔,每孔均设3个复孔。于CO2培养箱中共培养24 h后,收集细胞上清液,加入LDH试剂,待反应完全后,检测490 nm处的吸光度(A)值[1-4]。细胞杀伤活性=(实验释放孔A值-自发释放孔A值)/(最大释放孔A值-自发释放孔A值)×100%。

表1 3种多糖正交实验因素水平分布表Tab.1 Factors and levels of orthogonal test of three kinds of polysaccharides[ρB/(mg·L-1)]
2 结果
2.1 粗多糖的提取率及3种多糖成分水平3种粗多糖GPS、PTM和PLE的提取率分别为8.85%、9.40%和10.5%。3种多糖GPS、PTM 和PLE中总多糖水平分别为62.96%、59.13%和33.86%,糖醛酸水平分别为16.44%、9.37%和4.47%,淀粉水平分别为7.26%、2.80%和3.77%。
2.2 3种多糖的红外图谱分析3种多糖的红外图谱与标准品的图谱吸收峰大体位置相同,在3 500、3 000和1 700 cm-1附近有明显的吸收峰, 3 500 cm-1左右出现的强宽峰为糖O-H伸缩振动的强吸收;3 000 cm-1左右的吸收峰为C-H伸缩振动产生;1 700 cm-1左右的吸收峰为-CHO以及糖醛酸残基上的-COOH的C=O伸缩振动造成,这一区域的吸收峰是糖类的特征吸收峰。见图1~3。
2.3 Fehling实验分析Fehling实验结果显示:样品溶液产生棕红色的氧化亚铜沉淀,表明有多糖存在。
2.4 Molish实验分析Molish实验结果显示:样品溶液分层,在两界面处产生紫色环,表明有多糖的存在。
2.5 3种多糖合剂组方体外间接抗肿瘤正交实验经极差分析,3种多糖在合剂中主次顺序为PTM、GPS和PLE。根据K1、K2和K3确定最优组合为A3B3C3,即3种多糖浓度均为200 mg·L-1时,CTL杀伤活性最高,能有效地抑制小鼠肥大细胞瘤P815细胞的增殖。见表2。
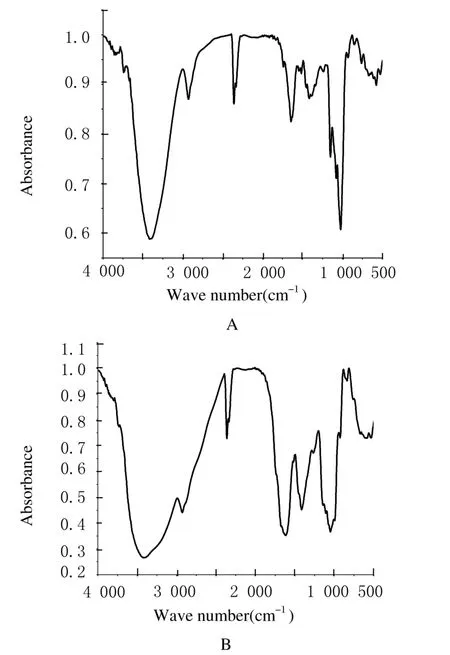
图1 GPS红外光谱图Fig.1 IR chromatogram of GPSA:Extraction of GPS;B:Standard of GPS.

图2 PTM红外光谱图Fig.2 IR chromatogram of PTMA:Extraction of PTM;B:Standard of PTM.

图3 PLE红外光谱图Fig.3 IR chromatogram of PLEA:Extraction of PLE;B:Standards of PLE.

表2 3种多糖合剂组方CTL杀伤活性正交实验结果Tab.2 Results of orthogonal test of CTL cytotoxicities of three kinds of polysaccharides complex
3 讨论
多糖的提取方法有水提取法、酸碱提取法、醇提取法、酶法、微波提取法、超声提取法、超滤法、超临界萃取法和双水相萃取法等,近年来超滤法、双水相萃取法和超临界萃取法等逐渐引起研究者的关注。热水提取法是多糖工业化生产最常用的方法之一,且不需要特殊的设备、简单、方便、无污染、成本低,故本实验采用热水提取法[8]。多糖水平的测定有蒽酮-硫酸法、地衣酚-硫酸法和苯酚-硫酸法等,本实验采用苯酚-硫酸法测定总多糖水平,操作简单,显色稳定[10]。咔唑-硫酸法和间羟基联苯法用于测定糖醛酸水平,与其他方法不同,间羟基联苯法不受共存的中性已糖和戊糖的干扰,简便、快速、灵敏[11-12]。本研究采用国标法检测淀粉水平,Sevage法除蛋白,氧化法脱色素,光谱法和化学法相结合分析鉴定,证实提取物为多糖。
本研究采用LDH法以CTL杀伤活性为指标,以小鼠肥大细胞瘤P815细胞为靶细胞,筛选3种多糖合剂的最佳组合,正交实验结果表明:3种多糖中PTM占主导地位,3种多糖组成的合剂质量配比为1∶1∶1、浓度为600 mg·L-1时,CTL杀伤活性最强,间接抗肿瘤效果最好。
综上所述,GPS、PTM和PLE组成的多糖合剂增强了CTL杀伤活性,对小鼠肥大细胞瘤P815细胞增殖有间接抑制作用。
[1]刘吉成,苏富琴,赵学梅.复合多糖抗肿瘤后增效作用研究[J].中药药理与临床,2006,12(3/4):73-76.
[2]赵锡民.中医药防治肿瘤的研究[J].长春中医药大学学报, 2012,29(1):169-170.
[3]谢好贵,韦明钎,陈美珍,等.复合多糖体外抗肿瘤协同增效作用初步研究[J].食品科学,2013,34(15):1-10.
[4]Zhang X,Yu L,Bi HT,et al.Total fractionation and characterization of the water-soluble polysaccharides isolated from Panax ginseng C.A.Meyer[J].Carbohydrate Polymer,2009,77(3):544-552.
[5]宋利华,萧 伟,鹿丽丽,等.正交试验优选人参多糖的提取工艺[J].中草药,2012,43(2):283-287.
[6]刘 刚,王 辉,郭成希,等.正交实验法优选松茸多糖的提取工艺[J].中国药师,2009,12(7):914-915.
[7]王美珠,曹月坤,韩秋菊.两种方法提取香菇多糖的比较研究[J].氨基酸与生物资源,2012,34(2):51-52.
[8]黄小葳.多糖的非常规提取研究[J].北京联合大学学报, 2011,25(1):59-63.
[9]Ding X,Zhu FS,Gao SG.Purification,antitumour andimmunomodulatory activity of water-extractable and alkaliextractable polysaccharides from Solanum nigrum L[J].Food Chemistry,2012,131(2):677-684.
[10]钟方晓,任海华,李 岩.多糖水平测定方法比较[J].时珍国医国药,2007,18(8):1916-1917.
[11]夏永刚,梁 军,杨炳友,等.麻黄多糖中糖醛酸水平的测定[J].中医药,2011,39(1):71-73.
[12]张惟杰.糖复合物生化研究技术[M].浙江:浙江大学出版社,2006.
[13]于 雷,王保奇,张华峰,等.首乌藤多糖脱色脱蛋白纯化工艺研究[J].中药新药与临床药理,2012,23(2):215-219.
[14]Shang MS,Zhang XM,Dong Q,et al.Isolation and structural characterization of the water-extractable polysaccharides from Cassia obtusifolia seeds[J].Carbohydrate Polymer,2012,90(2):827-832.
[15]周宝珍,肖娅萍,牛俊峰.绞股蓝多糖的分离纯化及红外光谱、气相色谱分析[J].中华中医药杂志,2012,27(1): 97-100.
[16]刘 萍,闫素清,柴保臣,等.四种真菌多糖复合组方的筛选[J].郑州大学学报:医学版,2009,44(2):430-432.
Preparation of polysaccharide complex and its indirect antitumor activity in vitro
YE Ling-yan,REN Ming,LYU Lin,LI Li,QI Yan-fei,LI Juan,XU Kun
(Department of Health Laboratory,School of Public Health,Jilin Univeisity,Ghangchun 130021,China)
ObjectiveTo extract the Ginseng polysaccharide(GPS),polysaccharides of Tricholoma matsutake (PTM)and polysaccharide of Lentinus edodes(PLE)from gingeng,tricholoma matsutake and lentinus edodes respectively,and to analyze and identify their structures,and to prepare their complex,and to study the indirect antitumor activity in vitro of polysaccharide complex.MethodsThe polysaccharides were extracted with hot water and precipitated by ethanol.The carbohydrate levels were determined by the method of phenol-sulfuric acid.The mhydroxyphenyl method was used to determine the levels of uronic acid,and the national standard method was used to determine the levels of starch.Infrared spectroscope and chemical methods were performed to analyze their structures.Orthogonal experiment was used to study mixing methods.Cytotoxic T lymphocyte experiment and LDH release assay were performed to detect the influence of polysaccharide complex of GPS,PTM,and PLE in the CTL killing activity,and its indirect killing effect on the P815 cells.ResultsThe extraction rates of GPS, PTM,and PLE were 8.85%,9.40%,and 10.50%;the levels of total polysaccharides were 62.96%,59.13%, and 33.86%;the levels of uronic acid were 16.44%,9.37%,and 16.44%;the starch levels were 7.26%,2.80%,and 3.77%,respectively.The identification results showed that the polysaccharides were obstrained.When the quality ratio of the three kinds of polysaccharides was 1∶1∶1 and the concentration was 600 mg·L-1, the CTL cytotoxicity was the highest.ConclusionThe polysaccharide complex is obtained,identified and characterized.Polysaccharide complex can enhance the cytotoxicity of CTL and has the indirectly inhibitory effect on the proliferation of P815 cells.
Ginseng polysaccharide;polysaccharides of Tricholoma matsutake;polysaccharide of Lentinus edodes; polysaccharide complex;antitumor activity
R273
A
2014-01-25
吉林省科技厅科研基金资助课题(20130522056JH);吉林省科技厅医药产业发展专项资金项目资助课题(yyzx201123-2)
叶伶艳(1989-),女,河北省唐山市人,在读医学硕士,主要从事多糖合剂保健品的抗肿瘤作用研究。
李 娟(Tel:0431-85645486,E-mail:li_juan@jlu.edu.cn); 徐 坤(Tel:0431-85619455,E-mail:xukun@jlu.edu.cn)
1671-587Ⅹ(2014)05-1033-05
10.13481/j.1671-587x.20140525
