电离辐射对转染pcDNA3.1-Egr-1-AIF△1-480质粒的MCF-7细胞增殖和侵袭能力的影响
2014-06-27齐亚莉刘洪彬谢忠伟刘彦军王剑锋
齐亚莉,刘洪彬,谢忠伟,刘彦军,王剑锋
(1.北华大学公共卫生学院流行病学教研室,吉林吉林 132011;2.吉林大学公共卫生学院卫生部放射生物学重点实验室,吉林长春 130021;3.吉林省吉林(市)出入境检验检疫局,吉林吉林 132013; 4.吉林省长春市人民医院放疗科,吉林长春 130051;5.吉林大学中日联谊医院放疗科,吉林长春 130033)
电离辐射对转染pcDNA3.1-Egr-1-AIF△1-480质粒的MCF-7细胞增殖和侵袭能力的影响
齐亚莉1,2,刘洪彬3,谢忠伟3,刘彦军4,王剑锋2,5
(1.北华大学公共卫生学院流行病学教研室,吉林吉林 132011;2.吉林大学公共卫生学院卫生部放射生物学重点实验室,吉林长春 130021;3.吉林省吉林(市)出入境检验检疫局,吉林吉林 132013; 4.吉林省长春市人民医院放疗科,吉林长春 130051;5.吉林大学中日联谊医院放疗科,吉林长春 130033)
目的:探讨辐射增强靶向截短型凋亡诱导因子(AIFΔ1-480)对MCF-7细胞增殖和侵袭能力的影响,阐明其提高肿瘤基因-放射治疗的可能性。方法:人乳腺癌MCF-7细胞经质粒转染早期生长反应1(Egr-1)介导的AIFΔ1-480重组表达载体pcDNA3.1-Egr-1-AIFΔ1-480(p E-AIFΔ1-480),2 Gy X射线照射后24 h,分别采用MTT法和Transwell侵袭实验检测细胞增殖和侵袭能力。实验分为正常对照组、pcDNA3.1组(只转染pcDNA3.1质粒)、p E-AIFΔ1-480组(转染p E-AIFΔ1-480质粒)、2 Gy X线照射组和p E-AIFΔ1-480+2 Gy X线照射组。结果:质粒转染并经2 Gy X线照射后,正常对照组、pcDNA3.1组和p E-AIFΔ1-480质粒组细胞生长较快,且增殖规律基本一致。与正常对照组比较,2 Gy X线照射组和pE-AIFΔ1-480+2 Gy X线照射组细胞增殖能力显著降低(P<0.05),且以p E-AIFΔ1-480+2 Gy X线照射组降低更明显,从12 h开始较2 Gy X线照射组明显降低(P<0.05)。正常对照组、pcDNA3.1组和p E-AIFΔ1-480组穿过基底膜细胞数基本一致,而2 Gy X线照射组和p E-AIFΔ1-480+2 Gy照射组穿过基底膜细胞较正常对照组明显减少(P<0.05或P<0.01),并且p E-AIFΔ1-480+2 Gy照射组穿过基底膜的细胞数较2 Gy照射组减少更明显(P<0.01)。结论:AIFΔ1-480和电离辐射均能抑制人乳腺癌MCF-7细胞增殖和侵袭,二者具有协同作用,并且Egr-1启动子能增强辐射条件下的抑制效果。
早期生长反应1;截短型凋亡诱导因子;细胞增殖;侵袭;电离辐射
自从Kufe等[1]和Weichselbaum等[2]提出以辐射敏感早期生长反应1(early growth response 1, Egr-1)基因启动子介导目的基因,进而对肿瘤细胞起到杀伤作用以来,肿瘤基因-放射治疗取得了长足进步。该理念是将辐射诱导性的调控序列与肿瘤杀伤基因相偶联后,再给予肿瘤局部放疗以诱导肿瘤杀伤基因表达,使辐射与杀伤基因表达产物协同抑瘤,同时也利用辐射的定位作用和可操控性,实现了对杀伤基因表达的时空调控[3-4]。肿瘤杀伤基因包括癌基因、抑癌基因和凋亡诱导基因等,如何选择非常关键。凋亡诱导因子(apoptosis inducing factor,AIF)是1996年发现的一种线粒体相关分子,其478~610位置氨基酸为C末端,具有凋亡诱导活性[5]。已有研究[5-6]表明:截短型AIF因为存在C末端,仍保留促凋亡活性,并且其编码480~613氨基酸的蛋白质具有相对分子质量小和更利于应用于临床的特点。本实验构建正确的含Egr-1的人截短型AIFΔ1-480重组表达载体并转染MCF-7细胞,联合X线照射,观察细胞增殖和侵袭的变化,为肿瘤基因-放射治疗提供新的理论基础和实验数据。
1 材料与方法
1.1 细胞、主要试剂和仪器人乳腺癌MCF-7细胞株和NIH/3T3细胞由吉林大学公共卫生学院卫生部放射生物学重点实验室保存。胎牛血清、高糖DMEM培养基和RPMI 1640(Gibco公司,美国), LipofectamineTM2000(Invitrogen公司,美国),噻唑蓝(methyl thiazolyl tetrazolium,MTT;Sigma公司,美国),吉姆萨染液(Applichem公司,德国),其他生化试剂为国产分析纯。低温高速离心机(Tomy公司,日本),Transwell小室(Pierce公司,美国),酶标仪(Bio-Rad公司,美国), X.S.S.205(FZ)型深部X线治疗机(国产)。
1.2 pc DNA3.1-Egr-1-AIFΔ1-480转染和X线照射pcDNA3.1-Egr1-AIFΔ1-480质粒已构建完成,并且AIFΔ1-480蛋白具有一定的辐射诱导表达规律[7]。质粒大量提取后,使用脂质体LipofectamineTM2000作为转染试剂进行瞬时转染,详细步骤按照说明书操作。按1×105m L-1接种于24孔细胞培养板中。24 h后当细胞密度达到80%~90%融合时进行转染,质粒与脂质体均采用无血清、无抗生素DMEM稀释,终浓度分别为1.0和2.5 g·50 L-1,质粒与脂质体比例为1∶2.5进行转染,转染后置于37℃、5%CO2细胞培养箱中孵育,6 h后换正常培养基继续培养,并进行2 Gy X线照射,照射条件为靶皮距50 cm,滤板0.5 mm Cu和1.0 mm Al,剂量率0.287 Gy·min-1。
1.3 实验分组MCF-7细胞分为正常对照组、pcDNA3.1组(只转染pcDNA3.1质粒)、p E-AIFΔ1-480组(转染p E-AIFΔ1-480质粒)、2 Gy X线照射组和p E-AIFΔ1-480+2 Gy X线照射组。
1.4 MTT法检测细胞增殖能力各组MCF-7细胞按照6×104m L-1接种于96孔板,每孔100μL,每块板设为1个时间点,共5个时间点。24 h后用脂质体进行转染,转染后进行2 Gy X线照射,分别于照射后0、4、12、24和48 h取出一块板,加入浓度为5 g·L-1的MTT溶液10μL,置于CO2孵箱中继续孵育4 h;终止培养后,除去孔内上清液,向每孔内加入100μL DMSO,振荡处理,保证结晶充分溶解;在酶标仪上于490 nm波长测定各孔吸光度(A490)值,以此表示细胞增殖能力[8-9], A值越大,细胞增殖能力越强。各组设6复孔。
1.5 细胞侵袭能力检测①条件培养液的制备: NIH/3T3细胞培养于含有10%胎牛血清的RPMI 1640培养基中,待细胞达到80%~90%融合时,用无血清的培养基洗3次。加入新鲜无血清培养基,于37℃、5%CO2培养箱培养36~48 h。用0.22μm孔径的滤器过滤收集到的培养基上清液,即得到含趋化因子的条件培养基,冻存于-70℃中备用。②Transwell侵袭实验:按照Matrigel胶∶无血清培养基=1∶3的比例稀释并混匀,Transwell小室的上室聚碳酸酯膜上加入80μL Matrigel胶稀释液,于37℃条件下聚合30 min。将接种于6孔板的人乳腺癌MCF-7细胞经过转染换液,2 Gy X线照射24 h后,采用0.25%胰酶消化,PBS漂洗,使用台盼蓝染色并计数活细胞数,无血清的培养基调整细胞浓度至1.0×106m L-1。将NIH/3T3条件培养液加入24孔板内,每孔200μL,将制备好的Transwell小室置入孔中,上室可加入100μL细胞悬液,使细胞数达到1.0×105个/孔,置于37℃、5%CO2条件下培养18 h。去除上室中的培养液,并用棉签蘸生理盐水轻轻擦去Matrigel胶,采用0.1%结晶紫染色后,使用倒置显微镜观察,于400倍视野下任取5个不重复视野照相,并记录穿膜细胞数量。
1.6 统计学分析采用SPSS 12.0软件进行统计学处理。各组细胞A490值及穿膜细胞数以±s表示,两两比较采用Student’s t检验。
2 结果
2.1 各组人乳腺癌MCF-7细胞的增殖能力正常对照组、pcDNA3.1组和p E-AIFΔ1-480组细胞生长较快,其中12、24和48 h与0 h比较差异有统计学意义(P<0.05),并且增殖规律基本一致。而2 Gy照射组和p E-AIFΔ1-480+2 Gy照射组细胞增殖受抑,且以p E-AIFΔ1-480+2 Gy组受抑更明显。从12 h开始,p E-AIFΔ1-480+2 Gy照射组较2 Gy照射组细胞增殖能力显著降低(P<0.05)。见表1。
表1 各组MCF-7细胞转染和照射后的A490值Tab.1 A490values of MCF-7 cells after transfection and irradiation in various groups(n=6,±s)
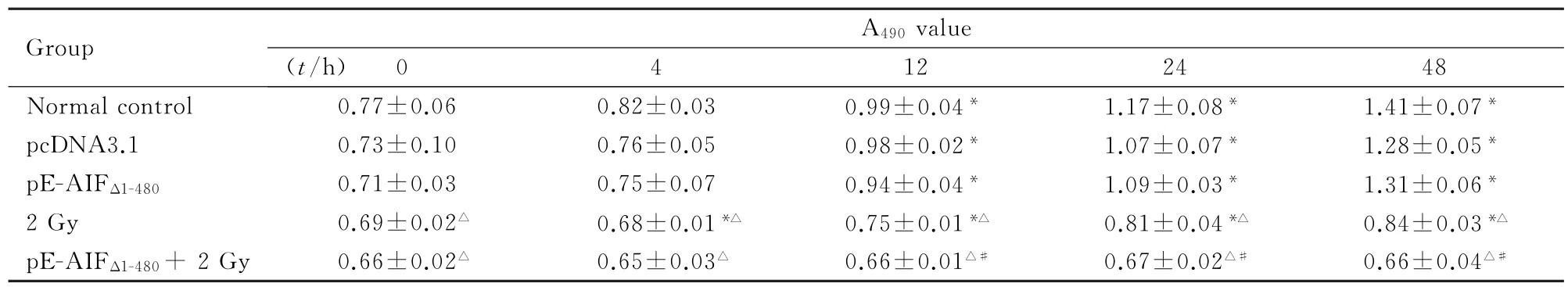
表1 各组MCF-7细胞转染和照射后的A490值Tab.1 A490values of MCF-7 cells after transfection and irradiation in various groups(n=6,±s)
∗P<0.05 vs 0 h;△P<0.05 vs normal control group;#P<0.05 vs 2 Gy group.
Group A490value (t/h) 0 4 12 24 48 Normal control 0.77±0.06 0.82±0.03 0.99±0.04∗1.17±0.08∗1.41±0.07∗pcDNA3.1 0.73±0.10 0.76±0.05 0.98±0.02∗1.07±0.07∗1.28±0.05∗pE-AIFΔ1-4800.71±0.03 0.75±0.07 0.94±0.04∗1.09±0.03∗1.31±0.06∗2 Gy 0.69±0.02△0.68±0.01∗△0.75±0.01∗△0.81±0.04∗△0.84±0.03∗△p E-AIFΔ1-480+2 Gy 0.66±0.02△0.65±0.03△0.66±0.01△#0.67±0.02△#0.66±0.04△#
2.2 各组人乳腺癌MCF-7细胞的侵袭能力正常对照组、pcDNA3.1组和pcDNA3.1-Egr-1-AIFΔ1-480组穿过基底膜细胞数基本一致,而2 Gy照射组和pc DNA3.1-Egr-1-AIFΔ1-480+2 Gy照射组穿过基底膜细胞较正常对照组明显减少(P<0.05或P<0.01);并且pcDNA3.1-Egr-1-AIFΔ1-480+2 Gy照射组穿过基底膜细胞数较2 Gy照射组减少更显著(P<0.01)。见表2和图1(插页一)。vs 2 Gy group.
表2 各组MCF-7细胞的侵袭能力Tab.2 Invasion abilities of MCF-7 cells in virous groups (n=3,±s)
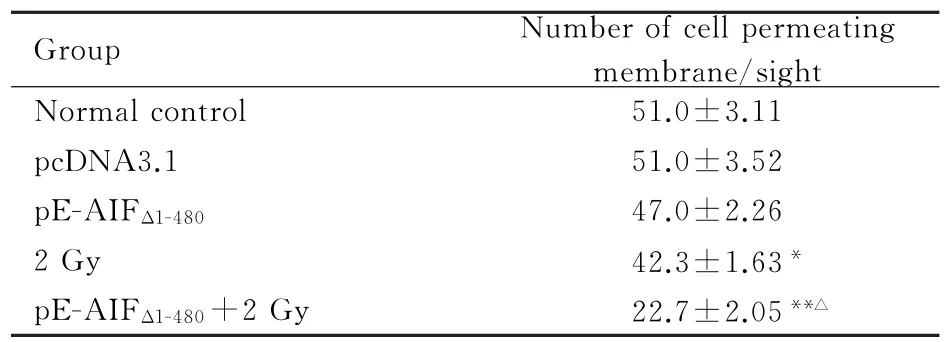
表2 各组MCF-7细胞的侵袭能力Tab.2 Invasion abilities of MCF-7 cells in virous groups (n=3,±s)
∗P<0.05,∗∗P<0.01 vs normal control group;△P<0.01
Group Number of cell permeating membrane/sight Normal control 51.0±3.11 pcDNA3.1 51.0±3.52 p E-AIFΔ1-48047.0±2.26 2 Gy 42.3±1.63∗p E-AIFΔ1-480+2 Gy 22.7±2.05∗∗△
3 讨 论
肿瘤细胞增殖能力较强,侵袭和转移是恶性肿瘤细胞的重要特性,利用这2个指标可以判定肿瘤细胞被杀伤效果。本实验采用MTT法和Transwell小室检测乳腺癌细胞增殖能力和侵袭能力结果显示:正常对照组、pcDNA3.1组和p E-AIFΔ1-480组细胞增殖和穿膜能力基本一致,这说明无电离辐射的条件下,Egr-1启动子无明显效应;2 Gy照射组和pE-AIFΔ1-480+2 Gy照射组细胞增殖能力和穿膜能力均显著降低,并且以p E-AIFΔ1-480+2 Gy照射组降低更明显,这说明单纯转染p E-AIFΔ1-480质粒并不能诱导蛋白表达,不能导致细胞增殖能力和穿膜细胞数降低,而联合2 Gy照射后则能够增强照射导致的细胞增殖抑制和细胞穿膜能力的降低,细胞基本处于停止状态,细胞穿过基底膜数量减少更明显。上述结果表明:截短型AIFΔ1-480的表达可以抑制肿瘤细胞的增殖和侵袭,电离辐射也可以抑制肿瘤细胞的增殖和侵袭,当截短型AIFΔ1-480与辐射联合应用时,能发挥协同作用,对肿瘤细胞增殖和侵袭的抑制更加明显,且辐射可以诱导Egr-1启动子激活并增强截短型AIFΔ1-480的表达,从而达到最佳的抑制效果。
本研究结果与肿瘤基因-放射治疗的理念非常吻合,既发挥基因治疗的作用,又发挥电离辐射的作用,二者协同,使治疗效果最优化。肿瘤基因-放射治疗是同时将具有辐射诱导特性和肿瘤杀伤的基因转入肿瘤细胞,一方面通过放疗杀伤肿瘤细胞,另一方面通过辐射作用诱导肿瘤杀伤基因表达,产生电离辐射和基因对肿瘤细胞的协同作用[10-11]。自从Weichselbaum等[2-3]提出这一理念以来,关于Egr-1基因启动子的研究已经取得很大的进展,其辐射的定位作用和可操控性实现了对杀伤基因表达的时空调控。AIF是1996年发现的一种凋亡效应分子[5],AIF基因定位于人类Xq25-26,AIF晶体结构研究揭示成熟AIF由3部分构成:具有1个FAD结合结构域(122~262和400~477位氨基酸)、1个NADH结合结构域(263~399位氨基酸)和1个C末端结构域(478~610位氨基酸),其C末端结构域可能与AIF的促凋亡活性有关[12]。本实验结果显示:截短型AIF可以诱导MCF-7细胞凋亡,而且可以抑制肿瘤细胞的增殖和侵袭,这与已有文献[13]报道的结果基本一致。本实验结果为利用截短型AIF进行肿瘤基因-放射治疗提供了实验数据,为乳腺癌的临床放疗提供了新的参考。
[1]Kufe D,Weichselbaum R.Radiation therapy:activation for gene transcription and the development of genetic radiotherapy-therapeutic strategies in oncology[J].Cancer Biol Ther,2003,2(4):326-329.
[2]Weichselbaum RR,Kufe D.Translation of the radio-and chemo-inducible TNFerade vector to the treatment of human cancers[J].Cancer Gene Ther,2009,16(8):609-619.
[3]Li YB,Guo CX,Wang ZC,et al.Radiosensitization of breast cancer cells by TRAIL-endostatin-targeting gene therapy[J].Neoplasma,2013,60(6):613-619.
[4]Manente AG,Pinton G,Tavian D,et al.Coordinated sumoylation and ubiquitination modulate EGF induced EGR1 expression and stability[J].PLoS One,2011,6(10): e25676.
[5]张 巍,张 勇,韩 涛,等.截短型人凋亡诱导因子AIF1-400对He La细胞的促凋亡作用[J].细胞与分子免疫学杂志,2007,23(10):973-975.
[6]于翠娟,孟艳玲,桂俊豪,等.重组人凋亡诱导因子基因的构建、表达及对HeLa细胞的促凋亡作用[J].生物化学与生物物理学进展,2002,29(6):915-921.
[7]王剑锋,方 芳,刘 扬,等.Egr1介导的人截短型凋亡诱导因子表达载体的构建及其在乳腺癌MCF-7细胞中的辐射诱导表达规律[J].吉林大学学报:医学版,2012,38(3): 521-527.
[8]Liu WW,Liu Y,Liang S,et al.Hypoxia-and radiationinduced overexpression of Smac by an adenoviral vector and its effects on cell cycle and apoptosis in MDA-MB-231 human breast cancer cells[J].Exp Ther Med,2013,6(6):1560-1564.
[9]Li Y,Guo C,Wang Z,et al.Enhanced effects of TRAIL-endostatin-based double-gene-radiotherapy on suppressing growth,promoting apoptosis and inducing cell cycle arrest in vascular endothelial cells[J].J Huazhong Univ Sci Technol Med Sci,2012,32(2):167-172.
[10]Lumniczky K,Sáfrány G.Cancer gene therapy:combination with radiation therapy and the role of bystander cell killing in the anti-tumor effect[J].Pathol Oncol Res,2006,12(2): 118-124.
[11]Zheng AQ,Song XR,Yu JM,et al.Liposome transfected to plasmid-encoding endostatin gene combined with radiotherapy inhibits liver cancer growth in nude mice[J].World J Gastroenterol,2005,11(28):4439-4442.
[12]Maria JM,Miguel OL,Brigette B,et al.The crystal structure of themouse apoptosis-inducing factor AIF[J].Nature,2002,96(6):442-446.
[13]刘湘丽,于翠娟,许彦鸣,等.人截短型凋亡诱导因子AIF△1-480的表达对He La细胞的促凋亡作用[J].第四军医大学学报,2005,26(6):484-487.
Effects of ionizing radiation on proliferation and invasion of MCF-7 cells transfected with pcDNA3.1-Egr-1-AIF△1-480plasmid
QI Ya-li1,2,LIU Hong-bin3,XIE Zhong-wei3,LIU Yan-jun4,WANG Jian-feng2,5
(1.Department of Epidemiology,School of Public Health,Beihua University,Jilin 132001,China; 2.Key Laboratory of Radiobiology,Ministry of Health,School of Public Health,Jilin University, Changchun 130021,China;3.Jilin Province Jilin(City)Entry and Exit Inspection and Quarantine Bureau, Jilin 132013,China;4.Department of Radiotherapy,People’s Hospital,Changchun City,Changchun 130051,China;5.Department of Radiotherapy,China-Japan Union Hospital, Jilin University,Changchun 130033,China)
ObjectiveTo investigate the influence of truncated apoptosis inducing factor(AIFΔ1-480)on theproliferation and invasion of MCF-7 cells,and to clarify the possibility of promoting cancer gene-radiotherapy. Methods The human breast cancer MCF-7 cells were transfected with AIFΔ1-480recombinant expression vector pcDNA3.1-Egr-1-AIFΔ1-480(pE-AIFΔ1-480)mediated by Egr-1;24 h after 2 Gy X-ray irradiation,MTT assay and Transwell invasion assay were performed to measure the changes of cell proliferation and invasion.The MCF-7 cells were diveded into normal control,pcDNA3.1,p E-AIFΔ1-480,2 Gy irradiation and pE-AIFΔ1-480+2 Gy irradiation groups.ResultsAfter transfection and 2 Gy X-ray irradiation,the cells proliferated very fast in normal control, pcDNA3.1 and p E-AIFΔ1-480groups,and the proliferation regularity was similar.Compared with normal control group,the cell proliferation abilities were significantly decreased in 2 Gy irradiation and p E-AIFΔ1-480+2 Gy irradiation groups(P<0.05),and it was more obvious in p E-AIFΔ1-480+2 Gy irradiation group,and it was significant lower than that in 2 Gy irradiation group(P<0.05).The number of the cells permeating membrane was basically same in normal control,pcDNA3.1 and p E-AIFΔ1-480groups;compared with normal control group,they were significantly decreased in 2 Gy irradiation and p E-AIFΔ1-480+2 Gy irradiation groups(P<0.05 or P<0.01); and it was more significant in pE-AIFΔ1-480+2 Gy irradiation group than that in 2 Gy irradiation group(P<0.01).ConclusionAIFΔ1-480and ionizing radiation could inhibit the proliferation and invasion of human breast cancer MCF-7 cells,both of them have a synergistic effect,and Egr-1 promoter can enhance the suppression effect under radiation conditions.
Egr-1;truncated apoptosis inducing factor;cell proliferation;invasion;ionizing radiation
R737.9
A
2013-11-30
国家自然科学基金资助课题(30970681);吉林省教育厅“十二五”科学技术研究项目资助课题(2014-192)
齐亚莉(1973-),女,吉林省四平市人,副教授,医学博士,主要从事艾滋病和肿瘤放射治疗的流行病学研究。
王剑锋(Tel:0431-85619443,E-mail:jfwang@jlu.edu.cn)
1671-587Ⅹ(2014)05-0929-04
10.13481/j.1671-587x.20140504
