一步重组法构建产龙胆苦苷酵母重组菌的研究
2014-06-27钱卫东赵德志付云芳陈雪峰毛培宏周颖欣谢海艳
钱卫东, 赵德志, 付云芳,陈雪峰, 毛培宏,周颖欣, 常 凯, 谢海艳
(1.陕西科技大学 生命科学与工程学院, 陕西 西安 710021; 2.新疆大学 物理科学与技术学院 离子束生物技术中心, 新疆 乌鲁木齐 830046)
0 引言
龙胆苦苷(Gentiopicroside),别名龙胆苦甙,分子式为C16H20O9,分子量为356.11,为裂环环烯萜苷类化合物,属于倍半萜类物质,是药用植物秦艽(Gentianamacrophylla)的主要药用成分[1].近年来的研究表明,龙胆苦苷具有镇痛、抗炎、抗菌、抗病毒、抗氧化、保肝利胆、健胃抗溃疡等作用,如作为国家一类新药注射用秦龙苦素,为秦艽提取物龙胆苦苷的冻干粉针,用于黄疸型病毒性肝炎的治疗[2-4].随着人们对龙胆苦苷药用价值的肯定,开发和生产以龙胆苦苷为原料的药品越来越多,使得临床上对龙胆苦苷的需求量日益增加.
龙胆苦苷多来源于龙胆科多年生草本植物秦艽.值得注意的是,秦艽药材由于使用范围不断扩大,市场需求量逐年增加,致使野生资源急剧下降,已被列入国家三级保护野生药材[5].又因为秦艽存在适生地窄、栽培困难、生长周期长等问题,造成目前市场上秦艽资源短缺,供需矛盾非常突出.
与国外相比而言,国内近年来对龙胆苦苷来源的研究相对较多.Tiwari和Zhang 等运用发根农杆菌(Agrobaeteriumrhizogenes)诱导出秦艽毛状根,但未筛选出产龙胆苦苷的毛状根[6-7].齐香君等运用秦艽悬浮细胞培养生产龙胆苦苷,产量仅为0.242 mg/g[8].上述结果表明,利用毛状根或悬浮细胞培养技术生产龙胆苦苷目前都未能获得理想的结果.
因此,研究和开发秦艽新资源、解决龙胆苦苷来源短缺问题亟需寻求其它药源途径和新的研究方法.近年来,代谢工程因其在寻求新型药源和药源种质改良方面具有独特优势,已经逐渐成为当今国际生药学界的研究热点之一[9-12].
目前,关于秦艽药用成分龙胆苦苷的生物合成相关基因的研究报道较少.赵鹏等分离克隆了3-羟基-3-甲基戊二酰辅酶A 还原酶(3-hydroxy-3-methylglutaryl-CoAreductase,HMGR)基因家族的两条基因和G10H 基因家族的一条基因,但其仅对HMGR和G10H 基因进行了序列分析,而没有利用基因敲除/遗传互补方法在体内进行功能鉴定.在龙胆苦苷生物合成基因尚未阐明前,亟需寻求新思路构建产天然产物工程菌.近年来,由我国学者自主开发的离子束介导药用植物基因组总DNA转化微生物、构建产药用植物天然药用成分重组菌株的技术,为利用微生物合成龙胆苦苷提供了技术支持[13,14].
1 材料和方法
1.1 菌种
多形汉逊酵母(HansenulapolymorphaH.polymorpha) DL-1菌株(来源为ATCC No.26012).
1.2 培养基
(1)YPD固体培养基(g/L):葡萄糖20 g,酵母膏10 g,蛋白胨20 g,琼脂粉15 g,pH 6.5.
(2)种子液培养基(g/L) :葡萄糖20 g,蛋白胨20 g,酵母膏10 g,pH 6.5.
(3)发酵培养基(g/L): 丙三醇15 g,(NH4)2SO415 g,K2HPO40.24 g,MgSO4·7H2O 1.8 g,CaCl20.28 g,NaCl 0.6 g,NaNO30.58 g,FeCl3SO4·6H2O 0.006 g,硫胺素盐酸盐0.004 g,微量元素母液1 mL.
其中,微量元素母液(mg/L):Na2MoO4·2H2O 484 mg,MnSO4·H2O 176 mg,KI 207.5,CuSO4·5H2O 40 mg,ZnSO4·7H2O 40 mg,pH为6.5.
1.3 主要试剂和仪器
龙胆苦苷标准品(美国Sigma公司);酵母浸粉、蛋白胨、葡萄糖、琼脂粉、CMC-Na、硅胶GF254、香草醛、醋酸锂等(天津市科密欧化学试剂有限公司);Tris-Hcl、十二烷基硫酸钠(SDS) 、EDTA 、Tris饱和酚等(拜尔迪公司).
台式冷冻离心机(Sigma);高效液相色谱仪(美国Waters);Ddevic 1多功能离子注入机(IBB).
1.4 试验方法
1.4.1 秦艽的基因组DNA的提取
秦艽新鲜叶片采自陕西省太白县秦艽种植基地.取其新鲜叶片约5 g置于研钵中,用液氮冷冻研磨至粉末,加入3.5 mL、2%(质量分数)、65 ℃预热的CTAB抽提缓冲液,轻轻摇匀后分装在1.5 mL EP管中(约1 mL/管),置于65 ℃的水浴锅中温育,每隔10 min轻摇一次,温育40 min.取出后,冷却2 min,加入0.5 mL氯仿-异戊醇(24∶1,v/v),漩涡振荡2 min,然后,10,000 r/min离心10 min,将上清液转移至装有600μL异丙醇的EP管中,将离心管上下轻轻摇动30 s,使异丙醇与水层充分混合.
10,000 r/min离心2 min后,去掉上清液,自然风干,然后加入720μL的75%乙醇及80μL 5 mol/L的醋酸钠,轻轻摇匀;10,000 r/min离心1 min后,倒掉上清液,加入800μL 75%(体积分数)的乙醇,轻轻摇匀后,10,000 r/min离心30 s后,倒掉上清液,将离心管自然风干;再加入50μL 0.5×TE(含RNase)缓冲液,使DNA溶解,置于37 ℃恒温箱约15 h.置于-20 ℃保存、备用.
1.4.2 酵母菌膜的制备
取酵母菌母液100μL转接到装有2 mL YPD液体培养基的试管中,37 ℃,110 r/min培养16~18 h,取菌体用保护液(葡萄糖0.5%+可溶性淀粉0.5%)稀释,采用血球计数板计数法确定稀释倍数,稀释至细胞浓度为1.0×106CFU/mL,并取0.1 mL菌体稀释液将其均匀涂布于直径90 mm的无菌平皿中央,用无菌风吹干制成菌膜.
1.4.3 最佳离子注入能量和剂量的探索
根据试验需要,设置不同的离子注入能量与剂量的组合,进行多次重复试验,探索最佳的离子注入参数,参数设计为:能量分别是a:30 keV;b:25 keV;c:20 keV,注入剂量(ions/cm2)如表1所示.
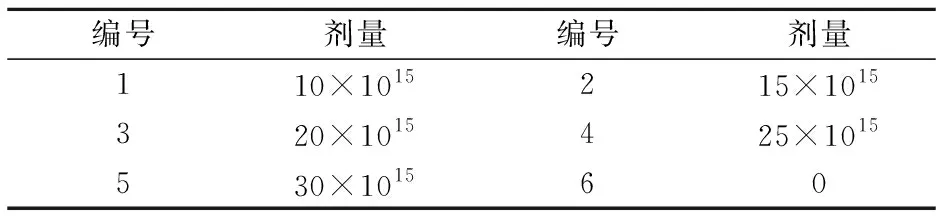
表1 试验中N+注入剂量
将菌膜平皿置于离子注入机真空靶室中央进行N+注入,按照a、b、c的能量和表1中的低能离子注入剂量注入.注入结束后,立即将2 mL不含基因组的TE溶液迅速倒入注入过的菌膜平皿中,置于 37 ℃恒温箱中温育2 h;然后用无菌刮铲将菌全部刮下,取0.1 mL菌液均匀涂布于YPD固体培养基上,37 ℃恒温培养18 h.对照菌株做同样处理,计算存活率.以低能注入剂量为横坐标,存活率为纵坐标,制备注入曲线,获得最佳的离子注入能量和剂量.
1.4.4 构建产龙胆苦苷工程菌株
(1)低能离子注入酵母
利用上述获得的最佳低能离子注入能量和剂量进行注入.注入完毕后,立即将2 mL含有秦艽基因组的TE溶液迅速加入经低能离子注入过的菌膜平皿中,经TE浸泡、温育、涂固体培养基,在 37 ℃恒温培养18 h.取出放入4 ℃冰箱,以备初筛.
(2)重组菌株的初筛
将YPD培养基上生长的单菌落接入装有5 mL YPD液体培养基的试管中,放入37 ℃,160 r/min摇床上培养90 h得发酵液,将发酵液7,000 r/min离心15 min,收集上清液用于发酵产物检测.由于龙胆苦苷是环烯醚萜苷类物质,因此,主要采用Molish反应、香草醛反应.其操作步骤如下:
①Molish反应.100 ℃下浓缩发酵液后,加入甲醇10 mL,过滤.取滤液3 mL放入干净试管中,加入两滴Molish试剂(10%的α-萘酚醇溶液)摇匀,然后沿试管壁缓慢加入约1 mL浓硫酸,静置,观察两层液面交界处的颜色变化.
②香草醛反应.取样品浓缩液1 mL加入试管中,再加入0.5 mL、5%(质量分数)的香草醛浓硫酸溶液,65 ℃水浴2 min,观察溶液颜色变化.
(3)重组菌株的复筛
将初筛所得菌株接种于装有200 mL YPD液体培养基的500 mL三角瓶中,37 ℃,160 r/min,恒温培养90 h后,7,000 r/min离心15 min,收集上清液80 ℃浓缩至40 mL,加入20 mL预冷丙酮萃取,萃取3次,将收集的萃取液用旋转蒸发仪在40 ℃下蒸干,然后加入5 mL甲醇溶解,获得样品溶液,用薄层层析法和高效液相色谱法对产物进行定性和定量分析.
①薄层层析法(TLC)定性检测.将薄层层析用GF254硅胶板放入干燥箱,105 ℃活化30 min.用微量进样器点样,在展开剂氯仿-甲醇(4∶1v/v)中展开,结束后挥发干展开剂,在紫外灯下观察,记录斑点,并计算其Rf值.
②高效液相色谱法(HPLC)定量检测.色谱条件:色谱柱,Diamonsil C18柱(4.6 ×250 mm,5μm);流动相,乙腈:水(40∶60,V/V);紫外检测器,Waters 2487;检测波长,274 nm;进样量,20μL;流速,1.0 mL/min;柱温,25 ℃.
1.4.5 遗传稳定性试验
将重组菌株依次划线传代培养8代,将各代菌株活化后,接种于装有200 mL YPD培养基的500 mL三角瓶中进行摇瓶培养,160 r/min ,37 ℃,恒温培养90 h后,经离心、浓缩、萃取、蒸发、溶解,制备样品溶液.对样品溶液经过HPLC进行定量检测,比较产量.
2 结果与讨论
2.1 最佳低能离子注入能量和剂量
分别在a、b、c三种能量下,按照表1中的N+注入剂量进行注入.注入后,立即在每个平皿中加入2 mL不含秦艽DNA的TE溶液,37 ℃温育2 h,用无菌刮铲刮下薄膜后,经平板培养18 h计算存活率,其结果如表2所示.
试验a各组经平板培养后,除空白对照组外,都未长出菌落;试验b平面培养后,除对照组菌落过多之外,其余各组菌落数均有不同程度地减少,且出现随着剂量的增加菌落数呈现先增加后减少的现象;试验c经平面培养后,出现各组菌落数均有一定程度减少,但减少幅度较小.
产生上述结果的主要原因是:试验a是由于能量过大在对DNA产生更大伤害的同时,对细胞壁及细胞质的刻蚀过于严重,产生不可逆的损伤,导致细胞死亡.
试验b当以能量为25 keV剂量较低时,注入N+只对细胞表面进行损伤和刻蚀,损伤程度低,易于修复,因此,存活率较高.随着注入剂量的增加,细胞表面刻蚀严重,离子损伤及细胞内部产生大量自由基和软射线等,致使存活率急剧下降;当注入剂量达到20×1015ions/cm2时,存活率下降到最低.随着注入剂量的增加,可能激活细胞内某个修复机制,导致存活率有小幅度回升,之后随着离子注入剂量的增加存活率再一次下降(如图1所示),这一结论与毛培宏提出的离子注入与生物体的相互作用机理[15]一致.
试验c由于能量低,离子对细胞表面损伤和刻蚀程度较轻,经过细胞的自我修复,存活率随着剂量的增加虽有一定程度地降低,但幅度较小.
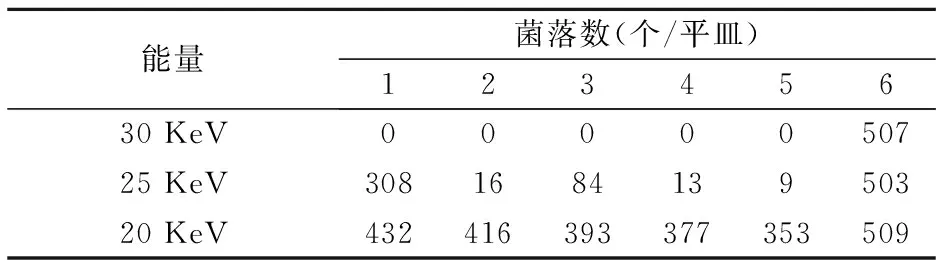
表2 菌落存活数
经过上述试验确定,N+注入技术转化H.polymorphaDL-1的最佳条件为:低能离子注入能量,25 keV;剂量,25×1015ions/cm2.10-3真空条件下,脉冲注入10 s,间隔10 s.
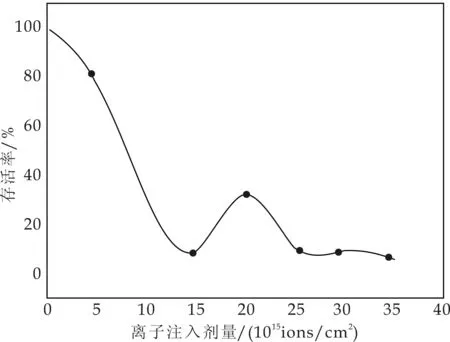
图1 低能N+注入多形汉逊酵母的存活率曲线
2.2 初筛结果分析
在能量25 keV、注入剂量25×1015ions/cm2、10-3Pa真空条件下,注入后,加入2 mL含秦艽基因组的TE溶液浸泡.37 ℃温育2 h,将刮下来的菌液接种到YPD固体培养基中,37 ℃恒温培养18 h,取单菌落活化后接种到100 mL YPD液体培养基中进行发酵培养,对发酵产物采用Molish反应、香草醛反应.
结果显示:在2,000多株备选菌株中,有313株的发酵液在Molish反应中有紫环产生;有173株的发酵液在香草醛反应中试管底部出现棕色或红色;同时在两种颜色反应中均有相应颜色出现的仅有54株.在真空条件下未经离子注入的酵母菌在导入秦艽基因组DNA的处理中,未获得糖苷类或环烯醚萜类物质阳性反应的菌株.由此可说明,用低能N+介导将秦艽基因组导入酵母的方法初步认为是可行的,同时也说明了导入外源DNA大分子转化的随机性和重组菌株的遗传多样性.
2.3 复筛结果分析
经过初筛获得了54株备选菌株,通过发酵培养、浓缩等,制备样品溶液.取20 μL各样品溶液在薄层层析展板上点样、风干.在展开剂氯仿-甲醇(4∶1,V/V)中展开,结束后挥发干展开剂,在紫外灯下观察,结果发现一株的发酵液斑点与龙胆苦苷的标准品在同一直线上,其Rf值完全相同,均为0.30(如图2所示),由此可以初步断定,该菌株为目标重组菌.
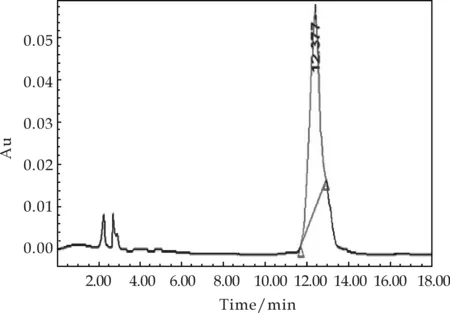
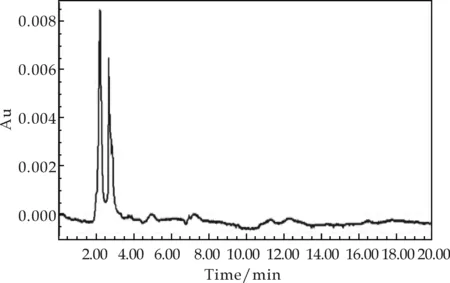
取Rf值一致的样品溶液0.5 mL,用0.45μm微孔滤膜过滤,以20μL的进样量,25 ℃柱温,270 nm波长,1 mL/min流速,进行高效液相色谱(HPLC)分析检测.对出峰时间和峰面积进行记录分析,其结果如图3所示.重组菌株的发酵液在高效液相色谱中的出峰时间为12.377 min,与龙胆苦苷标准品的出峰时间12.370 min基本一致,而出发菌株的发酵液在该位置未出现峰.
由上述试验结果分析,可以确定该重组菌株为目标菌株,即可以发酵生产龙胆苦苷的酵母重组菌株.

1:出发菌株的发酵液;2:龙胆苦苷标准品;3:重组菌株的发酵液图2 菌株发酵液的薄层层析图谱
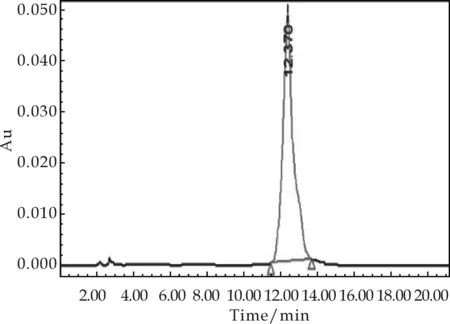
(a) 龙胆苦苷标准品HPLC图谱
(b) 重组菌株发酵液HPLC图谱
(c) 出发菌株发酵液HPLC图谱图3 菌株发酵液的HPLC图谱
2.4 产龙胆苦苷的重组菌株的传代稳定性试验
将复筛筛选出的重组菌株活化后接入5 mL YPD培养基中,培养18 h,用甘油保藏菌种,同时传代培养,斜面传至8代,分别对8代菌株进行活化、发酵培养,对发酵产物进行高效液相色谱分析,比较产量.其结果如表3所示,各代产量略有变化,但整体基本保持不变.这说明该菌株传代稳定性较好.
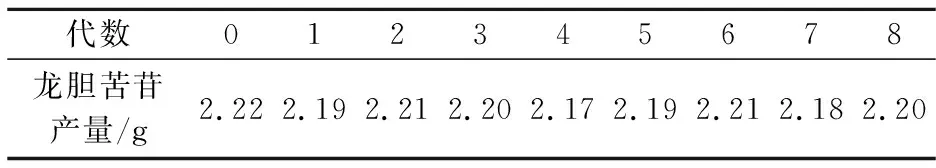
表3 重组菌株的遗传稳定性试验
3 结论
本试验利用低能N+注入对多形汉逊酵母进行直接注入诱变,通过存活率绘制出剂量-效应曲线,即“马鞍型”曲线,获得最佳低能离子注入能量和剂量.利用最佳的低能离子注入能量和剂量注入介导秦艽基因组随机转化酵母,经Molish反应和香草醛反应对转化子进行初筛,接着利用薄层层析法和高效液相色谱法等对初筛获得的候选菌株进行复筛,再结合遗传稳定性试验,获得了1株遗传稳定能生物合成龙胆苦苷的酵母重组菌.
本试验结果表明,利用低能离子注入技术构建产天然产物重组酵母菌株,具有如下优点:即在事先不清楚天然产物生物合成途径及其相关基因或无需克隆相关基因构建重组质粒的情况下,可以实现“一步”构建产天然产物的重组酵母菌,为天然产物新药源的开发提供了新思路、新方法.另外,人们还可以利用“逆向思维”,将获得的产天然产物酵母重组菌作为研究对象,依托操作简便的酵母遗传操作平台,深入研究天然产物的生物合成途径及其相关基因的功能.
[1]姚新生.天然药物化学[M].北京:人民卫生出版社,2005:219-232.
[2]陈 雷,王海波,孙晓丽,等.龙胆苦苷镇痛抗炎药理作用研究[J].天然产物研究与开发,2008,20(5):903-906.
[3]Chen L,Liu J C,Zhang X N,et al.Down-regulation of NR2B receptors partially contributes to analgesic effects of Gentiopicroside in persistent inflammatory pain[J].Neuropharmacology,2008,54(8):1 175-1 181.
[4]Deng Y,Wang L,Yang Y,et al.In vitro inhibition and induction of human liver cytochrome P450 enzymes by gentiopicroside: potent effect on CYP2A6[J].Drug Metab Pharmacokinet,2013,28(4):339-344.
[5]张恩迪,郑汉臣.中国濒危野生药用动植物资源的保护[M].上海:第二军医大学出版社,2000.
[6]Tiwari R K,Trivedi M,Guang Z C,et al.Genetic transformation of Gentiana macrophylla with Agrobacterium rhizogenes: growth and production of secoiridoid glucoside gentiopicroside in transformed hairy root cultures[J].Plant Cell Rep,2007,26(2):199-210.
[7]Zhang H L,Xue S H,Pu F,et al.Establishment of hairy root lines and analysis of gentiopicroside in the medicinal plant Gentiana macrophylla[J].Russ J Plant Physiol,2010,57:110-117.
[8]齐香君,陈如意,王 薇.秦艽细胞悬浮培养研究I[J].中草药,2010,41(3):472-475.
[9]Ro D K,Paradise E M,Ouellet M,et al.Production of the antimalarial drug precursor artemisinic acid in engineered yeast[J].Nature,2006,440(7 086):940-943.
[10]Ajikumar P K,Xiao W H,Tyo K E,et al.Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli[J].Science,2010,330(6 000):70-74.
[11]Paddon C J,Westfall P J,Pitera D J,et al.High-level semi-synthetic production of the potent antimalarial artemisinin[J].Nature,2013,496(7 446):528-532.
[12]Guo J,Zhou Y J,Hillwig M L,et al.CYP76AH1 catalyzes turnover of miltiradiene in tanshinones biosynthesis and enables heterologous production of ferruginol in yeasts[J].Proc Natl Acad Sci USA,2013,110(29):12 108-12 113.
[13]Feng H,Yua Z,Chu P K.Ion implantation of organisms[J].Mat Sci Eng R,2006,54(3-4):49-120.
[14]Lu J,Jin X,Mao P H,et al.Transfer of Ephedra genomic DNA to yeasts by ion implantation[J].Appl Biochem Biotechnol,2009,158(3):571-581.
[15]黄国伟,毛培宏,金 湘,等.低能离子注入介导外源DNA转化的原理与应用[J].基因组学与应用生物学,2009,28(4):815-820.
