山楂对低密度脂蛋白受体基因敲除小鼠脂代谢的影响
2014-06-27张玉颖
张玉颖,张 晾
(山东省动物抗性生物学重点实验室,山东师范大学生命科学学院,山东济南 250014)
动脉粥样硬化(atherosclerosis, AS)是引起心脑血管疾病的病理基础,高脂血症是引起AS的独立危险因素。血脂代谢异常导致泡沫细胞形成,平滑肌细胞及胶原纤维增生,血管壁增厚并失去弹性,进而引起血管壁不同程度的慢性炎症反应[1-2]。通过天然食物来调节血脂以预防高脂血症已成为当前医疗保健研究的热点。
山楂在我国具有悠久的保健和药用历史。近年来的临床研究证实,山楂具有降压作用[3],并能通过增强心肌收缩力、扩张冠状动脉血管、增加冠状动脉的血流量和降低心肌耗氧量等起到强心和预防心绞痛的作用[4]。然而,对于山楂能够有效防治AS的机制目前尚不清楚。
研究已证实,AS与血脂水平尤其是与胆固醇和甘油三酯(triglycerides, TG)密切相关。高脂血症人群和高脂饮食大鼠的研究发现,山楂能够降低血清总胆固醇(total cholesterol, TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)和TG的含量[5-6]。采用兔或豚鼠高脂饮食建立AS动物模型也证实了山楂能够降低血清中的胆固醇[7-8]。但利用自发性高血脂症的基因敲除小鼠来评价山楂对脂代谢影响尚未见报道。本研究使用低密度脂蛋白受体缺失(low density lipoprotein receptor-deficient, LDLR-/-)小鼠作为高血脂动物模型,探讨山楂对脂代谢的影响,为临床应用提供数据支持。
1 材料与方法
1.1动物LDLR-/-小鼠(C57BL/6J遗传背景)购于美国JACKSON 实验室,于山东师范大学生命科学院SPF级鼠房饲养、繁殖。饲养条件为(22±1)℃,40%~60%相对湿度,12 h明暗循环照明。小鼠出生后第22天停止哺乳,喂以普通饲料(含4%脂肪和0.07%胆固醇等),自由摄取水、食。选取20只4周龄雄性LDLR-/-小鼠,随机分为两组(10只/组),即正常饮食对照组和山楂干预实验组(普通饲料中添加1%的山楂冻干粉)。干预20周后,眼眶取血,解剖分离肝脏组织,-80 ℃保存备用。
1.2主要试剂Trizol试剂、Superscript Ⅱ逆转录酶和Olig (dT)18引物购自美国的Invitrogen公司,DEPC购自美国的Amresco公司,RNase Inhibitor购自日本的TOYOBO公司,DNaseⅠ购自日本的Takara公司,Sybergreen购自美国的Molecular Probes公司,TC和TG检测试剂盒购自南京建成生物工程研究所,山楂冻干粉为本实验室自制。
1.3血脂测定和液相色谱分离脂蛋白按照试剂盒的操作步骤分别检测血清TG和TC含量,以毫摩尔/升(mmol/L)表示。使用Superose 6柱(Amersham Pharmacia)进行快速蛋白液相色谱分析(FPLC),磷酸缓冲液(pH7.2)为流动相。每组血清样品合并后,各取100 μL上样,0.5 mL/min流速,1 min/管收集。试剂盒检测每管中TG、TC含量,500 nm波长检测吸光值,根据吸光值绘制曲线图。
1.4肝脏总脂质的提取及TG、TC含量的检测采用氯仿/甲醇混合液提取肝脏总脂质,利用酶法测定肝脏TG、TC含量。取100 mg肝脏组织于离心管中,加入氯仿︰甲醇(2︰1,V/V)混合液,冰浴充分匀浆,5 000 r/min离心10 min,取上清后加入0.2倍体积NaCl (145 mmol/L),充分混匀后8 000 r/min离心5 min。取下层氯仿相,真空挥干氯仿后称重,计算肝脏中总脂质含量(mg/g)。加入10 μL氯仿和990 μL异丙醇︰Triton X 100(9︰1,V/V)溶解总脂质,充分混匀后按照试剂盒操作步骤检测TG、TC含量。
1.5Real-timePCR分析Trizol法抽提肝脏总RNA,DNaseⅠ处理后紫外分光光度计测其浓度,凝胶电泳确定RNA的质量。取1 μg总RNA,以Oligo(dT)18为引物,Superscript Ⅱ为逆转录酶进行逆转录反应。参照GenBank中基因mRNA的序列设计引物(表1)。使用Rotor-Gene 3 000(Corbett Research, Australia)进行实时定量PCR,Sybergreen法检测目的基因的扩增,同时设β-actin为内参。所有反应均设3个重复。
表1Real-timePCR分析所用引物
Tab.1 Primers used for real-time PCR analysis

基 因正向引物反向引物FAS5'-GCGGGTCTATGCCACGATT-3'5'-TGTTACACCTTGCTCCTTGCTG-3'HMG-CoAR5'-CGAGCCACGACCTAATGAAGA-3'5'-GCTCCCATCACCAAGGAATAAT-3'PPARα5'-CTTTACATCAGTGTTTCCGTCAG-3'5'-TCAAATTGCCACCGTTCTT-3'SREBP-1c5'-TGGCTTGGTGATGCTATGTT-3'5'-TAAGGGGTTGGGAGTAGAGG-3'β-actin5'-CCTCTATGCCAACACAGTGC-3'5'-GTACTCCTGCTTGCTGATCC-3'

2 结 果
2.1饮食干预后小鼠体质量的变化饮食干预20周,每周称体质量1次,结果显示山楂干预组和正常对照组小鼠体质量差异无统计学意义(P>0.05,图1)。

图1不同饮食干预小鼠体质量的增长曲线
Fig.1 Changes of body weight in each group(n=10)
2.2饮食干预后小鼠血清TC、TG含量的变化酶法检测山楂干预组和正常对照组小鼠血清中TC、TG含量,结果显示,与正常对照组相比,山楂干预组小鼠血清中的TC、TG含量显著性降低(P<0.05,表2)。
表2山楂干预组和对照组小鼠血清中TC、TG含量的比较
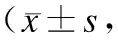

与对照组小鼠比较,*P<0.05。
2.3饮食干预后小鼠血脂谱的变化FPLC法分离脂蛋白,分别测定其TC(图2A)和TG含量(图2B)。分离管6~13收集液为VLDL,第14~30管收集液为LDL/IDL混合液,第31~45管收集液为HDL。结果显示,山楂干预组小鼠与正常对照组相比,VLDL和IDL/LDL峰值明显下降,VLDL-TC/TG和IDL/LDL-TC/TG含量均显著降低。然而,山楂干预组和对照组小鼠的HDL无明显差别。

图2山楂干预组和对照组LDLR-/-小鼠脂蛋白TC和TG的变化
Fig.2 Changes of serum lipoprotein TC and TG in LDLR-/-mice of hawthorn group and control group
2.4小鼠肝脏总脂质及TC、TG含量的比较用氯仿︰甲醇(2︰1,V/V)混合液抽提肝脏总脂质,试剂盒检测肝脏总脂质中TC、TG的含量。统计学数据分析发现,山楂干预组小鼠肝脏总脂质、TC和TG含量与正常对照组相比明显降低,差异具有统计学意义(P<0.05,表3)。
2.5脂代谢相关基因mRNA的表达为阐明山楂干预对LDLR-/-小鼠脂代谢的影响,Real-time PCR法检测脂代谢相关基因mRNA水平的表达情况(图3)。结果发现,山楂干预组的脂肪酸合成酶(FAS)mRNA表达水平比对照组降低了30.8%(P<0.05)(图3A),其上游调控基因SREBP-1c同样显著下调,降低了77.8%(P<0.05,图3B)。山楂干预组脂肪酸氧化相关调控基因PPARα的mRNA表达水平显著上调,与对照组相比升高44.2%(P<0.05,图3C)。山楂干预组与正常饮食对照组相比,胆固醇合成限速酶HMG-CoAR的mRNA表达水平下降55.9%(P<0.05,图3D)。
表3山楂干预组和对照组小鼠肝脏总脂质、TC和TG含量的比较
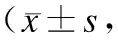

与对照组小鼠比较,*P<0.05,**P<0.01。
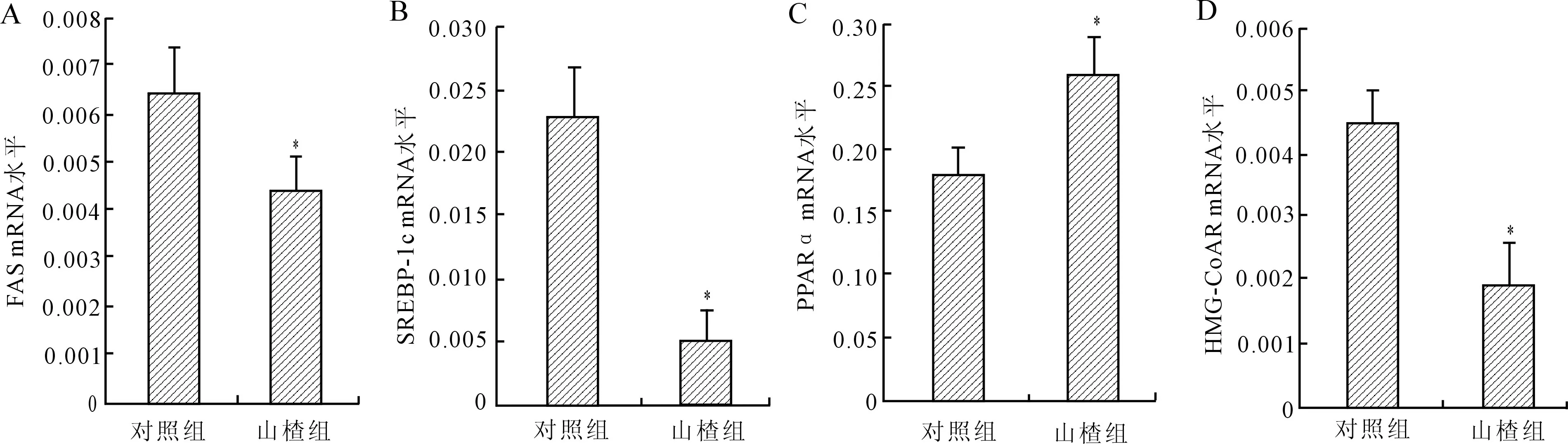
图3山楂干预组和对照组小鼠脂代谢相关基因mRNA的表达
Fig.3 The mRNA expression of genes related to lipid metabolism in hawthorn group and control group (n=10)
A:FAS mRNA表达水平;B:SREBP-1c mRNA表达水平;C:PPARα mRNA表达水平;D:HMG-CoAR mRNA表达水平。与对照组小鼠比较,*P<0.05。
3 讨 论
天然植物提取物预防或治疗疾病在临床上已被广泛应用[9]。本研究通过山楂饮食干预LDLR-/-小鼠,结果显示饮食后显著降低血脂TC、TG水平和肝脏脂质水平。
研究结果显示,山楂能显著降低小鼠血清中TC、TG水平(表2)。根据FPLC结果显示山楂能显著降低VLDL-TG和VLDL-TC水平,可能与抑制FAS和HMG-CoAR基因表达有关(图3A)。HMG-CoAR和FAS表达降低抑制了肝脏胆固醇和脂肪酸的合成,降低了肝脏中TC、TG含量。然而,在山楂干预组中,与脂肪酸氧化相关的调控基因PPARα表达升高(图3C),山楂可能会促进肝脏脂肪酸的氧化分解,这与其他文献报道一致[10]。有研究报道,以兔为动物模型同样发现实验组血清中的TC和TG水平显著低于对照组,而血清中HDL-C水平无明显差异[7],FPLC结果也证实了山楂饮食不影响血清中的HDL-TC和HDL-TG含量(图2)。
综上所述,山楂可以调节LDLR-/-小鼠脂代谢,降低肝脏脂质及血脂水平,对脂代谢引起的相关疾病有一定预防和保护作用,也为研究山楂的药用价值提供了理论基础。
参考文献:
[1] MASSY ZA, KEANE WF. Pathogenesis of atherosclerosis[J]. Semin Nephrol, 1996, 16(1):12-20.
[2] SMIRNOV AN. Lipid signaling in the atherogenesis context[J]. Biochemistry(Mosc), 2010, 75(7):793-810.
[3] SCHANDRY R, DUSCHEK S. The effect of Camphor-Crataegus berry extract combination on blood pressure and mental functions in chronic hypotension—A randomized placebo controlled double blind design[J]. Phytomedicine, 2008, 15(11):914-922.
[4] DAHMER S, SCOTT E. Health effects of hawthorn[J]. Am Fam Physician, 2010, 81(4):465-468
[5] CHEN JD, WU YZ, LIU XP, et al. Hawthorn (shan zha) drink and its lowering effect on blood lipid levels in humans and rats[J]. World Rev Nutr Diet, 1995, 77:147-154.
[6] SHANTHI S, PARASAKTHY K, DEVARAJ SN, et al. Hypolipidemic activity of tincture of Crataegus in rats[J]. Indian J Biochem Biophys, 1994, 31(2):143-146.
[7] ZHANG Z, HO WK, CHEN ZY, et al. Hawthorn fruit is hypolipidemic in rabbits fed a high cholesterol diet[J]. J Nutr, 2002, 132(1):5-10.
[8] ZHANG Z, HO WK, CHEN ZY, et al. Hypocholesterolemic activity of hawthorn fruit is mediated by regulation of cholesterol-7α-hydroxylase and acyl CoA: cholesterol acyltransferase[J]. Food Res Int, 2002, 35:885-891.
[9] HU FB. Plant-based foods and prevention of cardiovascular disease: an overview[J]. Am J Clin Nutr, 2003, 78(3):544S-551S.
[10] NIU C, CHEN C, CHENG J, et al. Decrease of blood lipids induced by Shan-Zha (fruit of Crataegus pinnatifida) is mainly related to an increase of PPARα in liver of mice fed high-fat diet[J]. Horm Metab Res, 2011, 43(9):625-630.
