STAT3及p-STAT3在肝癌中的表达及其与 肝癌临床病理特征的关系
2014-06-27姚英民丁飞虎刘青光
宋 涛,杨 雪,郭 成,姚英民,杨 威,丁飞虎,刘青光
(西安交通大学医学院第一附属医院肝胆外科,陕西西安 710061)
信号传导及转录活化因子(signal transducer and activator of transcription, STAT)是研究干扰素调节基因时发现的,随后不断发现众多酪氨酸激酶作用于不同种类的STAT蛋白。在哺乳动物细胞中,STAT家族发现7个亚型,分别是:STAT1、STAT2、STAT3、STAT4、STAT5A、STAT5B、STAT6。其中STAT3被认为是一种癌基因,是多个致癌性酪氨酸激酶信号通道汇聚点,在多种肿瘤中呈现异常表达活化[1],STAT3及其活化产物表达同肿瘤分级和患者预后存在关联,在肝癌中是否也存在类似现象尚不完全确定。
1 材料与方法
1.1组织标本组织标本均来自2008~2010年西安交通大学医学院第一附属医院手术患者,均合并有乙型病毒性肝炎肝硬化,经术后病理证实为肝细胞肝癌,共计73例,其中男性61例,女性12例,年龄28~72岁,中位年龄50.5岁,取非坏死区肝癌组织(肝癌组织)及距肿瘤边缘2 cm肝硬化组织(癌旁组织)约0.5 cm×0.5 cm×0.5 cm。所有组织均为手术切除后获取的新鲜标本,组织标本获取后立即转移至液氮及40 g/L多聚甲醛固定,经HE染色证实剔除标本内包含坏死组织样本。
1.2主要试剂PCR引物由上海生工生物工程技术服务有限公司合成,鼠抗人STAT3单克隆抗体和鼠抗人p-STAT3单克隆抗体购于Santa Cruz Inc(sc-81385, sc-8059),Elivision二步法二抗试剂盒购于福州迈新生物技术开发有限公司。
1.3RT-PCR检测肝癌组织及癌旁组织STAT3的转录参照FASTAGEN-RNAfast200试剂盒提取组织总RNA,逆转录条件为:37 ℃反应15 min,85 ℃反应5 s。扩增反应条件为:94 ℃预变性5 min,94 ℃变性30 s,50 ℃退火30 s,72 ℃延伸30 s,扩增30个循环;最后72 ℃延伸5 min,PCR扩增产物取5 μL,20 g/L琼脂糖凝胶电泳,以β-actin基因为内参照。STAT3上游引物:5′-GTCAGATGCCAAATGC-3′,下游引物:5′-TGATGTACCCTTCGTTC-3′。β-actin上游引物:5′-ATCGTGCGTGACATTAAGGAGAAG-3′,下游引物:5′-AGGAAGGAAGGCTGGAAGAGTG-3′。以senesiAnsys凝胶定量分析软件进行凝胶扩增产物灰度定量分析。
1.4免疫组化检测肝癌组织及癌旁组织STAT3、p-STAT3表达采用免疫组织化学Elivision二步法,按照试剂盒操作说明书进行操作:60 ℃烘烤切片2 h,石蜡切片脱蜡水化,90 ℃微波抗原热修复2 min,依次滴加30 mL/L H2O2室温下灭活内源性过氧化物酶10 min;STAT3和p-STAT3鼠抗人一抗(分别1∶100;1∶150稀释),4 ℃保存16 h;聚合物增强剂室温孵育20 min;酶标抗鼠/兔聚合物室温孵育25 min;DAB显色。阴性对照组中,以PBS液代替一抗。
1.5免疫组织化学法阳性结果判定密封组织片号,由我院病理科2位病理医师在显微镜下观察组织切片阳性染色情况并进行评分。镜下选取每一组织点的中心部,染色结果判定参照Mattern方法进行判定。阳性染色深度:未见染色为0,轻度染色(浅黄色)为1,中度染色(棕黄色)为2,深度染色(棕褐色)为3;阳性细胞百分比:未见染色为0,染色细胞<25%为1,25%~50%为2,>50%为3。两方面得分相加,0~2分判为阴性表达,>2分判为阳性表达,随机选择10个高倍视野,记数1 000个细胞。记录肝癌组织和癌旁组织p-STAT3阳性表达率及各样本临床资料,病理学特征(年龄、性别、肿瘤大小、肿瘤计数、病理分级、TNM分期、是否存在包膜、门静脉系统侵犯、血清AFP浓度、HBsAg阳性率)。

2 结 果
2.1STAT3在肝癌组织和癌旁组织中的mRNA水平STAT3逆转录扩增产物为368 bp,内参β-actin扩增产物大小为197 bp,在肝癌组织和癌旁组织中均发现存在STAT3转录(图1),但是肝癌组织的STAT3mRNA扩增产物电泳条带灰度明显高于对应癌旁组织,STAT3基因的PCR产物量/β-actin的比值经t检验,差异具有统计学意义(P<0.01)。
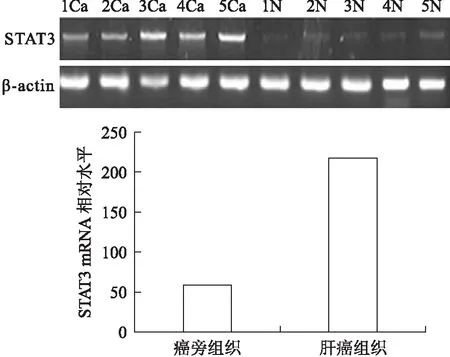
图1肝癌组织(Ca)及对应癌旁组织(N)中STAT3mRNA的表达
Fig.1 STAT3 mRNA expression in hepatic carcinoma tissues (Ca) and paracancerous tissues (N)
2.2免疫组化检测结果73例肝细胞肝癌组织和癌旁组织中未出现组织自溶现象,标本保存良好。STAT3蛋白阳性染色定位于肿瘤细胞胞质及核周,呈棕黄色或棕褐色颗粒状,弥漫或局灶性分布,而肿瘤间质组织中未见STAT3蛋白阳性染色;癌旁组织中STAT3阳性表达率26.0%(19/73),而肝细胞肝癌组织中阳性表达率75.3%(65/73),癌旁组织中STAT3表达弱于肝癌组织(图2),阳性表达率组间差异具有统计学意义(P<0.01)。p-STAT3蛋白阳性染色定位于肿瘤细胞胞核内,呈棕褐色颗粒状。癌旁组织中p-STAT3表达同样弱于肝癌组织,阳性表达率组间差异具有统计学意义(P<0.05,表1)。

图2STAT3和p-STAT3在肝癌组织和癌旁组织的表达
Fig.2 Expression of STAT3 and p-STAT3 in hepatic carcinoma tissues and paracancerous tissues (×400)
A:STAT3在肝癌组织中呈阳性表达;B:STAT3在癌旁肝组织中呈阴性表达;C:p-STAT3在肝癌组织中呈阳性表达;D:p-STAT3在癌旁肝组织中呈阴性表达。
表1STAT3和p-STAT3在肝癌组织及癌旁组织中阳性表达
Tab.1 Positive expression of STAT3 and p-STAT3 in hepatic carcinoma tissues and paracancerous tissues

[n(%)]
与癌旁组织比较,*P<0.05,**P<0.01。
2.3p-STAT3表达同肝癌病理特征关系73例肝癌组织中p-STAT3表达阴性和阳性组间肿瘤大小、组织病理分化、TNM分期、门静脉系统侵犯比率的差异有统计学意义,而患者年龄、性别、肿瘤个数、是否存在假胞膜、血清AFP浓度和HBsAg阳性率组间比较差异无统计学意义(表2)。
3 讨 论
STAT3是IL-6/JAK2/STAT3信号通路的关键调控基因,参与调节众多基因转录,影响细胞增殖侵袭活性[1],研究证实几乎在人类主要肿瘤中均存在STAT3异常表达,在多种肿瘤中STAT3阳性表达同肿瘤病理分级及不良预后相关[2-5]。部分肝癌细胞株内STAT3转录水平异常[6];建立肝癌大鼠模型中也发现肝癌细胞内存在STAT3表达和激活[7]。但是对于人肝癌组织中STAT3表达状况以及STAT3表达同肝癌病理特征是否相关存在不同意见[8],其在肝癌发生发展中的作用尚不完全明确。
我国肝癌患者多数伴有乙型肝炎病毒感染及肝硬化,其血清IL-6水平高于正常人群[9],存在使受损肝细胞和肝癌细胞内IL-6/JAK2/STAT3通路持续激活的始动因素,而且在肝脏细胞和肝脏肿瘤细胞表面发现IL-6受体gp130存在[10],存在激活IL-6/JAK2/STAT3信号通路的物质基础。本实验通过肝癌组织和癌旁肝硬化组织内STAT3 mRNA对比,发现癌旁肝硬化组织虽然存在STAT3基因转录,但是明显低于肝癌组织,说明在肝硬化组织受损细胞向肝细胞肝癌转化中,存在STAT3转录异常升高。通过免疫组织化学证实STAT3蛋白在肝癌组织内表达强度以及阳性表达率均高于癌旁肝硬化组织,而且p-STAT3蛋白也有类似改变,说明在同样存在炎性因子高表达的微环境下,癌旁肝硬化组织STAT3蛋白不同于肝癌组织中的表达升高,STAT3的异常转录表达及活化可能是受损细胞向肝癌细胞转化的中间事件,STAT3在肝硬化组织癌变过程中可能扮演了重要角色。
表2p-STAT3表达与肝癌临床病理特征关系
Tab.2 Correlation between p-STAT3 expression and clinicopathological characteristics in hepatic carcinoma

病理特征例数(n)表达水平阳性表达(n=38)阴性表达(n=35)P值年龄7349.92±9.3951.34 ±7.550.714性别0.633 男613130 女1275肿瘤直径0.029* <5cm321220 ≥5cm412615肿瘤个数0.135 单个572839 多个16106组织病理分化0.009 良(I)808 中(Ⅱ,Ⅲ)512724 差(Ⅳ)14113TNM分期0.028 Ⅰ~Ⅱ301119 Ⅲ~Ⅳ432716包膜形成0.153 无462125 有271710门静脉侵犯0.001 无421527 有31238AFP(ng/mL)0.453 <400472621 ≥400261214HBsAg0.294 阳性583226 阴性1569
IL-6/JAK2/STAT3通路持续激活的最终结果是提高细胞内p-STAT3蛋白表达量,具有生物学活性的p-STAT3蛋白表达异常才可能影响诸如VEGF,survivin等影响细胞增殖侵袭的功能基因转录水平,进而表现为p-STAT3表达同患者临床病理特征相关。我们发现肝癌组织中p-STAT3表达水平明显高于癌旁肝硬化组织,通过对比肝癌组织中p-STAT3阳性表达组和阴性表达组患者的临床特征,发现两组患者在肿瘤大小、组织病理分化、TNM分期、门静脉系统侵犯存在统计学差异,p-STAT3阳性表达组患者肿瘤直径大于5 cm者更多,组织病理更趋向低分化,TNM分期更晚,门静脉系统侵犯率高,以上现象反映出p-STAT3阳性表达肝癌细胞更具增殖侵袭能力,恶性程度更高,虽然未进一步对2组肝癌患者进行生存分析,但是既往众多文献证明肿瘤直径大于5 cm,组织病理分化差,TNM分期晚,门静脉系统侵犯均是患者预后不佳的标志性事件[11-12],而p-STAT3蛋白表达均与以上因素正相关,因此推断p-STAT3有可能成为提示肝癌患者预后的指标之一。
参考文献:
[1] GRONER B, LUCKS P, BORGHOUTS C. The function of Stat3 in tumor cells and their microenvironment[J]. Semin Cell Dev Biol, 2008, 19(4):341-350.
[2] LEE J, KANG WK, PARK JO, et al. Expression of activated signal transducer and activator of transcription 3 predicts poor clinical outcome in gastric adenocarcinoma[J].APMIS, 2009, 117(8):598-606.
[3] HOWLETT M, MENHENIOTT TR, JUDD LM, et al. Cytokine signalling via gp130 in gastric cancer[J]. Biochim Biophys Acta, 2009, 1793(11):1623-1633.
[4] TAKEMOTO S, USHIJIMA K, KAWANO K, et al. Expression of activated signal transducer and activator of transcription-3 predicts poor prognosis in cervical squamous-cell carcinoma[J]. Br J Cancer, 2009, 101(6):967-972.
[5] YANG Z, CAI JH, XIE SJ, et al. Therapeutic effects of signal transducer and activator of transcription 3 siRNA on human breast cancer in xenograft mice[J]. Chin Med J (Engl), 2011, 124(12):1854-1861.
[6] KUSABA M, NAKAO K, GOTO T, et al. Abrogation of constitutive STAT3 activity sensitizes human hepatoma cells to TRAIL-mediated apoptosis[J]. J Hepatol, 2007, 47(4):546-555.
[7] YU XT, ZHU SN, XU ZD, et al. Roles of EGFR-Stat3 signal pathway in carcinogenesis of experimental hepatoma in rats[J]. J Cancer Res Clin Oncol, 2007, 133(3):145-152.
[8] 张荣贵,臧国庆,奚敏,等. 肝细胞癌组织信号转导子与转录激活子3蛋白表达的研究[J]. 中华肿瘤防治杂志,2009, 16(7):523-525,552.
[9] 张家明,王文,姚孝明,等. 肝硬化患者血清AFP、TNF-α、IL-6、IL-10检测的临床意义[J]. 放射免疫学杂志, 2007, 20(3):221-223.
[10] REBOUISSOU S, AMESSOU M, COUCHY G, et al. Frequent in-frame somatic deletions activate gp130 in inflammatory hepatocellular tumours[J]. Nature, 2009, 457(7226):200-204.
[11] CHEN CH, HU FC, HUANG GT, et al. Applicability of staging systems for patients with hepatocellular carcinoma is dependent on treatment method—analysis of 2010 Taiwanese patients[J]. Eur J Cancer, 2009, 45(9):1630-1639.
[12] 陈焕伟,廖珊,王峰杰,等. 解剖性肝切除治疗肝细胞癌的长期结果和预后影响因素分析:附90例报告[J]. 中华肝胆外科杂志, 2012, 18(2):110-114.
