Notch信号在神经肽P物质对高氧暴露肺泡Ⅱ型 上皮细胞的保护作用机制
2014-06-27董欣鑫
董欣鑫,姚 兰,方 芳,许 峰
(1. 重庆医科大学附属儿童医院PICU,儿童发育疾病研究省部共建教育部 重点实验室,重庆 400014;2. 太钢总医院,山西太原 030003)
慢性肺疾病(chronic lung disease, CLD)或支气管肺发育不良(bronchopulmonary dysplasia, BPD)是新生儿持续用氧治疗后的一种肺氧化性损伤疾病,严重影响患儿的肺发育和呼吸功能[1]。肺泡Ⅱ型上皮细胞(alveolar epithelial cell type Ⅱ, AECⅡ)作为肺组织的干细胞,其增殖分化不仅可以修复肺泡的正常结构,而且可以有效改善肺功能。因此AECⅡ是决定肺损伤上皮细胞恢复正常功能状态的主要因素[2]。
神经肽P物质(substance P, SP)是一种细胞外信号分子和细胞调控因子,释放后可与神经激肽1受体(NK1R)结合,参与调控损伤细胞的修复、增殖、分化[3]。本课题组前期研究发现SP可减轻高氧致AECⅡ的凋亡,促进其增殖[4],具有一定的保护效应。但其作用机制尚不清楚。研究表明Notch信号在肺发育中起重要作用,可能参与支气管树及气血屏障的形成,且对呼吸道上皮细胞、肺泡上皮细胞的成熟分化有重要调节作用[5]。因此,SP可能通过参与调节Notch信号的表达起到保护高氧肺损伤的作用。
本研究以原代培养的早产大鼠AECⅡ为研究对象,观察SP干预对高氧致AECⅡ细胞凋亡、氧化损伤、增殖及Notch1、Notch3表达的影响,拟探讨SP对高氧肺损伤细胞的作用机制。
1 材料与方法
1.1实验动物及主要试剂孕19 d Sprague-Dawley(SD)大鼠36只(清洁级成年孕鼠,体质量240~260 g,由重庆医科大学实验动物中心提供);SP(美国Abcam公司);SP拮抗剂L703.606、胶原酶、噻唑蓝(MTT)溶液(美国Sigma公司);DMEM/F12培养基、胎牛血清(美国Gibco公司);胰蛋白酶(美国Hyclone公司);超氧化物阴离子荧光探针检测试剂盒(碧云天生物技术研究所);细胞AnnexinV-FITC凋亡检测试剂盒(南京凯基生物科技发展有限公司);兔抗鼠Notch1及Notch3多克隆抗体、辣根过氧化物酶标记的羊抗兔二抗(美国CST公司);BCA蛋白定量检测试剂盒(北京百泰克公司),Trizol总RNA提取试剂盒、逆转录试剂盒、荧光定量PCR试剂盒(TaKaRa公司)。
1.2早产大鼠AECⅡ的分离、培养及鉴定取孕19 d的大鼠,经剖宫产取出胎鼠,分离、纯化、培养AECⅡ,具体方法参考文献[6]。经透射电镜观察及改良巴氏染色法证实细胞存活率及纯度均在90%以上后备用。
1.3氧化损伤性细胞模型建立及实验分组原代AECⅡ经培养24 h后,随机分为以下4组:①空气组:将细胞置于含50 mL/L CO2的孵箱中培养;②高氧组:将细胞置于50 mL/L CO2、950 mL/L O2的密闭氧仓中;③高氧+SP组:细胞培养液中预先加入5×10-8mol/L的SP,再行高氧处理;④高氧+SP+ L703.606组:细胞培养液中预先加入5×10-8mol/L SP和5×10-7mol/L L703.606,其余处理同高氧组。各组细胞干预并培养24 h。
1.4AnnexinV/PI双标记法检测AECⅡ凋亡将原代培养的AECⅡ细胞接种于6孔板,调整密度为1×106个/mL,经分组处理后,胰酶消化并收集各种贴壁细胞,PBS清洗2次,重悬于结合液[10 mmol/L N-(2-羟乙基)哌嗪-N-2-乙烷磺酸(Hepes)/NaOH,pH 7.4,140 mmol/L NaCl,2.5 mmol/L CaCl2]中,吹打成单细胞悬液,加入5 μL AnnexinV-FITC及10 μL PI于常温避光处孵育15 min,经流式细胞仪激发波长为488 nm处检测,FITC受激发后发出绿色荧光,PI发红色激光,凋亡细胞表现为FITC高染而PI低染(FITC+PI-),计算出该区域的细胞比例。
1.5超氧化物阴离子含量的测定原代培养的AECⅡ细胞,以1×106个/mL 密度接种于细胞培养小室中,按上述分组处理24 h后,去除细胞培养液,加入1 μmol/L的Dihydroethidium(超氧化物阴离子荧光探针)溶液1 mL和细胞一起在37 ℃孵育30 min左右进行荧光探针装载,PBS液洗涤2次,在激发波长为535 nm,发射波长610 nm条件下,用微孔板检测系统(SpectraMax M5/M5e)检测各样本平均荧光强度(MFI),用激光共聚焦显微镜观察图像并采集保存,统计学分析各荧光强度值。
1.6MTT法检测细胞存活率将原代分离的AECⅡ接种于96孔板,调整密度为1×104/mL,24 h后换液,按上述方法处理24 h后,加入5 mg/mL MTT,20 μL/孔,放入孵箱内继续孵育4 h,弃上清,加入二甲基亚砜150 μL/孔,震荡10 min后,酶标仪检测492 nm处各孔吸光度值(A值)。细胞存活率=处理孔A492/对照孔A492×100%。
1.7荧光定量PCR检测Notch1和Notch3采用Trizol一步法提取AECⅡ的总RNA,测定吸光度A260/A280值,计算提取的总RNA浓度,逆转录合成cDNA。PCR引物由Primer premier 5.0自行设计。扩增Notch1基因正义链的引物序列:5′-TGGATGAGGAAGACAAGCATTA-3′,反义链序列为:5′-GAAAAGCCACCGAGATAGTCAG-3′,扩增片段为136 bp;扩增Notch3基因正义链的引物序列:5′-GACAAGGACCACTCCCACTACT-3′,反义链序列为:5′-ATCCACATCATCCTCACAACTG-3′,扩增片段为136 bp;GAPDH正义链的引物序列:5′-GCAAGTTCAACGGCACAGTCA-3′,反义链序列为:5′-TCACCCCATTTGATGTTAGCG-3′,扩增片段为106 bp。反应体系25 μL,反应条件:95 ℃变性30 s,Notch1、Notch3、GAPDH基因的退火温度分别为59 ℃、60 ℃、60 ℃,退火30 s,95 ℃延伸15 s,共40个循环。根据扩增曲线和溶解曲线检测反应的特殊性,结果以GAPDH标准化,应用CFX Manager软件计算目的基因的相对表达量。
1.8Westernblot检测Notch1、Notch3蛋白水平全蛋白裂解液提取细胞总蛋白,BCA法测定蛋白浓度。取蛋白质30 μg上样,经100 g/L的SDS-聚丙烯酰胺凝胶电泳分离后,电转移至聚偏氟乙烯(PVDF)膜,含50 g/L的脱脂奶粉的TBST封闭后,分别加入Notch1多克隆抗体、Notch3多克隆抗体,4 ℃孵育过夜,再加入辣根过氧化物酶标记的二抗孵育2 h,用ECL化学发光法检测,蛋白条带用Quantity One 4.5.0软件分析处理。
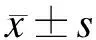
2 结 果
2.1高氧及SP干预对AECⅡ存活率和凋亡率的影响与空气组比较,高氧组暴露后24 h,细胞凋亡率显著升高,细胞存活率明显受到抑制(P<0.01,表1)。高氧+SP组可明显降低高氧暴露后细胞凋亡率,提高细胞存活率,与高氧组和高氧+SP+L703.606组相比差异有统计学意义(P<0.01,表1)。
表1高氧暴露及SP干预对AECⅡ细胞存活及凋亡的影响
Tab.1 Effect of hyperoxia exposure and SP intervention on survival rate and apoptosis rate of AECⅡ
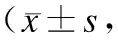
n=6)
与空气组比较,*P<0.01;与高氧+SP组比较,#P<0.01。
2.2高氧及SP干预对AECⅡ超氧化物阴离子水平的影响与空气组比较,高氧组暴露后24 h,细胞超氧化物阴离子水平显著升高(P<0.01)。高氧+SP组可明显降低高氧暴露后细胞的超氧化物阴离子水平,与高氧组及高氧+SP+L703.606组相比差异有统计学意义(P<0.01,图1)。


图1 高氧及SP干预对AECⅡ超氧化物阴离子荧光水平的影响Fig.1 Effect of hyperoxia exposure and SP intervention on the level of intracellular superoxide anion A:超氧化物阴离子荧光强度表达(×400);B:定量分析。1:空气组;2:高氧组;3:高氧+SP组;4:高氧+SP+L703.606组。与空气组比较,*P<0.01;与高氧组比较,#P<0.01;与高氧+SP组比较,&P<0.01。
2.3SP及高氧暴露对AECⅡ内Notch1、Notch3基因水平的影响与空气组比较,高氧组Notch1基因水平表达明显降低(P<0.01),Notch3基因水平表达显著升高(P<0.01),高氧+SP组与单纯高氧组比较,Notch1基因水平表达升高,Notch3基因水平表达降低,具有统计学意义(P<0.01,图2)。

图2SP及高氧暴露对AECⅡ内Notch1、Notch3基因水平的影响
Fig.2 Effect of hyperoxia exposure and SP intervention on the mRNA expression of Notch1 and Notch3 in AECⅡ
1:空气组;2:高氧组;3:高氧+SP组;4:高氧+SP+L703.606。与空气组比较,*P<0.01;与高氧组比较,#P<0.01;与高氧+SP组比较,&P<0.01。
2.4SP及高氧暴露对AECⅡ内Notch1、Notch3蛋白质水平的影响与空气组相比,高氧组Notch1蛋白水平表达明显降低(P<0.01),Notch3蛋白水平表达显著升高(P<0.01),高氧+SP组与单纯高氧组比较,Notch1蛋白水平表达升高,Notch3蛋白水平表达降低,具有统计学意义(P<0.01,图3)。

图3SP及高氧暴露对AECⅡ内Notch1、Notch3蛋白质水平的影响
Fig.3 Effect of hyperoxia exposure and SP intervention on the protein expression of Notch1 and Notch3 in AECⅡ
A:Western blot检测结果;B:半定量分析结果。1:空气组;2:高氧组;3:高氧+SP组;4:高氧+SP+L703.606组。与空气组比较,*P<0.01;与高氧组比较,#P<0.01;与高氧+SP组比较,&P<0.01。
3 讨 论
BPD是新生儿接受高浓度氧治疗的严重并发症之一[1]。主要原因是高浓度氧导致肺组织细胞的ROS产生增多,包括羟自由基(·OH)、过氧化氢(H2O2)、超氧阴离子(O2-)等,过量的ROS可通过氧化应激反应诱导肺泡上皮细胞凋亡甚至坏死[7]。肺损伤的修复主要依赖于AECⅡ的增殖分化,而高氧刺激可抑制AECⅡ的增殖,促进其凋亡。因此寻找保护AECⅡ氧化损伤的因素,可为高氧肺损伤的防治提供理论基础。
SP作为一种感觉神经肽,具有修复细胞增殖、迁移、分化等多种生物学效应[3]。OSLUND等[8]发现通过活化NK1R有助于肺损伤后上皮细胞增殖,是参与损伤修复的重要因素。DIB等[9]发现神经肽递质能通过激活NK1R起到保护急性高氧肺损伤的作用。本实验室黄波等[4]发现SP对高氧状态下AECⅡ的损伤有明显保护作用,但其作用机制尚不清楚。本研究结果显示,SP干预后可减轻氧化损伤,降低细胞凋亡率,增加细胞增殖活性,此结果同前期结果[4]一致。SP的拮抗剂L703.606干预后细胞内超氧化物阴离子水平、细胞凋亡率较SP干预后明显增加,细胞增殖率明显降低,进一步支持SP可以减轻AECⅡ的氧化损伤,促进细胞增殖。
为研究SP作用所涉及的分子机制,本研究对高氧及SP干预下Notch信号通路的活化情况做了进一步的观察。Notch信号途径广泛存在于脊椎动物和无脊椎动物并且高度保守,是胚胎发育所必需的细胞间调节信号,由Notch1~4、配体(Delta、Jagged)及目的基因Su(H)、Hes组成,通过Notch受体和配体相互作用,发生2次裂解后形成活化的胞内区,进而与胞质和胞核内的相关蛋白结合来调控Su(H)、Hes基因的转录,最终影响多种细胞增殖、分化、发育[10]。近年来研究表明Notch信号可能在调控肺泡上皮细胞的分化发育中起重要作用[11]。TAICHMA等[12]发现Notch 1及Jagged 1在肺泡微血管内皮细胞膜表面定位表达。XING等[13]发现Notch1在气道损伤修复中起关键作用。DANG等[14]在活化 Notch3转基因小鼠中发现大量的I型上皮细胞,可见Notch3的持续异位表达影响了上皮细胞的正常分化,最终造成肺形态学改变及发育延迟。
本研究以高氧暴露损伤AECⅡ模型作为研究对象,对Notch1和Notch3的表达进行了研究。结果显示,高氧暴露下AECⅡ内Notch1信号分子表达明显减弱,Notch3信号分子表达明显增加,与空气组比较差异有统计学意义。而高氧暴露前给予SP干预后,Notch1表达有所增加,Notch3表达有所降低,表明SP可逆转高氧对Notch信号分子的作用。研究表明,Notch1的活性增加后,与相关配体结合,进而引起目的基因Su(H)、Hes的转录表达,细胞进入增殖分化程序,发育成功能细胞[10]。因此,推测高氧暴露前给予SP干预后,Notchl表达的上调是促进AECⅡ分化增殖的主要机制之一,有助于高氧损伤上皮细胞的修复。Notch3活性上调可能通过抑制Notch1信号分子的表达,阻止 AECⅡ分化,两者间存在一个制约关系。因此,Notch3的活化是高氧阻滞AECⅡ分化增殖的重要因素,对高氧引起的AECⅡ损伤修复起负面作用,而给予SP干预后可解除这一作用,从而促进高氧损伤AECⅡ的存活。
综上所述,SP可能通过Notch通路的介导,减轻了高氧对AECⅡ的氧化损伤,降低了AECⅡ的凋亡,促进AECⅡ的增殖,利于肺损伤的修复,为BPD的防治提供了新的方向。
参考文献:
[1] RAITH M, SCHAAL K, KOSLOWSKI R, et al. Effects of recombinant human keratinocyte growth factor on surfactant, plasma, and liver phospholipid homeostasis in hyperoxic neonatal rats[J]. J Appl Physiol, 2012, 112(8):1317-1328.
[2] LU HY, SHAO GB, LI WB, et al. Effects of hyperoxia ontransdifferentiation of primary cultured type II alveolar epithelial cells from premature rats[J]. In Vitr Cell Dev Biol Animal, 2011, 47(1):64-72.
[3] SCOTT JR, MUANGMAN PR, TAMURA RN, et al. Substance P levels and neutral endopeptidase activity in acute burn wounds and hypertrophic scar[J]. Plast Reconstr Surg, 2005,115(4):1095-1102.
[4] 黄波,付红敏,杨鸣,等. 高氧对早产鼠肺泡Ⅱ型上皮细胞的影响及神经肽P物质的保护作用[J]. 第三军医大学学报,2008,30(24):2285-2288.
[5] XU K, MOGHAL N, EGAN SE.Notch signaling in lung development and disease[J]. Adv Exp Med Biol, 2012, 727:89-98.
[6] 刘秀香,杨志军,陈洪清,等. 胎鼠肺泡Ⅱ型细胞的原代培养及鉴定[J]. 中国组织工程研究与临床康复, 2008, 12(18):3497-3499.
[7] ZAHER TE, MILLER EJ, MORROW DM, et al.Hyperoxia-induced signal transduction pathways in pulmonary epithelial cells[J]. Free Radic Biol Med, 2007, 42(7):897-908.
[8] OSLUND KL, HYDE DM, PUTNEY LF, et al. Activation of neurokinin-1 receptors during ozone inhalation contributes to epithelial injury and repair[J]. Am J Respir Cell Mol Biol, 2008, 39(3):279-288.
[9] DIB M, ZSENGELLER Z, MITSIALIS A, et al. A paradoxical protective role for the proinflammatory peptide substance P receptor (NK1R) in acute hyperoxic lung injury[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 297(4):L687-L697.
[10] 杨东虹,唐文渊,徐伦山,等. Notch1胞内结构域在星形细胞肿瘤中的表达及其临床意义[J]. 第三军医大学学报, 2010, 32(20):2189-2192.
[11] POST LC, TERNET M, HOGAN BL. Notch/Delta expression in the developing mouse lung[J]. Mech Dev, 2000, 98(1-2):95-98.
[12] TAICHMAN DB, LOOMES KM, SCHACHTUER SK, et al. Notchl and Jaggedl expression by the developing pulmonary vasculature[J]. Dev Dyn, 2002, 225(2):166-175.
[13] XING Y, LI A, BOROK Z, et al. NOTCH1 is required for regeneration of Clara cells during repair of airway injury[J]. Stem Cells, 2012, 30(5):946-955.
[14] DANG TP, EICHENBERGER S, GONZALEZ A, et al. Carbone DE constitutive activation of Notch3 inhibits terminal epithelial differentiation in lungs of transgenic mice[J]. Oncogene, 2003, 22(13):1988-1997.
