南麂列岛岩相潮间带多毛类生态初步研究
2014-06-26汤雁滨高爱根廖一波曾江宁陈全震
汤雁滨,高爱根,廖一波, ,寿 鹿, ,曾江宁,陈全震
(1.国家海洋局 海洋生态系统与生物地球化学重点实验室 国家海洋局第二海洋研究所,浙江 杭州 310012;2.宁波大学 海洋学院,浙江 宁波 315211;3.南京师范大学 生命科学学院,江苏 南京 210046)
南麂列岛国家海洋自然保护区位于浙江东南沿海,隶属于温州市平阳县,始建于1992年,是我国最早成立的海洋自然保护区之一;1998年该保护区成为当时我国唯一纳入联合国教科文组织世界生物圈保护网络的海洋类型自然保护区;2000年又被联合国开发计划署列为全球环境基金“中国南部海域生物多样性保护示范区”。南麂列岛位于台湾暖流与浙闽沿岸流交汇处,气候温暖、物种丰富,其潮间带生物资源更是一座海洋生物的宝库,其贝藻资源在建区初期就被圈定为保护对象[1-4],而在潮间带生境中与贝藻类共同生活的多毛类则被忽视。多毛类隶属于环节动物门,其种类极其丰富且多为海生,仅在我国海区记载的就有1千多种[5-6],是潮间带生态系统的重要组成部分,在维持海洋生态系统平衡中发挥着重要作用[7-8]。多毛类浮游幼体时期短,迁移能力较弱,多在底质上营底栖爬行或穴居生活,可作为良好的环境指示生物[9-12]。国外对多毛类的生态学功能已有较深入研究[13-15],而国内此类研究起步较晚且近年来有发展减缓的趋势[8]。之前曾有过多次对南麂列岛的底栖生物调查[1-2,4],但由于调查侧重点不同,对多毛类并未给予过多关注,使得调查结果对南麂岛多毛类实际状况的表征意义有限。因此对南麂列岛多毛类的种类数量分布进行系统研究,对于保护区内生物多样性的保护和修复具有重要意义。鉴此,作者于 2012年 5月、8月、11月和2013年2月在保护区内布设4条断面,对其中多毛类的生态现状进行了调查,对其生态功能开展了初步研究,有望进一步丰富南麂列岛岛礁生态系统保护学的研究范畴,为南麂列岛的环境保护、管理提供基础信息和科学依据。
1 材料与方法
1.1 南麂列岛环境概况
南麂列岛位于浙江省温州市东南海域,总面积201.06 km2。区内有面积大于500 m2的岛屿52个,南麂主岛面积为 7.64 km2,西距大陆最近点约 30 n mile。列岛长期受海浪和潮汐的侵蚀和冲击,基岩裸露,且多呈陡崖峭壁。列岛岸线曲折,岬角丛生,海湾众多。主岛位于列岛中央,呈东南—西北走向,全长5.3 km,东西最宽处3.3 km,最窄处仅150 m;最高点海拔229 m,岸线长24.8 km,有大沙岙、火焜岙和马祖岙、国姓岙 4个海湾,分为于东南和西北两个方向。大檑山岛位于主岛西北约2 km,面积0.37 km2,最高点海拔 83.8 m,岛呈西北—东南走向。马祖岙位于主岛最窄西北处,岙内是南麂主要养殖区,陆上有育苗场,西侧为一民用码头。大沙岙沙滩位于主岛最窄处东南,长约600 m ,宽约为200 m,滩面由贝壳碎屑细砂构成,是南麂列岛最具代表的沙滩。
1.2 断面布设与采样
在南麂列岛的马祖岙、大檑山、大山脚、黄鱼屯各布设一条断面,依次记为S1、S2、S3、S4。除S2外,其余3条断面均位于南麂主岛,具体断面分布见图1。于2012 年 5 月(春季)、8 月(夏季)、11 月(秋季)和 2013 年2月(冬季)当地大潮汛期间进行采样。每条断面设置 7个站位,高潮区2个,中潮区3个,低潮区2个(受潮汐影响,部分站位低II未采集)。每站各采4个定量样和1个定性样。采用10 cm×10 cm样框,采集样框内所有多毛类。定性样在所选区域内广泛采集。所有样品装袋后用 5%甲醛固定保存后带回,在实验室中吸干表面水分后进行鉴定,同时对样品进行计数、称质量,所有标本力求鉴定到种。整个样品采集过程参照《海洋调查规范第6部分》(GB/T12763)进行。

图1 研究区域与采样断面Fig.1 Study area and sampling section
1.3 数据分析
样品的鉴定方法如下: 对采集的样品用SteREO Discovery.V8蔡司体视显微镜观察其总体形态,然后在高放大倍数下重点观察头部、疣足等部位的特征,对部分难鉴定种类进行解剖,取其刚毛制成临时装片在徕卡 DM2500显微镜下进行观察,综合观察结果对多毛类种类进行鉴定[5-6,16-17]。
为减小种间差异对分析结果的影响,将物种的栖息密度进行四次方根转化后计算。由于高潮区几乎无多毛类分布,以下计算除特殊说明外,均只包括中、低潮区的数据。
1.3.1 优势种
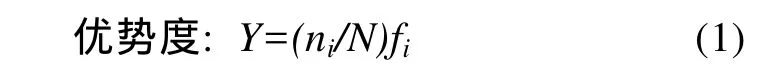
式中,N为各断面中所有多毛类栖息密度的四次方根;ni为物种i栖息密度的四次方根;fi为物种i在各断面的出现频率。Y大于0.02时为优势种。
1.3.2 Shannon-Wiener多样性指数[18]:
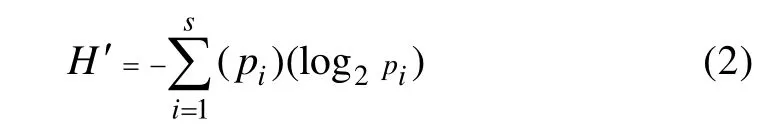
1.3.3 Pielou均匀度指数[18]:

1.3.4 Marglef丰度指数[18]:

2 结果
2.1 组成与分布
2.1.1 物种组成
4次调查共鉴定出多毛类 85种(表 1),隶属 24个科。以沙蚕科种类最多,为17种,有12个科只出现 1种。春季采集到多毛类51种,夏季47种,秋季40种,冬季19种。
四季优势种如表2所示。优势度Y大于0.02的种类共计19种,隶属于8科。龙介虫科占6种,所占比例最高。异须沙蚕为仅有的一种四季优势种,即每一季度调查中优势度均高于0.02。
2.1.2 空间分布特征
各断面多毛类丰度及生物量见表3。高潮区多毛类丰度与生物量均处于较低水平,这是由于高潮区长期暴露在空气中,藻类稀疏,缺少适合多毛类生存的环境所致。故在接下来的计算中均只包括中低潮区数据。去除高潮区的数据后,S1四季丰度最高为秋季(1167个/m2),最低为春季(651个/m2);S2四季丰度最高为夏季(982个/m2),最低为冬季季(388个/m2);S3四季丰度最高为夏季(1171个/m2),最低为春季(384个/m2);S4四季丰度最高为夏季(725个/m2),最低为春季(319个/m2)。

表1 南麂岩礁相潮间带多毛类物种名录Tab.1 Checklist of polychaetes of intertidal rocky zone on Nanji Islands

续表
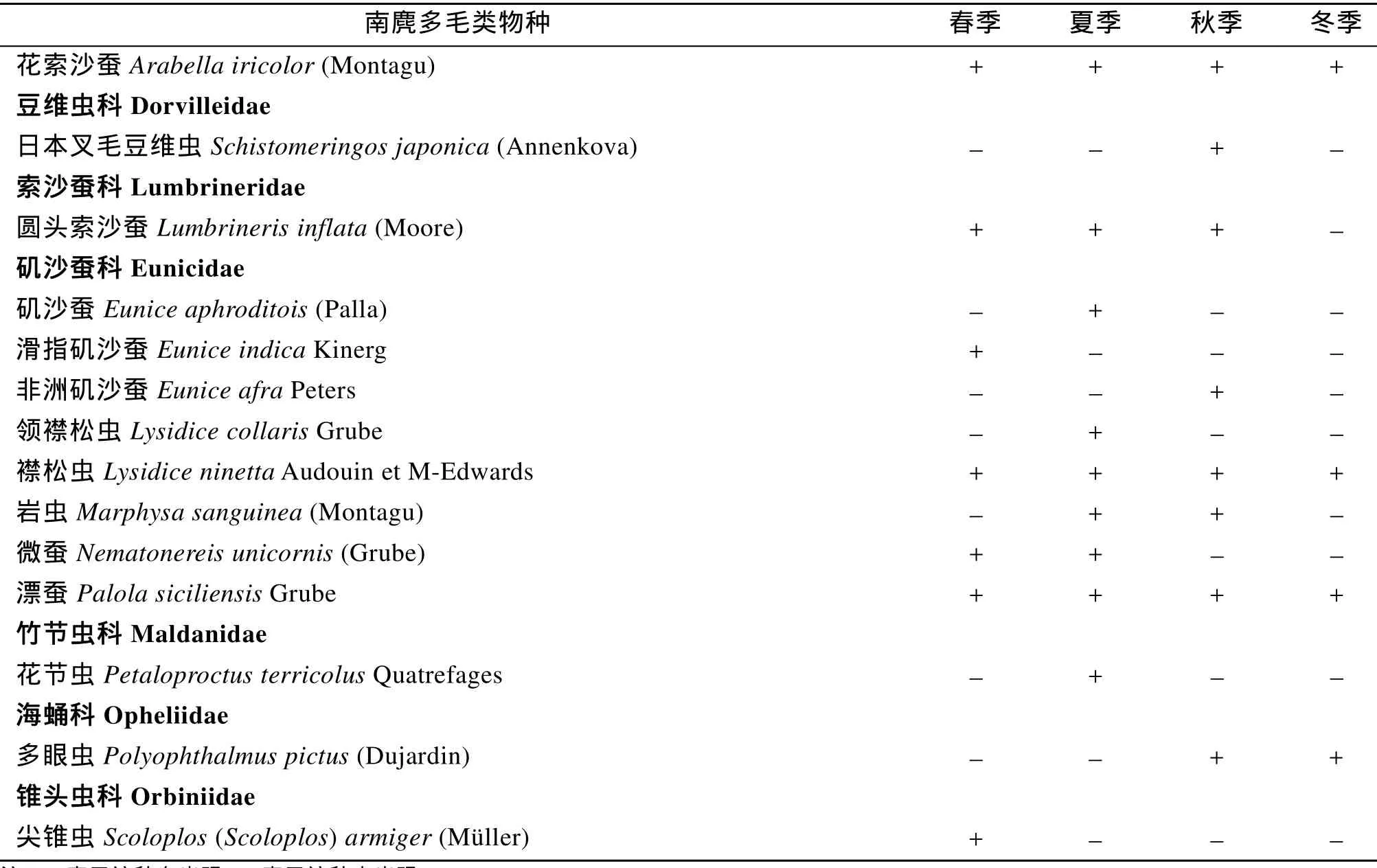
续表

表2 2012年南麂岛岩相潮间带多毛类优势种Tab.2 Dominant species of polychaetes of intertidal rocky zone on Nanji Islands in 2012

表3 南麂岛岩相潮间带春、夏、秋、冬季多毛类丰度、生物量Tab.3 Abundance and biomass of polychaetes of intertidal rocky zone in spring,summer,autumn and winter
S1四季生物量最高为春季(26.83 g/m2),最低为夏季(10.96 g/m2);S2四季生物量最高为春季(67.07 g/m2),最低为冬季(9.84 g/m2);S3四季生物量最高为春季(34.51 g/m2),最低为冬季(4.25 g/m2);S4四季生物量最高为春季(29.57 g/m2),最低为冬季(4.34 g/m2)。
2.2 生物多样性指数
四季各断面的Shannon-Wiener多样性指数H'、Pielou均匀度指数J及Marglef丰度指数d的计算结果见图2。均匀度指数的变化范围很小(0.922~0.990),各断面之间、季节之间几乎无区别。多样性指数与丰度指数的变化趋势类似。冬季各断面这两项指数均属较低水平,其余季节各断面变化趋势不同。
3 讨论
3.1 岩礁相多毛类的生境
岩礁相潮间带的多毛类生境和软相底质中的多毛类不同,常栖息在岩礁的其他物种中,其主要生境有三种: 大型藻类底部、贝类壳体或个体间隙、藤壶间隙。从现场观测的情况看,春夏季南麂岛藻类的种类数及丰度都较高,为多毛类提供优良的生存条件,到了秋冬季,藻类衰退,剩余的优势藻种以较矮小的珊瑚藻为主,而裸露区域则被藤壶、贻贝占据。值得注意的是,浙江海域水体中泥沙含量较高[19-20],南麂列岛虽远离大陆,但仍会接受沿岸流输运的大量泥沙,此外,南麂岛藻类丰富,对沉积物固定有一定帮助,使得南麂岛的岩礁具有一定深度沉积物层。故本次调查中采集到梳鳃虫、滑指矶沙蚕等多见于软相底质的多毛类。
3.2 总体现状
南麂岛潮间带多毛类资源丰富。2009年 4月对浙江南部近岸海域大型底栖生物的调查表明,浙南多毛类的丰度与生物量分别为 268个/m2与2.13 g/m2[21],而本次调查中南麂岛各断面的这两项数据即使在冬季也仍高于该水平。与厦门港[22]同为岩相潮间带的调查结果相比,南麂岛多毛类的种类数、丰度、生物量都更高。与其他多数类似调查结果[23-25]相比,南麂岛的多毛类种类更丰富,数量更多。南麂岛除丰富的贝藻资源之外,同样有着数量庞大的多毛类群体。
南麂岛的多毛类群落表现出明显的季节性变化,冬季的生物量、多样性指数与丰度指数均处于较低水平,与其余三次调查有明显差异。之所以出现这种情况,除简单的季节变化影响外,与每年 3月至 10月控制南麂海域的台湾暖流[26]的作用分不开。在这支暖流影响期间,南麂列岛海区水温较高,夏季采样期间的平均水温达到了27.9℃,春季也有20.9℃。在春夏季采集到的样品中襟松虫、杂色伪沙蚕、扁蛰虫等暖水种占一定比例,这也证实了台湾暖流对南麂岛潮间带多毛类的影响。而当这支暖流的影响消失后,以马旋塞虫为代表的冷水种在南麂岛也能达到不小的优势度,体现出南麂列岛潮间带多毛类群落多元化的特点。

图2 各断面Shannon-Wiener多样性指数(A)、Pielou均匀度指数(B)、Marglef丰度指数(C)Fig.2 Shannon-Wiener index (A),Pielou index (B)and Marglef index (C)in each sampling section
3.3 环境对于多毛类的影响
3.3.1 人类活动的影响
本次调查的19种优势种中龙介虫科占6种,为所有种类中最高。而龙介虫为主要的海洋污损生物之一[27-30],能通过附着在船只、网箱等表面上进行传播。第 5次人口普查数据显示,南麂岛上常驻人口2413人,来自大陆驻岛季节性生产的渔民和暂住人口有7000多人,故在南麂岛附近海域常有渔船活动,龙介虫科多毛类可借此迁移。
S1站点位于马祖岙左岙,其周边海域是南麂岛主要的海水养殖区域,分布有大量网箱、浮排,同时马祖岙内有一民用码头,平时常有渔船往来。这就导致了S1成为了本次调查的4条断面中受人为活动影响最大的一条。夏季S1的丰度指数与多样性指数均处于较低水平,与冬季接近。8月为南麂岛旅游旺季,岛上日接待游客可达上千人次。马祖岙附近人类活动增加,可能影响到了多毛类的分布。尽管受到人类影响,南麂岛多毛类的这两项指数依然要高于海州湾、湄洲湾等地[24,31]。
3.3.2 潮汐对多毛类的影响
潮汐影响了不同潮区多毛类的种类数量分布。高潮区到低潮区暴露在空气中的时间存在差异,导致生活在其中的多毛类表现出不同特征。高潮区暴露于空气中的时间最长,生存条件最为恶劣,几乎无多毛类存在,只有一些石缝低洼处,退潮时能够囤积海水,适于藻类生长,在这些区域中有多毛类的存在[22]。中潮区的多毛类多体型健壮,有较强的迁移和耐受能力,如花索沙蚕、多齿围沙蚕等。而迁移能力较弱的管栖多毛类则多分布于低潮区。例如华美盘管虫、马旋鳃虫等种类多在中潮区下层和低潮区采到。一些适应能力和迁移能力都较强,数量又较多的种类则在不同的潮区均可采到,典型的为异须沙蚕,在南麂岛的高中低三个潮区均有分布,同时数量较多,为南麂岛的多毛类优势种之一。
3.3.3 季节变化对多毛类的影响
表1~表3显示出多毛类在季节上的变化特征。采样期间春季南麂岛附近海域的表层海水平均温度为20.9℃,夏季为27.9℃,秋季为13.4℃,冬季为9.8℃。四季之间有明显差距,是影响多毛类季节变化的重要因素。春夏季节水温较高,且氮、磷营养盐含量高于秋冬季[32],季节性旺发的浮游动植物为多毛类幼虫提供了丰富的饵料[33-34]。多毛类在这两季的丰度和生物量都处于较高水平。秋季,水温开始下降,具有迁移能力的多毛类迁入较温暖的潮下带,潮间带多毛类数量下降。到了冬季,潮间带多毛类的丰度与生物量都达到四季的最低点,而马旋鳃虫这类管栖多毛类由于不具有迁移能力,继续留在潮间带,成为秋冬季的优势种,从表2中可以看到,马旋鳃虫的优势度从夏季至冬季不断升高,并在冬季的优势度高达0.381,为所有多毛类中最高。图2显示冬季的丰度指数和多样性指数均处于较低水平,这也反映了该季多毛类数量较少,种类单一的状况。
不同季节藻类的生长状况对多毛类也有影响。春季为南麂岛大型藻类的生长旺季,而夏季开始衰退,到了冬季紫菜等藻类开始生长,但与春季相比生物量仍有较大差距。丰富的藻类可为体型较大的多毛类提供良好的栖身之所,而夏秋冬这三个季节不具备这种条件,多数大体型多毛类无法继续在潮间带生活。这就解释了表 3中春季的调查采集的多毛类相较其他几个季节丰度没有明显优势,但生物量要远超其他几季的现象。
裂虫科的许多种类对环境变化较为敏感[10,35]。调查显示裂虫科几个种随水温变化表现出不同的变化趋势: 冷水种的千岛模裂虫在春夏季不是优势种,而到了秋冬季成为优势种且优势度随水温降低而升高;广温种的似环模裂虫在本次调查中未表现出与水温变化的明显关系。
3.4 多毛类的环境指示作用
多毛类对于环境的指示作用,国外已有相关的研究[36-37],但多聚焦在软相底质(沙滩、泥滩),而对于岩礁类硬相底质的研究刚刚起步[10]。南麂列岛潮间带以岩礁为主,多有藻类覆盖,为多毛类的生长提供了适宜的条件,其中也不乏一些适合作为环境指示物种的多毛类。环境指示生物应具备以下特点:(1)在调查区域广泛分布且数量较高;(2)对于环境变化敏感,在周遭环境受到扰动后会出现较大的数量变化;(3)迁移能力弱,可代表调查区域的生物群落;(4)易于采集,容易在实验室中培养;(5)在生态系统中占有重要地位[38]。国外一些研究认为裂虫科可作为海洋环境的良好指示物种[10],而国内尚缺少此方面研究。南麂岛由于其独有的自然环境优势,可作为开展此类研究的野外试验场,本次调查可为将来的研究提供参考。
3.5 多毛类生态功能初步分析
多毛类是潮间带生态系统物质交换和能量流动的重要环节,其本身是某些甲壳类、贝类和鱼类的饵料[7-8]。因此多毛类的数量状况可直接影响以其为食物种的分布。南麂岛丰富的藻类资源为多毛类提供了生存的条件,而大量多毛类又可作为贝类的天然饵料,可以说贝藻这两大南麂岛上最重要的生物类群都与多毛类有着紧密的联系。
底栖多毛类可通过生物扰动(包括潜穴,爬行、觅食、和避敌等)及对营养盐的吸收、转化、降解和排泄等生理活动影响着营养盐在沉积物-水-气三相界面之间的迁移、转化[39-40]。以龙介虫科为例,岩礁相的底质较为坚硬且孔隙较少,而此类多毛类在其表面营造栖管,增加了表面积,使氧气更充分进入底质中,改变了氧化环境,进而影响到营养盐的变化。
[1]高爱根,曾江宁,陈全震,等.南麂列岛海洋自然保护区潮间带贝类资源时空分布[J].海洋学报,2007,29 (2): 105-111.
[2]高爱根,董永庭,王慧珍,等.南麂列岛邻近海域贝类生态分布的初步研究[J].东海海洋,1998,16 (2): 49-54.
[3]Sun J Z,Ning X R,Le F F,et al.Long term changes of biodiversity of benthic macroalgae in the intertidal zone of Naji Islands [J].Acta Ecologica Sinica,2010,30 (2): 106-112.
[4]彭欣,谢起浪,陈少波,等.南麂列岛潮间带底栖生物时空分布及其对人类活动的响应[J].海洋与湖沼,2009,40 (5): 584-589.
[5]刘瑞玉.中国海洋生物名录[M].北京: 科学出版社,2008: 405-452.
[6]杨德渐,孙瑞平.中国近海环节多毛动物[M].北京:农业出版社,1998.
[7]纪莹璐,拓宁,刘志强,等.我国沿海多毛类研究的现状[J].水产科学,2012,31 (5): 306-310.
[8]周进,李新正.中国海多毛纲动物研究现状及展望[J].海洋科学,2011,35(6): 82-89.
[9]Belan T A.Marine environmental quality assessment using polychaete taxocene characteristic in Vancouver Harbor [J].Marine Environmental Research,2003,57(1-2): 89-101.
[10]Giangrande A,Licciano M,Musco L.Polychaetes as environmental indicators revisited [J].Marine Pollution Bulletin,2005,50 (11): 1153-1162.
[11]Van Hoey G,Degraer S,Vincx M.Macrobenthic community structure of soft-bottom sediments at the Belgian Continental Shelf [J].Estuarine,Coastal and Shelf Science,2004,59 (4): 599-613.
[12]Labrune C,Grémare A,Amouroux J M,et al.Assessment of soft-bottom polychaete assemblages in the Gulf of Lion (NW Mediterranean)based on a mesoscale survey [J].Estuarine,Coastal and Shelf Science,2007,71 (1-2): 133-147.
[13]Jaubet M L,Garaffo G V,Sánchez M A,et al.Reef-forming polychaetes outcompetes ecosystem engineering mussels [J].Marine Pollution Bulletin,2013,71(1-2): 216-221.
[14]Ryer C H,Spencer M L,Iseri P,et al.Polychaete worm tubes modify juvenile northern rock sole Lepidopsetta polyxystra depth distribution in Kodiak nurseries [J].Journal of Experimental Marine Biology and Ecology,2013,446: 311-319.
[15]Sizmur T,Canário J,Gerwing T G,et al.Mercury and methylmercury bioaccumulation by polychaete worms is governed by both feeding ecology and mercury bioavailability in coastal mudflats [J].Environmental Pollution,2013,176: 18-25.
[16]吴宝玲,吴启泉,丘建文,等.中国动物志: 环节动物门多毛纲I叶须虫目[M].北京: 科学出版社,1997.
[17]孙瑞平,杨德渐.中国动物志: 环节动物门多毛纲 II沙蚕目[M].北京: 科学出版社,2004.
[18]马克平,刘玉明.生物群落多样性的测度方法 Iα多样性的测度方法(下)[J].生物多样性,1994,2(4):231-239.
[19]王凯,卢昕晖,施心慧.东海浑浊海域悬沙浓度的三维数值模拟及与观测的比较[J].海洋与湖沼,2011,42 (6): 884-890.
[20]李旭升,赵洪波,左书华,等.浙江苍南海域水文泥沙环境及冲淤演变分析[J].水道港口,2008,29 (5):318-322.
[21]贾海波,胡颢琰,唐静亮,等.浙江南部近岸海域大型底栖生物的生态[J].台湾海峡,2011,30 (4):577-582.
[22]郑凤武,吴启泉,鲁琳.厦门港岩相潮间带多毛类的生态[J].台湾海峡,1997,16 (1): 85-89.
[23]陈海燕,周红,张志南,等.青岛岩礁海藻附植动物的区系组成和季节动态[J].中国海洋大学学报(自然科学版),2011,41 (2): 85-90,96.
[24]高爱根,杨俊毅,曾江宁,等.海州湾潮间带大型底栖动物的分布特征[J].海洋学研究,2009,27 (1):22-29.
[25]王金宝,李新正,王洪法,等.胶州湾多毛类环节动物数量分布与环境因子的关系[J].应用与环境生物学报,2006,12 (6): 798-803.
[26]管秉贤.黑潮—— 一 支世界著名的大洋 強流[J].海洋科学,1978,2: 1-6.
[27]孙瑞平,杨德渐.中国近海盘管虫属(多毛纲: 龙介虫科)的研究I [J].海洋科学集刊,2000,42: 116-135.
[28]孙瑞平,杨德渐.中国近海龙介虫科(多毛纲: 缨鳃虫目)的研究II [J].海洋科学集刊,2001,43: 184-208.
[29]孙瑞平,杨德渐.中国近海龙介虫科和螺旋虫科(多毛纲: 缨鳃虫目)的研究III [J].海洋科学集刊,2001,43: 209-227.
[30]王宝强,薛俊增,庄骅,等.洋山港海域大型污损生物的生态特点[J].海洋学报,2012,34 (3): 155-162.
[31]方少华,张跃平,骆巧琦,等.湄洲湾多毛类物种多样性及生态特点[J].台湾海峡,2011,30 (3): 419-429.
[32]李扬,吕颂辉,江天久,等.浙江南麂列岛海域氮、磷营养盐季节动态及其环境影响因子分析[J].海洋通报,2009,28 (4): 74-80.
[33]纪焕红,叶属峰,刘星,等.南麂列岛海洋自然保护区浮游动物的物种组成及其多样性[J].生物多样性,2006,14 (3): 206-215.
[34]陈舜,李扬,李欢,等.南麂列岛海域浮游植物的群落结构研究[J].海洋环境科学,2009,28 (2): 170-175.
[35]Musco L,Cavallo A,Giangrande A.I sillidi (Annelida Polychaete)dellitoralebrindisino: possibilità di un loroimpiego come indicatori di qualitàdell'ambiente [J].Thalassia Salentina,27: 161-174.
[36]Surugiu V,Revkov N,Todorova V,et al.Spatial patterns of biodiversity in the Black Sea: An assessment using benthic polychaetes [J].Estuarine,Coastal and Shelf Science,2012,88 (2): 165-174.
[37]Dean H K.The use of polychaetes (Annelida)as indicator species of marine pollution: a review [J].Rev Biol Trop,56 (4): 11-38.
[38]徐士霞,王跃招,李旭东.两栖动物在环境污染生物监测中的应用前景[J].应用与环境生物学报,2004,10 (6): 816-820.
[39]刘敏,侯立军,许世远.底栖穴居动物对潮滩沉积物中营养盐早期成盐作用的影响[J].上海环境科学,2003,22 (3): 180-196.
[40]余婕,刘敏,侯立军,等.底栖穴居动物对潮滩 N迁移转化的影响[J].海洋环境科学,2004,23 (2): 1-4.
