全细胞催化生产苯乙酰-7-氨基-3-脱乙酰氧基头孢烷酸的条件优化
2014-06-24付金衡赵健林白雪许杨陶勇
付金衡,赵健,林白雪,许杨,陶勇
1南昌大学中德联合研究院,江西南昌330047 2中国科学院微生物研究所,北京100101
全细胞催化生产苯乙酰-7-氨基-3-脱乙酰氧基头孢烷酸的条件优化
付金衡1,赵健1,林白雪2,许杨1,陶勇2
1南昌大学中德联合研究院,江西南昌330047 2中国科学院微生物研究所,北京100101
头孢类抗生素由于广谱性和低毒性被广泛用于细菌感染的治疗。7-氨基-3-脱乙酰氧基头孢烷酸(7-am inodeacetoxycephalosporanic acid,7-ADCA)作为半合成头孢类抗生素的重要中间体,需求量逐渐增加,而7-ADCA主要由G-7-ADCA(苯乙酰-7ADCA)脱酰基得到。工业上多以化学法合成G-7-ADCA,成本高,污染严重。迫切需要对环境友好且经济高效的合成方法。在前期研究中,构建了一株可以将青霉素G转化为G-7-ADCA的代谢工程菌(E.coli H7/PG15)。本研究通过单因素试验对E.coli H7/PG15的G-7-ADCA合成过程进行优化,包括底物组成及其最适浓度,转化条件(菌体浓度、pH、青霉素浓度、MOPS浓度、葡萄糖浓度,铁离子浓度和时间等)。优化后,建立了全细胞催化法生产G-7-ADCA的工艺流程,使G-7-ADCA的产量稳定在15 mmol/L左右,转化率达到30%,具有操作简便、高效和经济的优势。
苯乙酰-7-氨基-3-脱乙酰氧基头孢烷酸,全细胞催化,生物转化,条件优化
β-内酰胺类抗生素是临床使用最多、应用最广和评价最高的一类抗生素[1]。β-内酰胺环的抗生素中最重要的两类是青霉素和头孢类抗生素。青霉素有抗菌谱相对较窄、致病菌耐药性、对酸不稳定、不能口服等缺点[2]。头孢菌素是意大利科学家Giuseppe Brotzu发现的第一种头孢类抗生素,它是对革兰氏阳性菌和革兰氏阴性菌有强抑制的广谱抗生素[3]。与青霉素相比,头孢菌素具有抗菌谱广、耐青霉素酶、毒性低等优点。头孢类抗生素合成的主要材料为7-氨基头孢烯酸(7-ACA)和7-ADCA。7-ACA由头孢菌素C去侧链制得,头孢菌素C则通过顶头孢霉发酵产生。但头孢菌素C的发酵产量较青霉素要低很多,而且在任何pH下都易溶于水,所用的柱层析分离技术操作复杂、成本高昂、工艺周期长。7-ADCA是制造头孢氨苄、头孢羟氨苄、头孢拉定等半合成头孢菌素的重要中间体,需求量大,与7-ACA相比,在3位消除了不稳定的乙酰氧基。它可由价廉易得的青霉素G扩环得到G-7-ADCA,然后用青霉素酰化酶去除侧链即可得到7-ADCA。
目前在工业上生产7-ADCA的方法主要有两种:一是将扩环酶克隆至产黄青霉,直接发酵产G-7-ADCA[4],酶法脱侧链后获得7-ADCA,但该方法的产量低,周期长,技术复杂,国内未见报道;二是以青霉素G为原料,采用化学法酯化、扩环、脱脂得到G-7-ADCA,然后去除侧链得到7-ADCA[5]。但化学合成方法不但成本高而且严重污染环境[6]。利用青霉素扩环酶(DAOCS)使青霉素G扩环得到G-7-ADCA(图1),再去除7位侧链得到7-ADCA被认为是可以取代化学法的低成本、低污染的良好方法[7]。
Hsu等[8]在体外利用改造过的扩环酶将青霉素转化为G-7-ADCA,Gao等[9]使用含青霉素扩环酶的棒状链霉菌或酶的提取物进行转化。上述方法转化条件十分严格,且体外环境下,青霉素扩环酶极易失活,生物转化的效率极低。而全细胞催化法研究的较少,且主要使用霉菌进行试验,效率和产量都很低。
本实验室创新性地将扩环酶基因克隆至经过改造的E.coli,初步试验G-7-ADCA的转化产量达到了3 g/L以上(另文发表)。本文在前期工作基础上对影响其转化过程的关键性因素进行摸索与优化,为进一步对该菌进行工业改造提供研究基础,并为以后的工业化生产提供启示和参考。

图1 由青霉素扩环酶催化的由青霉素G向G-7-ADCA的转化Fig.1 DAOCS catalyzed conversion of penicillin G to G-7-ADCA.
1 材料与方法
1.1 菌种
工程菌E.coli H7/PG15由本实验室保存。
1.2 主要试剂
标准品青霉素G购自Sigma公司,转化底物青霉素G为国产分析纯试剂,购于华北制药有限公司。标准品G-7-ADCA由中国科学院微生物研究所杨克迁研究员提供。
1.3 工程菌E.coli H7/PG15的诱导表达
将E.coli H7/PG15接种于装有150 m L ZYM-5052自诱导培养基[10]的250 m L摇瓶中,30℃诱导20 h,4℃离心后用生理盐水洗涤2次,用转化底物重悬菌体进行转化。
1.4 工程菌E.coli H 7/PG 15转化条件的优化
1)初始转化条件:将离心后的菌体用转化底物混合物重悬(OD600为30),底物组成为:100 mmol/L青霉素G,0.5%葡萄糖,50 mmol/L MOPS(pH 7.5),3.6 mmol/L FeSO4。将200 μL菌悬液接入20 m L试管,30℃,250 r/m in转化20 h,进行以下发酵条件的优化分析,所有因素均进行3次平行测定,结果取平均值。
2)转化体系中菌体浓度:细菌经诱导离心后收集菌体,用转化底物重悬菌体,使得转化体系中最终OD600分别为15、30、45、60和75,其他条件同1)。
3)转化体系中pH:在最适的菌体浓度下,优化转化过程的初始pH(6.5、7.0、7.5、8.0和8.5),其他条件同1)。
4)转化底物中青霉素浓度:在最适的菌体浓度、pH条件下,优化底物中青霉素浓度(20、30、40、50、100、150和200 mmol/L)。
5)转化底物中MOPS浓度:在最适的菌体浓度、pH和青霉素浓度条件下,优化底物中缓冲液MOPS的浓度(0、20、50、100、150和200 mmol/L),其他条件同1)。
6)转化底物中葡萄糖浓度:在最适的条件下,优化底物中葡萄糖浓度(0%、0.25%、0.5%、0.75%、1%和1.25%),其他条件同1)。
7)转化底物中二价铁离子浓度:在最适的条件度下,优化底物中二价铁离子浓度(0、0.45、0.9、1.8和3.6 mmol/L),其他条件同1)。
8)二硫苏糖醇和抗坏血酸对转化的作用:在最优转化条件下,在转化开始时分别加入二硫苏糖醇和抗坏血酸,确定两者对转化的作用。
9)转化反应的时间:在最适的条件下,在不同的转化时间进行取样,确定最优的转化时间。
1.5 分析测定方法
生物转化反应中转化底物青霉素G的量和G-7-ADCA的含量采用HPLC进行测定。转化反应液离心后收集上清,用去离子水稀释50倍,再用0.22 μm的滤膜过滤后即可上样,上样量为5 μL。色谱柱为Agilent Eclipse XDB-C18(3.5 μm 4.6 mm× 100 mm),流动相为的70%的10 mmol/L的KH2PO4(pH 3.0)、30%的乙腈和0.7%的三氟乙酸,柱温25°C,流速为0.5 m L/m in,紫外检测波长青霉素G为220 nm,G-7-ADCA为260 nm。采用外标法绘制标准曲线对转化体系中的底物和产物进行定量分析。
2 结果与分析
2.1 转化体系中菌体浓度对转化的影响
全细胞转化体系中,菌体浓度对转化有一定的影响,菌体越多催化反应的酶越多,但并不是菌体量越大越有利于转化,因为转化过程需要氧气和a-酮戊二酸(图1),菌体量越大,对溶氧的要求越高。同时当体系中溶氧相对较低的时候,会限制细胞的TCA循环,减少a-酮戊二酸的供应。通过比较不同OD600对转化效率的影响,确定在OD600为45时,G-7-ADCA的产量最高。
2.2 转化过程中初始pH的影响
Gao等[9]利用棒状链霉菌进行转化时的最适pH为6.5,然而细菌与真菌具有不同的代谢环境,对于pH的要求也截然不同。另一方面,底物和产物的溶解性和pH有重要的关系,当产物G-7-ADCA的pH降低时,其溶解性也快速降低,直至析出,会影响反应的进行和产物的检测。我们以不同初始pH进行转化,结果pH 7.5的转化效率最高(图2)。然而,在pH为7的时候产量快速降低,说明酶的转化过程对pH是十分敏感的,在图6中,反应速度随时间延长降低,我们猜测部分原因是由pH降低引起的(初始pH为7.5,转化20 h后会降到6.5左右)。

图2 不同初始pH对转化的影响Fig.2 Effects of pH on the bioconversion.
2.3 转化底物中青霉素浓度
Jie等[11]及Goo等[12]在进行胞外和胞内转化实验时,使用的青霉素G浓度较低,最高只有12 mmol/L。我们使用的青霉素浓度较高,因此出现了一些新的状况,即底物抑制效应。如图3所示,在20 mmol/L开始,随底物浓度增加,产物浓度随着增加,而转化率却是一直降低,到达50 mmol/L后,G-7-ADCA的产量达到最高,随着底物浓度的增加,产物浓度逐渐降低。说明在青霉素G浓度为50 mmol/L的时候底物的促进作用和抑制作用达到平衡,虽然高浓度的底物会使反应速度加快,从经济实用的角度我们认为青霉素G浓度在50 mmol/L或更低的水平。
2.4 转化底物中MOPS的浓度
由于产物是有机酸,导致反应液pH下降。而扩环酶作用需要稳定的pH环境。Goo等[12]在实验中使用的缓冲液均为MOPS缓冲液。我们的预实验显示,MOPS比Tris-HCl和HEPE缓冲效果好。可能是因为MOPS在pH 7左右有较好的缓冲能力,维持了较适宜的扩环酶催化环境。不同浓度的MOPS缓冲液的缓冲能力不同,结果表明,100 mmol/LMOPS的缓冲效果最好(图4)。

图3 转化底物中青霉素G浓度对转化的影响Fig.3 Effects of penicillin G on the bioconversion.
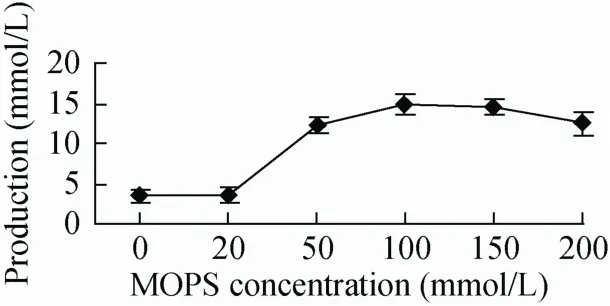
图4 转化底物中不同MOPS浓度对转化的影响Fig.4 Effects of MOPS on the bioconversion.
2.5 转化底物中葡萄糖浓度的影响
转化过程需要a-酮戊二酸作为底物。大肠杆菌中的a-酮戊二酸主要来源于TCA循环,而TCA循环需要葡萄糖推动。如图5所示,当葡萄糖浓度为0.5%时G-7-ADCA的产量最高,达16 mmol/L,而后随着葡萄糖浓度的增加底物浓度降低。我们检测到随着葡萄糖浓度增加乙酸的产量随着增加,我们猜测是乙酸的增加使pH降低从而间接地影响了G-7-ADCA的产量。
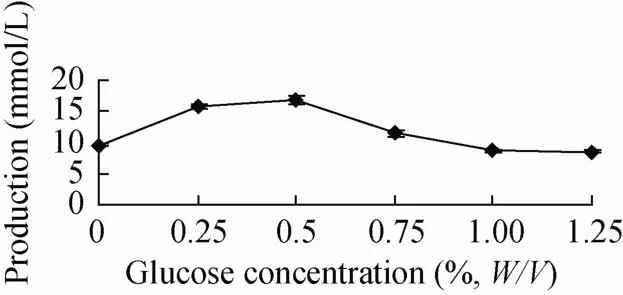
图5 转化底物中葡萄糖浓度的影响Fig.5 Effects of glucose on the bioconversion.
2.6 转化底物中二价铁离子浓度
Fe2+是青霉素扩环酶重要的辅因子[13],在转化反应中起重要的作用。对不同浓度的Fe2+进行优化,结果显示,在Fe2+浓度为0.9 mmol/L时即可达到最优的转化效率,随着Fe2+浓度的进一步增加,产物量不再增加。结果表明从0到3.6 mmol/L,产物增加不足5 mmol/L,说明Fe2+并不是影响转化的关键因素,在实验过程中我们发现,Fe2+会快速的氧化成3价并变为黄色沉淀,同时会形成胶体吸附一部分菌体,因此我们认为在转化过程中要限制Fe2+的添加。
2.7 二硫苏糖醇和抗坏血酸对转化的作用
在体外实验中,Jie及Cho等[11,14]均用到了二硫苏糖醇和抗坏血酸,结果显示,二者对转化过程有一定的促进作用。而Sim等[15]认为二硫苏糖醇和抗坏血酸对扩环酶起抑制作用。本研究中,初始转化条件下,在转化开始时分别加入二硫苏糖醇(DTT)和抗坏血酸,结果表明:本研究中,二硫苏糖醇和抗坏血酸均不是转化反应所必需的,且对反应有轻微的抑制作用。
2.8 转化反应的时间
利用前面实验得到最优的转化条件进行转化实验,考察转化时间对反应的影响。结果如图6所示,随着时间延长,反应速率逐渐降低,在转化进行17 h之后,反应速率由开始的3 mmol/(L·h)降低到约0.1 mmol/(L·h),考虑水分蒸发带来的浓度差异(200 μL体系,转化20 h水分蒸发12 μL),可以认为反应已经不再进行。因此,最优的转化时间为17 h。

图6 转化过程中产物浓度随时间变化Fig.6 Effects of the time of bioconversion.
3 结论
针对目前G-7-ADCA生产的高成本、高污染问题,利用生物转化法将廉价的底物青霉素G转化为G-7-ADCA,完全可以解决工业生产中高成本高污染的问题,在Jie及Sim等[11,15]的研究中,转化实验需要用到a-酮戊二酸、亚铁离子、DTT、抗坏血酸等,成分较为复杂,而对条件要求比较严格,如在Gao等[9]的研究中,pH和铁离子的最适浓度在极小的范围内,且G-7-ADCA的产量低,一般都在1 mmol/L以下,远远达不到工业生产的要求。
本实验室使用E.coli全细胞催化的方法进行生物转化,具有转化时间短、成本低与产量高的优点。最适反应条件如下:E.coli H7/PG15菌体浓度OD600为45、50 mmol/L青霉素G,0.5%葡萄糖,100 mmol/L MOPS(pH 7.5),0.9 mmol/L FeSO4,转化17 h,可以使G-7-ADCA产量(15 mmol/L)和转化率(30%)达到较高的水平。为全细胞催化生产G-7-ADCA的进一步研究和后期的发酵实验提供启示和参考。
REFERENCES
[1]Brown AG,Butterworth D,Cole M,et al.Naturallyoccurring beta-lactamase inhibitors w ith antibacterial activity.J Antibiot(Tokyo),1976,29(6):668–669.
[2]Cierpucha M,Panfil I,Danh TT,et al.Synthesis of 3-Substituted-clavams:antifungal properties,DD-peptidase and beta-lactamase inhibition.J Antibiot(Tokyo),2007,60: 622–632.
[3]Brotzu G.Richerche sudi un nuovo antibiotic.Cagliari: Lavori dell'istituto di Igiene di Cagliari,1948:1–11.
[4]Bovenberg RAL,Koekman BP,Schipper D.Process for the production of 7-ADCA via expandase activity on penicillin G:US,5731165.1995-06-02.
[5]Chauvette RR,Pennington PA,Ryan CW,et al.Chem istry of cephalosporin antibiotics.XXI.Conversion of penicillins to cephalosporin.J Org Chem,1971,36(9):1259–1267.
[6]Velasco J,Adrio JL,Moreno MA,et al.Environmentally safe production of 7-am inodeacetoxycephalosporanic acid (7-ADCA)using recombinant strains of Acremonium chrysogenum.Nat Biotechnol,2000,18:857–861.
[7]Bruggink A,Straathof AJJ,van der W ielen LAM.A'Fine' chem ical industry for life science products:green solutions to chem ical challenges.Adv Biochem Eng Biotechnol,2003, 80:69–113.
[8]Hsu JS,Yang YB,Deng CH,et al.Tsai.Fam ily shuffling of expandase genes to enhance substrate specificity for penicillin G.Appl Environ M icrobiol,2004,70:6257–6263.
[9]Gao Q,Piret JM,Adrio JL,et al.Performance of a recombinant strain of Streptomyces lividans for bioconversion of penicillin G to deacetoxycephalosporin G. J Ind M icrobiol Biotechnol,2003,30:190–194.
[10]Studier FW.Protein production by auto-induction in highdensity shaking cultures.Protein Expres Purif,2005,41: 207–234.
[11]Jie JJ,Yun TX,Qiang FK,et al.New strategy of site-directed mutagenesis identifies new sites to improve Streptomyces clavuligerus deacetoxycephalosporin C synthase activity toward penicillin G.Appl M icrobiol Biotechnol,2012,93(6):2395–2401.
[12]Goo KS,Chua CS,Sim TS.Relevant double mutations in bioengineered Streptomyces clavuligerus deacetoxycephalosporin C synthase result in higher binding specificities which improve penicillin bioconversion.Appl Environ M icrobiol, 2008,74:1167–1175.
[13]Robert PH.Fe(II)/α-Ketoglutarate-dependent hydroxylases and related enzymes.Crit Rev Biochem Mol,2004,39:21–48.
[14]Cho H,Adrio JL,Luengo JM,et al.Elucidation of conditions allow ing conversion of penicillin G and other penicillins to deacetoxycephalosporins by resting cells and extracts of Streptomyces clavuligerus NP1.Proc Natl Acad Sci USA,1998,95:11544–11548.
[15]Sim J,Sim TS.In vitro conversion of penicillin G and ampicillin by recombinant Streptomyces clavuligerus NRRL 3585 deacetoxycephalosporin C synthase.Enzyme M icrob Technol,2001,29:240–245.
(本文责编 陈宏宇)
Optim ization of whole-cell biocatalysis for phenylacetyl-7-am inodeacetoxycephalosporanic acid production
Jinheng Fu1,Jian Zhao1,Baixue Lin2,Yang Xu1,and Yong Tao2
1 Sino-Germany Joint Research Institute,Nanchang University,Jiangxi 330047,Nanchang,China 2 Institute of Microbiology,Chinese Academy of Sciences,Beijing 100101,China
Cephalosporins are w idely used antibiotics ow ing to their broad activity spectra and low toxicity.Many ofthese medically important compounds are made chem ically from 7-am inodeacetoxycephalosporanic acid.At present,this intermediate is made by synthetic ring-expansion of the inexpensive penicillin G to form G-7-ADCA,followed by enzymatic removal of the side chain to obtain 7-ADCA.The chem ical synthetic process is expensive,complicated and environmentally unfriendly.Environmentally compatible enzymatic process is favorable compared w ith chem ical synthesis. In our previous research,metabolic engineered Escherichia coli strain(H7/PG15)was constructed and used as whole-cell biocatalyst for the production of G-7-ADC w ith penicillin G as substrate.The whole-cell biocatalysis was studied by single factor experiment,including the composition of substrates and the conversion conditions(OD600,pH,concentration of penicillin G,MOPS,glucose,time and FeSO4).A fter optim ization,15 mmol/L of G-7-ADCA was obtained.The process is convenient,efficient and econom ic.This work would facilitate the industrial manufacturing and further product research.
phenylacetyl-7-aminodeacetoxycephalosporanic acid,whole-cell biocatalysis,biotransformation,conditions optim ization
February 24,2014;Accep ted:April 24,2014
Yang Xu.Tel:+86-791-8329479;E-mail:xuyang1951@163.com Yong Tao.Tel/Fax:+86-10-64807419;E-mail:taoyong@im.ac.cn
付金衡,赵健,林白雪,等.全细胞催化生产苯乙酰-7-氨基-3-脱乙酰氧基头孢烷酸的条件优化.生物工程学报,2014, 30(11):1781–1785.
Fu JH,Zhao J,Lin BX,et al.Optim ization of whole-cell biocatalysis for phenylacetyl-7-am inodeacetoxycephalosporanic acid production.Chin J Biotech,2014,30(11):1781–1785.
Supported by:The third Innovation Fund of“Industrial M icrobial Genomics Modification and Application”,Institute of M icrobiology,Chinese Academy of Sciences.
中国科学院微生物研究所第三批“工业微生物组学改造及应用”创新培育基金资助。
