通过N端引入芳香族氨基酸提高木聚糖酶的热稳定性
2014-06-24柏文琴杨鲁红马延和
柏文琴,杨鲁红,马延和
1 山西师范大学 生命科学学院,山西 临汾 041004
2 中国科学院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308
3 中国科学院微生物研究所 工业酶国家工程实验室,北京 100101
通过N端引入芳香族氨基酸提高木聚糖酶的热稳定性
柏文琴1,2,杨鲁红1,马延和2,3
1 山西师范大学 生命科学学院,山西 临汾 041004
2 中国科学院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308
3 中国科学院微生物研究所 工业酶国家工程实验室,北京 100101
耐热的木聚糖酶具有用于造纸、麻类脱胶和饲料生产等工业领域的巨大潜力,为了提高11家族碱性木聚糖酶Xyn11A-LC的热稳定性,通过理性设计在N-末端引入了芳香族氨基酸 (T9Y和D14F)。测定野生型和突变体的性质表明,突变体的最适反应温度和热稳定性均获得了提高。突变体的最适反应温度比野生型提高了5 ℃。野生型在65 ℃的Tris/HCl缓冲液 (pH 8.0) 中的半衰期为22 min,而突变体在此条件下的半衰期为106 min。圆二色光谱测定结果显示野生型和突变体的Tm分别为55.3 ℃和67.9 ℃。因此,通过在N-末端引入芳香族氨基酸可以提高11家族木聚糖酶的热稳定性和在高温下的活性。
木聚糖酶,热稳定性,芳香族氨基酸,疏水作用
木聚糖酶 (EC 3.2.1.8) 是降解植物细胞壁中半纤维素木聚糖的关键酶。由于具有应用于造纸、饲料生产、食品加工、麻类脱胶以及生物燃料开发等工业领域的潜力,木聚糖酶越来越引起人们的广泛关注[1]。在许多工业应用过程中,由于降温过程耗费能量且工艺繁琐,或者高温可以提高底物的溶解度、降低污染率等原因,嗜热的或耐热的木聚糖酶显示出很强的优势[1]。尽管目前分离了大量的木聚糖酶,但是大多数是中温酶。因此,需要通过蛋白质工程对酶进行分子改造,提高其嗜热和/或热稳定性。
目前,通过序列比对,晶体结构分析及突变研究,发现耐热木聚糖酶和非耐热木聚糖酶结构非常相似,热稳定性可能仅由大量的微小修饰累计造成[1]。这些修饰包括提高离子键和氢键数目[2-3]、增强分子内包装[2]、额外的疏水相互作用[4-6]、提高表面带电荷氨基酸数目及降低对化学变化敏感的氨基酸数目(Ser、Thr、Asn及Qln)[7-8]、 N-末端额外的β-链[2]、热稳定区的存在[9]、高比例的Ser/Thr及高含量的β-折叠[2]、在N-末端或C-末端或α-螺旋位置引入二硫键[10-12]。这些修饰可以加强分子内和/或分子间的相互作用,从而导致酶分子更加稳定。这些信息为提高木聚糖酶的分子改造提供了一定的理论指导。
11家族木聚糖酶N-末端的稳定对酶整体结构的稳定起重要作用。研究表明,用来源于褐色高温单孢菌Thermomonospora fusca的嗜热木聚糖酶TfxA的N-末端33个氨基酸替换来源于橄榄绿链霉菌Streptomyces olivaceovirdis的中温酶SoxB相应末端,会提高中温酶的热稳定性。进一步分析发现,热稳定性的提高主要由于N-末端的5个氨基酸的替换 (T11Y、N12H、N13D、F15Y和Y16F)[6]。
前期工作中,我们从芽胞杆菌Bacillus sp. SN5中分离了碱性中温木聚糖酶Xyn11A-LC,该酶是目前报道的具有最高催化活性的碱性木聚糖酶 (比活力为4511.9 U/mg),具有应用在工业领域尤其是纸浆助漂中的巨大潜力 (相关文章待发表)。其晶体结构已经解析 (PDB code:4IXL)[13]。通过与来源于T. fusca嗜热木聚糖酶TfxA的N-末端序列比对及结构分析,在Xyn11A-LC的N-末端引入芳香族氨基酸。突变体提高了酶在高温下的活性及热稳定性,更适合用于工业领域中。
1 材料与方法
1.1 材料
大肠杆菌Escherichia coli BL21 (DE3)和质粒pET28a购自Novagen公司,分别用作基因表达的宿主和载体。携带碱性木聚糖酶Xyn11A-LC基因的质粒作为定点突变的模板。限制性内切酶DpnⅠ和Pyrobest DNA聚合酶购自TaKaRa公司。底物山毛榉木聚糖购自Sigma公司。His·Bind纯化试剂盒购自Novagen公司。Quick Start™ Bradford蛋白检测试剂盒购自美国Bio-Rad公司。
1.2 方法
1.2.1突变位点的选择
用在线软件ClustalW2对Xyn11A-LC和来源于T. fusca嗜热木聚糖酶TfxA[14]进行N-末端序列的比对,寻找TfxA中对热稳定性起重要作用的5个氨基酸位点 (9Y、10H、11D、13Y和14F) 在Xyn11A-LC中对应的氨基酸位点。将其中存在的两个差异位点进行定点突变 (T9Y和D14F)。用Swiss-PdbViewer软件分析野生型和突变体的结构。用Pymol软件制作结构图片。
1.2.2定点突变
设计以上突变位点 (T9Y和D14F) 的突变引物,序列信息见表1。以携带Xyn11A-LC基因的质粒pET28a-Xyn11A-LC为模板[13],用高保真的Pyrobest聚合酶,PCR扩增全质粒实现定点突变。
PCR循环条件:预变性:95 2 min℃;扩增循环:95 35 s℃,58 1 min℃,循环16次;68 ℃延伸20 min。用1%琼脂糖凝胶电泳检测PCR产物。
1.2.3 PCR产物的转化
PCR产物用DpnI 37 ℃酶切过夜,80 ℃处理15 min使酶失活,化学转化法转入E. coli BL21(DE3)感受态细胞。挑取克隆测序验证。
1.2.4野生型及突变体酶的表达及纯化
将含有野生型和突变体基因的转化子分别在含有50 μg/mL卡那霉素的LB培养基中培养至OD600约0.6–0.8,加入终浓度为0.5 mmol/L IPTG继续诱导培养6 h。5 000 ×g离心10 min收集细胞,超声破碎后获得粗酶液。用His·Bind纯化试剂盒进行蛋白的纯化,具体步骤参照操作说明书。用12%的SDS-PAGE电泳检测纯化后的蛋白纯度。用Bio-Rad蛋白浓度测定试剂盒检测纯化后的蛋白浓度。℃,68 6.5 min
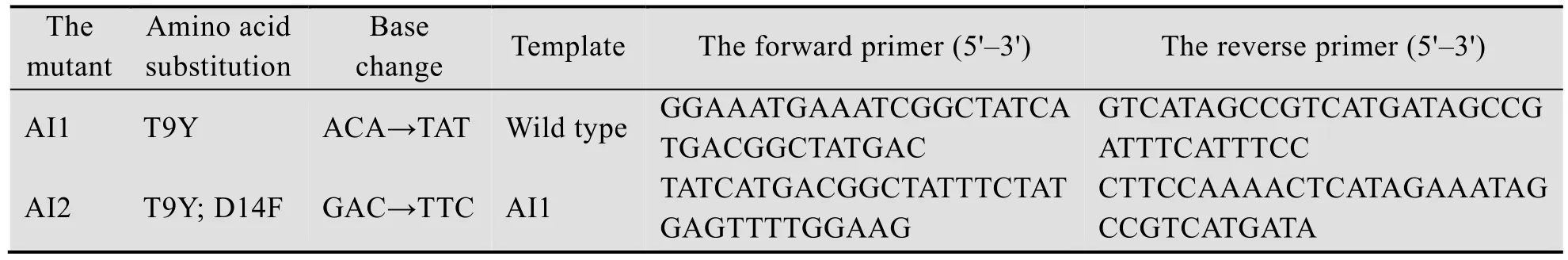
表1 定点突变引物序列Table 1 The primers in site-directed mutation
1.2.5野生型及突变体酶活性及热稳定性的测定
采用DNS法,具体参照文献[15]。底物溶液为用Na2HPO4/柠檬酸缓冲液 (pH 7.5) 配制1%浓度的山毛榉木聚糖。野生型和突变体的最适温度测定条件为,酶在50、55、60、65 ℃分别反应10 min。
野生型及突变体动力学参数测定条件:用Na2HPO4/柠檬酸缓冲液 (pH 7.5) 配制浓度分别1、2、4、6、8、10和12 mg/mL的山毛榉木聚糖,20 μL酶液 (1 μg/mL) 加入到480 μL上述不同浓度的底物溶液中,置于最适反应温度下反应5 min。用Graphpad Prism 5.0计算出Vmax和Km。
热失活的半衰期 (t1/2) 测定条件:将2 μg/mL的野生型或突变体蛋白,在Tris/HCl缓冲液 (pH 8.0) 中65 ℃保温不同时间取样,测定残余酶活。用Excel软件拟合热失活曲线,计算半衰期t1/2[6]。
用圆二色光谱仪 (英国光物理公司产品)测定野生型及突变体的Tm值。测定光谱范围为200–260 nm,温度范围为36–82 ℃。测定溶液为含有8 μmol/L蛋白样品的20 mmol/L Tris/HCl (pH 8.0)。实验数据的分析用Global 3™分析软件 (http://www.photophysics.com/software/global-3-analysis-software)。
2 结果与分析
2.1 突变位点的选择
将Xyn11A-LC与TfxA进行N-末端序列比对发现,对TfxA的热稳定性起重要作用的5个位点 (9Y、10H、11D、13Y和14F) 在Xyn11A-LC中对应的分别为9T、10H、11D、13Y和14F。5个氨基酸中有2个位点存在差异,即T9Y和D14F。因此,选择这两个位点定点突变。前期研究工作中已经解析了Xyn11A-LC的三维结构[15],我们利用野生型的结构分析两个位点突变后的突变体AI2的结构,发现这两个芳香族氨基酸分别位于β链B1和B2上,两个苯环中心距离为6.67 Å,可能存在芳香环的相互作用,见图1。因此,选定这两个突变位点 (T9Y和D14F),可能会增强β1-β2链之间的稳定性。
2.2 定点突变
利用PCR法扩增全质粒进行定点突变,获得突变体AI2 (T9Y和D14F) 的PCR产物,大小约为6 kb,与预测结果基本一致。PCR产物经DpnⅠ37 ℃酶切过夜并热处理使酶失活后,化学法转入E. coli BL21(DE3),测序验证了序列的正确。
2.3 野生型与突变体酶的表达和纯化
将转入野生型和突变体质粒的E. coli BL21(DE3)菌株,在0.5 mmol/L IPTG的诱导下,37 ℃培养6 h后,超声破碎获得粗酶液。用Ni柱亲和层析纯化,SDS-PAGE电泳检测纯化的效果见图2。从图中可以看出,尽管只采用Ni柱亲和层析纯化,但是得到电泳纯的野生型和突变体酶。目标条带与预期的分子量保持一致,突变体的分子量 (27.4 kDa) 略大于野生型 (27.3 kDa)。

图1 N-端芳香族氨基酸的引入结构图Fig. 1 Introduction of aromatic acid residues in the N-terminus.

图2 纯化的Xyn11A-LC及突变体的SDS-PAGE电泳图Fig. 2 SDS-PAGE analysis of the purified AI2 and Xyn11A-LC. M: the standard protein molecular mass markers; 1-2: the purified AI2 and Xyn11A-LC, respectively.
2.4 野生型和突变体酶的性质测定
2.4.1最适温度测定
为了测定野生型和突变体的最适反应温度,在相同的pH条件下,分别测定不同温度下的酶活性,以各自的最高酶活性为100%,计算相对酶活性。如图3所示,突变体AI2的最适温度都为60 ℃,比野生型提高了5 ℃。
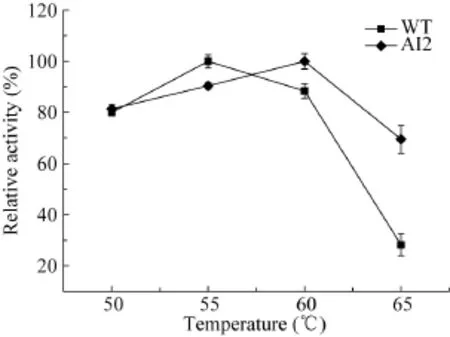
图3 温度对野生型及突变体AI2的活性影响Fig. 3 Effects of temperature on the activity of Xyn11A-LC and AI2.
2.4.2野生型和突变体的热稳定性半衰期测定
用Tris/HCl缓冲液 (pH 8.0) 将野生型和突变体稀释到相同浓度,分别置于65 ℃保温不同时间取样,测定残余酶活。用Excel软件拟合热失活曲线 (图4),计算出野生型和突变体的t1/2分别为22 min和106 min。说明N-末端芳香族氨基酸的引入大大提高了酶的热稳定性。
2.4.3野生型和突变体的Tm值测定
圆二色光谱结果显示野生型与突变体的AI2的Tm值分别为55.3 ℃和67.9 ℃,见图5和表2。与野生型相比较,突变体AI2的Tm值提高了12.6 ℃。这表明芳香族氨基酸的引入明显提高了热稳定性。
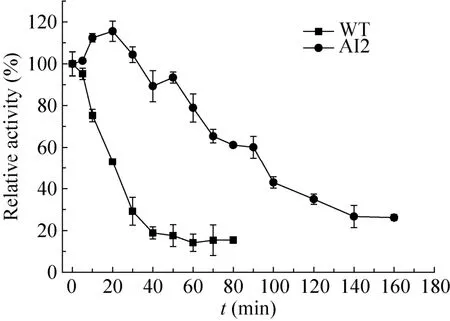
图4 Xyn11A-LC及突变体AI2在65 ℃、pH 8.0条件下的热失活曲线图Fig. 4 Thermal inactivation of Xyn11A-LC and AI2 at 65 ℃ and pH 8.0.
图5 圆二色光谱测定Tm值的蛋白变性拟合曲线图Fig. 5 The melting temperature measurement using CD spectroscopy.

表2 野生型和突变体的酶学性质比较Table 2 Comparison of the enzymatic properties of wild type Xyn11A-LC and the mutant
2.4.4野生型和突变体的动力学参数测定
野生型及突变体在各自最适反应条件下,以山毛榉木聚糖为底物,测定动力学参数,测定结果见表2。与野生型相比较,突变体AI2降低了催化活性。芳香族氨基酸的引入增加了酶分子的刚性,但是刚性增加的同时会造成酶活性的下降。此外,突变体的Km值下降为2.5 mg/mL,而野生型的Km值为3.3 mg/mL,表明突变体与底物的亲和力上升。推测可能引入的芳香族氨基酸在增强疏水作用的同时,还可能是潜在的与底物结合的位点。尽管突变体AI2的催化活性下降,但由于Km值也下降,导致其催化效率 (kcat/Km) 反而高于野生型。
3 讨论
理性设计是继DNA重组技术和定点突变技术之后发展的最早的蛋白质工程研究策略,至今仍广泛应用。理性设计需要蛋白的详细结构信息、结构与功能的关系。嗜热蛋白是通过结构的微小变化可以获得较高的稳定性。疏水作用、表面离子键、缩小疏水表面积和末端的稳定对嗜热蛋白的热稳定性起重要作用[16-19]。另外氢键、二硫键和金属离子结合力等分子内作用力,蛋白质的结构构型和氨基酸的组成对蛋白质的稳定性都有一定的影响[20-23]。蛋白嗜热机制的研究,为理性设计提高木聚糖酶热稳定性改造提供了一定的理论指导。
11家族木聚糖酶具有β-果冻卷 (β-jelly roll)折叠结构,这种结构由15个β-链形成两个互相缠绕的围绕催化中心的反向平行β-片层A和B。其C-末端包埋在β-片层的内部,而N-末端位于β-片层的侧面,直接暴露在亲水环境中,见图1。因此提高N-末端的稳定性对于酶的整体稳定性起重要作用。目前突变结果表明,在N-末端引入二硫键及疏水作用都可以提高11家族木聚糖酶的嗜热性[6,11]。来源于T. fusca的木聚糖酶TfxA是极少数的11家族嗜热酶之一[14]。Georis等以通过定点突变证明了TfxA的热稳定区主要在N-末端[4]。用TfxA的N末端序列替换来源于S. olivaceoviridis的中温木聚糖酶XynB的相应序列,融合蛋白的热稳定性明显提高[24-25]。近一步发现,N-末端的5个氨基酸对酶的稳定性起关键作用[6]。
前期研究中获得了11家族碱性木聚糖酶Xyn11A-LC,该酶是目前分离的具有最高催化活性的碱性木聚糖酶,具有应用于工业领域的巨大潜力。但是Xyn11A-LC为中温酶,最适反应温度55 ℃,在65 ℃时的半衰期仅22 min。为了提高酶的热稳定性,本文通过与嗜热酶TfxA的N-末端序列比对及结构分析,选定两个定点突变位点 (T9Y和D14F),构建了突变体AI2,分析突变体的结构发现,两个突变位点分别位于β链B1和B2上,二者可能通过形成疏水作用,增加N-末端B1和B2之间的稳定性,进而提高整个酶分子的稳定性。测定结果表明,突变体的最适温度和热稳定性获得明显的提高,但是催化活性下降。说明在增加蛋白分子的刚性的同时,酶分子的柔性下降,进而造成酶活性的下降。此外,突变体的Km值比野生型低,可能由于引入的芳香族氨基酸位于酶分子催化裂隙,是酶与底物结合的潜在位点,使底物在较高的温度下与酶的结合力提高,从而提高酶的嗜热性及热稳定性[4]。
REFERENCES
[1] Collins T, Gerday C, Feller G. Xylanases, xylanase families and extremophilic xylanases. FEMS Microbiol Rev, 2005, 29(1): 3–23.
[2] Hakulinen N, Turunen O, Janis J, et al. Three-dimensional structures of thermophilic beta-1,4-xylanases from Chaetomium thermophilum and Nonomuraea flexuosa. Comparison of twelve xylanases in relation to their thermal stability. Eur J Biochem, 2003, 270(7): 1399–1412.
[3] Gruber K, Klintschar G, Hayn M, et al. Thermophilic xylanase from Thermomyces lanuginosus: high-resolution X-ray structure and modeling studies. Biochemistry, 1998, 37(39): 13475–13485.
[4] Georis J, de Lemos Esteves F, Lamotte-Brasseur J, et al. An additional aromatic interaction improves the thermostability and thermophilicity of a mesophilic family 11 xylanase: structural basis and molecular study. Protein Sci, 2000, 9(3): 466–475.
[5] Harris GW, Pickersgill RW, Connerton I, et al. Structural basis of the properties of an industrially relevant thermophilic xylanase. Proteins, 1997, 29(1): 77–86.
[6] Zhang S, Zhang K, Chen X, et al. Five mutations in N-terminus confer thermostability on mesophilic xylanase. Biochem Biophys Res Commun, 2010, 395(2): 200–206.
[7] Turunen O, Vuorio M, Fenel F, et al. Engineering of multiple arginines into the Ser/Thr surface of Trichoderma reesei endo-1,4-beta-xylanase II increases the thermotolerance and shifts the pH optimum towards alkaline pH. Protein Eng, 2002, 15(2): 141–145.
[8] Umemoto H, Ihsanawati, Inami M, et al. Improvement of alkaliphily of Bacillus alkaline xylanase by introducing amino acid substitutions both on catalytic cleft and protein surface. Biosci Biotechnol Biochem, 2009, 73(4): 965–967.
[9] Zverlov V, Piotukh K, Dakhova O, et al. The multidomain xylanase A of the hyperthermophilic bacterium Thermotoga neapolitana is extremely thermoresistant. Appl Microbiol Biot, 1996, 45(1/2): 245–247.
[10] Turunen O, Etuaho K, Fenel F, et al. A combination of weakly stabilizing mutations with a disulfide bridge in the alpha-helix region of Trichoderma reesei endo-1,4-beta-xylanase II increases the thermal stability through synergism. J Biotechnol, 2001, 88(1): 37–46.
[11] Wang Y, Fu Z, Huang H, et al. Improved thermal performance of Thermomyces lanuginosus GH11 xylanase by engineering of an N-terminal disulfide bridge. Bioresour Technol, 2012, 112: 275–279.
[12] Wakarchuk WW, Sung WL, Campbell RL, et al. Thermostabilization of the Bacillus circulans xylanase by the introduction of disulfide bonds. Protein Eng, 1994, 7(11): 1379–1386.
[13] Bai W, Zhou C, Xue Y, et al. Three-dimensional structure of an alkaline xylanase Xyn11A-LC from alkalophilic Bacillus sp. SN5 and improvement of its thermal performance by introducing arginines substitutions. Biotechnol Lett, 2014, 36(7): 1495-1501.
[14] Irwin D, Jung ED, Wilson DB. Characterization and sequence of a Thermomonospora fusca xylanase. Appl Environ Microb, 1994, 60(3): 763–770.
[15] Bai WQ, Xue YF, Zhou C, et al. Cloning,expression and characterization of a novel salt-tolerant xylanase from Bacillus sp. SN5. Biotechnol Lett, 2012, 34(11): 2093–2099.
[16] Pace CN. Contribution of the hydrophobic effect to globular protein stability. J Mol Biol, 1992, 226(1): 29–35.
[17] Chan CH, Yu TH, Wong KB. Stabilizing salt-bridge enhances protein thermostability by reducing the heat capacity change of unfolding. PLoS ONE, 2011, 6(6): e21624.
[18] Connerton I, Cummings N, Harris GW, et al. A single domain thermophilic xylanase can bind insoluble xylan: evidence for surface aromatic clusters. Biochim Biophys Acta, 1999, 1433(1/2): 110–121.
[19] Gao SJ, Wang JQ, Wu MC, et al. Engineering hyperthermostability into a mesophilic family 11 xylanase from Aspergillus oryzae by in silico design of N-terminus substitution. Biotechnol Bioeng, 2013, 110(4): 1028–1038.
[20] Yu XW, Tan NJ, Xiao R, et al. Engineering a disulfide bond in the lid hinge region of Rhizopus chinensis lipase: increased thermostability and altered acyl chain length specificity. PLoS ONE, 2012, 7(10): e46388.
[21] Zheng B, Yang W, Zhao X, et al. Crystal structure of hyperthermophilic endo-beta-1,4-glucanase: implications for catalytic mechanism and thermostability. J Biol Chem, 2012, 287(11): 8336–8346.
[22] Zeng J, Gao X, Dai Z, et al. Effects of metal ions on stability and activity of hyperthermophilic pyrolysin and further stabilization of this enzyme by modification of a Ca2+-binding site. Appl Environ Microbiol, 2014, 80(9): 2763–2772.
[23] Mrabet NT, Van den Broeck A, Van den brande I, et al. Arginine residues as stabilizing elements in proteins. Biochemistry, 1992, 31(8): 2239–2253.
[24] Yang HM, Meng K, Luo HY, et al. Improvement of the thermostability of xylanase by N-terminus replacement. Chin J Biotech, 2006, 22(1): 26–32 (in Chinese).
杨浩萌, 孟昆, 罗会颖, 等. 通过N端替换提高木聚糖酶的热稳定性. 生物工程学报, 2006, 22(1): 26–32.
[25] Sun JY, Liu MQ, Xu YL, et al. Improvement of the thermostability and catalytic activity of a mesophilic family 11 xylanase by N-terminus replacement. Protein Expres Purif, 2005, 42(1): 122–130.
(本文责编 郝丽芳)
Improving thermal stability of xylanase by introducing aromatic residues at the N-terminus
Wenqin Bai1,2, Luhong Yang1, and Yanhe Ma2,3
1 School of Life Science, Shanxi Normal University, Linfen 041004, Shanxi, China
2 National Engineering Laboratory for Industrial Enzymes, Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
3 National Engineering Laboratory for Industrial Enzymes, Institute of Microbiology, Chinese Academy of Sciences, Beijing 100101, China
Thermophilic and alkalophilic xylanases have great potential in the pulp bleaching industry. In order to improve the thermal stability of an alkaline family 11 xylanase Xyn11A-LC, aromatic residues were introduced into the N-terminus of the enzyme by rational design. The mutant increased the optimum temperature by 5 ℃. The wild type had a half-time of 22 min at 65 ℃ and pH 8.0 (Tris-HCl buffer). Under the same condition, the mutant had the half-time of 106 min. CD spectroscopy revealed that the melting temperature (Tm) values of the wild type and mutant were 55.3 ℃ and 67.9 ℃, respectively. These results showed that the introduction of aromatic residues could enhance the thermal stability of Xyn11A-LC.
xylanase, thermal stability, aromatic residues, hydrophobic interaction
April 1, 2014; Accepted: May 19, 2014
Luhong Yang. Tel: +86-357-2051196; E-mail: ylh1010309@126.com
柏文琴, 杨鲁红, 马延和. 通过N端引入芳香族氨基酸提高木聚糖酶的热稳定性. 生物工程学报, 2014, 30(8):1217−1224.
Bai WQ, Yang LH, Ma YH. Improving thermal stability of xylanase by introducing aromatic residues at the N-terminus. ChinJ Biotech, 2014, 30(8): 1217−1224.
Supported by: Chinese Key Program of the Chinese Academy of Sciences (No. KSZD-EW-Z-015), National Natural Science Foundation of China (No. 31301245).
中国科学院重点部署项目 (No. KSZD-EW-Z-015), 国家自然科学基金 (No. 31301245) 资助。
时间:2014-05-21 网络出版地址:http://www.cnki.net/kcms/doi/10.13345/j.cjb.140194.html
