IR125和HDITCP在不同烷基链长阳离子离子液体中的光异构化动力学
2014-06-23袁树威于安池
袁树威 吕 荣 于安池
(中国人民大学化学系,北京100872)
1 引言
离子液体又称室温熔融盐,它完全由阴阳离子组成,是近些年来发展较为迅速的绿色溶剂.1-8与常规溶剂相比,它具有高粘度、高电导率、不易挥发等特点.离子液体具有很强的功能可调性,通过改变阴阳离子的种类,可以获得具有不同粘度、密度、极性或功能化的离子液体.目前,离子液体已被广泛地用于溶剂化、9-11转动扩散、11,12异构化、13,14电子转移、15,16质子转移17-19和自由基反应20-22等体系的研究.
光异构化过程在诸多生命过程中发挥着重要作用,如植物体系的光合作用23和动物视网膜的感光过程24均有光异构化过程的参与.光异构化过程在光记忆、25光敏生物开关、26生物传感器27等领域具有较好的应用与前景,因而受到了广泛关注.常规体系中的光异构化过程28-45已有较多报道.Fleming等29,32系统研究了1,1'-二乙基-4,4'-花菁碘化物(1144C)和3,3'-二乙基氧杂二羰花菁碘化物(DODCI)在不同醇类中的光异构化过程,Bieske等33研究了DTC+(DTC:3,3'-二乙基硫碳花菁碘化物)在气相中的光异构化过程,Sitzmann和Eisenthal30研究了DODCI在空气-水界面上的光异构化过程,Bhattacharyya等34,35研究了DODCI在胶束和反胶束体系中的光异构化过程,这些研究都表明体系的粘度会阻碍光异构化过程的发生.
然而,光异构化过程在具有高粘度的离子液体中的研究13,14,46-49并不是很多.Gangamallaiah和Dutt等13发现离子液体高度有序的结构性质可能会阻碍DODCI的光异构化过程,相比于醇类,DODCI在离子液体中的异构化活化能更高.Sarkar等46研究了DODCI在离子液体胶束体系、离子液体与常规溶剂的混合体系中的光异构化过程,发现体系粘度是影响光异构化速率的唯一因素,且光异构化速率随着粘度的增大而降低.Mali等14研究了DODCI和MC540在离子液体与甘油水溶液中的光异构化过程,发现MC540与离子液体间的相互作用也会影响其光异构化速率.
为了探究离子液体对光异构化过程的影响,我们选用了两个具有应用价值的近红外花菁染料分子,IR125和HDITCP(分子结构见图1),分别研究它们在具有不同烷基链长阳离子离子液体即1-乙基-3-甲基咪唑四氟硼酸盐([Emim][BF4])、1-丁基-3-甲基咪唑四氟硼酸盐([Bmim][BF4])、1-己基-3-甲基咪唑四氟硼酸盐([Hmim][BF4])、1-辛基-3-甲基咪唑四氟硼酸盐([Omim][BF4])和1-癸基-3-甲基咪唑四氟硼酸盐([Dmim][BF4])中的光异构化过程.同时,我们配制与各离子液体具有相似粘度的甘油水溶液,研究IR125和HDITCP在不同配比甘油水溶液中的光异构化过程,并与离子液体中的光异构化过程对比,获得离子液体中溶质-溶剂间特殊相互作用对它们各自光异构化过程的影响.

图1 IR125、HDITCP和离子液体的分子结构Fig.1 Chemical structures of IR125,HDITCP,and ionic liquids
2 实验部分
2.1 实验材料
IR125和HDITCP购自美国Exciton公司,使用前未经过处理.离子液体[Emim][BF4]、[Bmim][BF4]、[Hmim][BF4]、[Omim][BF4]和[Dmim][BF4]均购自中国科学院兰州化学物理研究所绿色化学和催化中心,纯度>99.0%.甘油购自中国百灵威公司,纯度>99.0%.
2.2 实验仪器和方法
稳态吸收光谱通过紫外可见吸收光谱仪(Cary-50,Varian,Australia)测得.稳态荧光光谱的测定是通过实验室自行搭建的稳态荧光装置,包括一个电荷耦合检测器(CCD)(Spec10:400B,Princeton Instruments,Acton,MA,USA)和一个作为激发光源(745 nm)的钛蓝宝石激光器(Spectra Physics,Mountain View,CA,USA).各体系中的荧光量子产率测定以IR125的二甲基亚砜(DMSO)溶液(荧光量子产率为0.13)50作为参比溶液,根据公式(1)求出.其中φf为荧光量子产率,I为荧光峰积分面积,A为吸光度,n是溶剂的折射率.

体系的荧光寿命由自己搭建的时间相关单光子计数(TCSPC)装置获得.时间相关单光子计数装置采用的激发光源是由钛蓝宝石飞秒激光放大器(Spectra Physics,Mountain View,CA,USA)泵浦的光学参量放大器(OPA)产生的频率为1 kHz,波长为680 nm,脉冲宽度为150 fs的激光.激光通过分束镜被分成两路,一部分直接经过衰减片衰减能量后进入一个光电二极管(TDA 200,PicoQuant GmbH,Berlin,Germany);另一部分经过聚焦照射在样品上产生荧光,荧光采取背向收集,通过单色仪(SP2358,Princeton Instruments,Acton,MA)后进入超快响应的单光子MPD光电二极管(PDM 50CT,Micro Photon Devices,Bolzano,Italy).然后两个信号同时传输到计算机中的TimeHarp 200(PicoQuant GmbH,Berlin,Germany)相关卡中,其中荧光信号作为开始信号,激光信号作为结束信号.为消除分子转动对荧光寿命的影响,实验过程中控制激发光的偏振为垂直,接收荧光的偏振方向为魔角(54.7°).通过该TCSPC实验装置,我们获得的仪器响应时间约为180 ps.
稳态吸收与荧光光谱以及TCSPC实验均在室温条件下进行.通过公式(2)-(5)获得各研究体系中花菁染料的辐射跃迁速率与非辐射跃迁速率.

其中Φf为荧光量子产率,τf为荧光寿命,kr为辐射跃迁速率,knr为非辐射跃迁速率.
3 结果与讨论
图2为近红外花菁分子IR125在不同烷基链长阳离子离子液体中的归一化稳态吸收和荧光光谱线型图.其中实线为归一化的吸收光谱线型,虚线为归一化的荧光光谱线型.稳态吸收与荧光光谱线型是通过文献51中讲述的方法获得的.归一化的稳态吸收和荧光光谱线型可以反映溶剂化理论中Franck-Condon跃迁的行为.表1给出了IR125在各离子液体中的最大吸收峰值、最大荧光峰峰值以及斯托克斯位移值等数据.从图2和表1中数据,可以发现IR125在离子液体中的吸收光谱线型随着离子液体阳离子取代基链长的增加发生了红移,而荧光光谱线型则变化不明显.
离子液体的极性改变或离子液体的折射率变化均可造成IR125在离子液体中吸收光谱的红移.但由于IR125为非极性溶剂化分子,51其在离子液体中的吸收光谱位移不应与离子液体的极性改变有关,而可能与离子液体的折射率改变有关.为了证实IR125在离子液体中吸收光谱的红移是由于离子液体的折射率改变造成的,我们研究了IR125在离子液体中的最大吸收峰值与各离子液体的非极性函数f0(n)或f1/2(n)的关系.其中非极性函数f0(n)和f1/2(n)分别为51


图2 IR125在离子液体中的稳态吸收(实线)与荧光(虚线)光谱线型图Fig.2 Normalized absorption(solid line)and fluorescence(dash line)line shape functions of IR125 in ionic liquids
表1 IR125在离子液体中的最大吸收峰值()、最大荧光峰峰值()及斯托克斯位移值(λSS)Table 1 Absorption maxima(),fluorescence maxima(),and Stokes shifts(λSS)of IR125 in ionic liquids

表1 IR125在离子液体中的最大吸收峰值()、最大荧光峰峰值()及斯托克斯位移值(λSS)Table 1 Absorption maxima(),fluorescence maxima(),and Stokes shifts(λSS)of IR125 in ionic liquids
η:viscosity
Solvent[Emim][BF4][Bmim][BF4][Hmim][BF4][Omim][BF4][Dmim][BF4]η/(mPa·s)45 77 174 223 320 n νmax 1.4122 1.4213 1.4277 1.4331 1.4369 λSS/cm-1 511±30 464±30 427±30 422±30 408±30 abs/cm-1 12781±20 12755±20 12733±20 12714±20 12694±20 νmaxfluo/cm-1 12375±20 12403±20 12410±20 12394±20 12400±20
图3和图4分别为IR125在离子液体中的最大吸收峰值随各离子液体的f0(n)和f1/2(n)值的变化关系图.IR125在各离子液体中的最大吸收峰值与相应离子液体的f0(n)或f1/2(n)值呈现出的良好线性关系(线性相关系数均大于0.99),表明IR125分子在各离子液体中发生的溶剂化过程为非极性溶剂化过程,即IR125分子在各离子液体中的吸收光谱红移是由于相应离子液体的折射率改变造成的.
为了研究IR125分子在离子液体中光异构化过程,我们首先以IR125的DMSO溶液为参比测定了IR125分子在各离子液体中的荧光量子产率(表2),其次通过TCSPC实验获得IR125在相应离子液体中的荧光寿命(表2),最后利用公式(4)和(5)计算获得IR125在各离子液体中的辐射跃迁速率与非辐射跃迁速率(表2).从表2中所列数据可以发现IR125分子在不同烷基链长阳离子离子液体中的荧光量子产率变化并不明显(均在0.15左右),且IR125分子在不同烷基链长阳离子离子液体中的荧光寿命变化也不大,随着阳离子取代基链长的增加仅稍有增加.通过计算获得的IR125在不同烷基链长阳离子离子液体中的辐射跃迁速率和非辐射跃迁速率的变化也不大.

图3 IR125在离子液体中的最大吸收峰值随非极性函数(f0(n))变化图Fig.3 Plots of absorption maxima versus nonpolar function(f0(n))for IR125 in ionic liquids

图4 IR125在离子液体中的最大吸收峰值随非极性函数(f1/2(n))变化图Fig.4 Plots of absorption maxima versus nonpolar function(f1/2(n))for IR125 in ionic liquids
IR125分子的非辐射跃迁过程主要包括从单线态到三线态的系间窜越过程和光异构化过程.但由于IR125的三线态产率很小(<0.01),可忽略不计,故IR125在各离子液体中的非辐射跃迁速率可以看作IR125的光异构化速率.图5为IR125在各离子液体中的非辐射跃迁速率与相应离子液体粘度的关系图.从图5中发现IR125在各离子液体中的光异构化速率并没有随着离子液体粘度的增大而明显减小.而众所周知,体系粘度越大,光异构化过程便越难发生,其光异构化速率也会相应减小.14,28,29,46这表明IR125与离子液体间强的静电相互作用可能掩盖了离子液体的粘度对IR125光异构化过程所造成的影响.
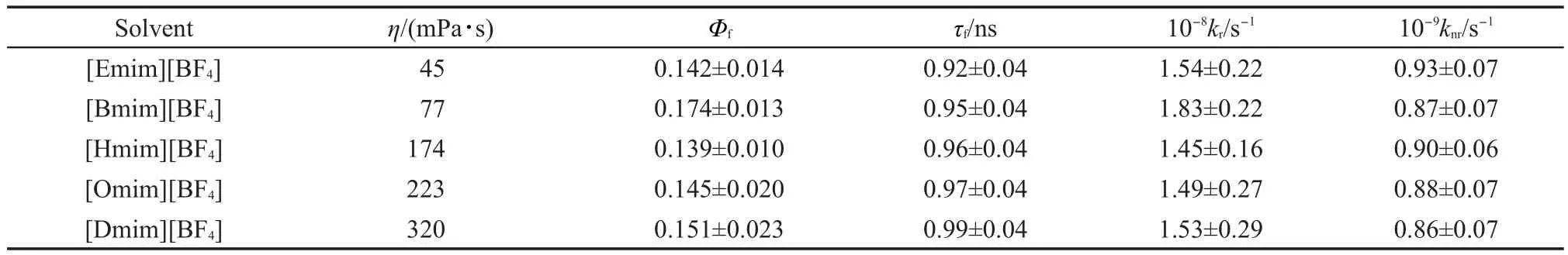
表2 IR125在离子液体中的荧光量子产率(Φf)、荧光寿命(τf)、辐射跃迁速率(kr)和非辐射跃迁速率(knr)Table 2 Quantum yields(Φf),fluorescence lifetimes(τf),radiative rate constants(kr),and nonradiative rate constants(knr)of IR125 in ionic liquids

图5 IR125在离子液体中的非辐射跃迁速率随离子液体粘度变化图Fig.5 Plots of knrversus η for IR125 in ionic liquids
为了确认离子液体的粘度对IR125光异构化速率的影响,我们配置了与各离子液体具有相同粘度的甘油水溶液,分别测得了IR125在不同配比甘油水溶液中的荧光量子产率和荧光寿命,见表3.同样通过测得的荧光量子产率和荧光寿命计算获得了IR125在不同配比甘油水溶液中的辐射跃迁速率和非辐射跃迁速率,见表3.我们发现在甘油水溶液中IR125的荧光量子产率较低,只有0.04左右,与离子液体中的荧光量子产率相比小了3-4倍.同时,IR125在甘油水溶液中的荧光寿命也较短,只有离子液体中的一半左右.与离子液体相比,IR125在甘油水溶液中的辐射跃迁速率减小了一半,非辐射跃迁速率增大了一倍左右.这与Mali等14观测到的部花菁540(MC540)的实验结果一致.
图6为IR125在各不同配比甘油水溶液中的非辐射跃迁速率与相应配比甘油水溶液粘度的关系图.从图6发现IR125在甘油水溶液中的光异构化速率随着体系粘度的增大而减小.这说明高粘度体系中粘度的变化同样会对IR125的光异构化过程造成影响,粘度的增大将阻碍光异构化过程的发生.在离子液体中没有发现IR125的光异构化速率随粘度变化而改变的原因是由于IR125与离子液体之间的静电相互作用对IR125的光异构化过程影响更大,掩盖了粘度改变所造成的影响.对比图5与图6发现,IR125在离子液体中的光异构化速率比它在甘油水溶液中的光异构化速率慢了2-3倍.通过公式(8)


表3 IR125在甘油水溶液中的荧光量子产率、荧光寿命、辐射跃迁速率和非辐射跃迁速率Table 3 Quantum yields,fluorescence lifetimes,radiative rate constants,and nonradiative rate constants of IR125 in aqueous glycerol solutions

图6 IR125在甘油水溶液中的非辐射跃迁速率随甘油水溶液粘度变化图Fig.6 Plots of knrversus viscosity for IR125 in aqueous glycerol solutions

图7 HDITCP在离子液体及甘油水溶液中的非辐射跃迁速率随溶液粘度变化图Fig.7 Plots of knrversus η for HDITCPin ionic liquids and aqueous glycerol solutions
我们获得IR125在离子液体中的光异构化能垒比IR125在甘油水溶液中的光异构化能垒增大了1.7-2.7 kJ·mol-1.这表明IR125与离子液体之间的静电相互作用是阻碍光异构化过程发生的一个重要因素.
HDITCP与IR125结构非常相似(图1).作为对比,我们同样研究了HDITCP在不同烷基链长阳离子离子液体中以及与各离子液体具有相似粘度的甘油水溶液中的光异构化过程.图7为HDITCP在不同烷基链长阳离子离子液体和不同配比甘油水溶液中的非辐射跃迁速率与相应离子液体和相应配比甘油水溶液粘度的关系图.同样我们发现HDITCP在离子液体中的光异构化速率比它在甘油水溶液中的光异构化速率慢了2-3倍,相应地HDITCP在离子液体中的光异构化能垒比它在甘油水溶液中的光异构化能垒高了2 kJ·mol-1左右.
4 结论
通过稳态吸收和荧光光谱以及时间相关单光子计数技术研究了两种近红外花菁分子IR125和HDITCP在不同烷基链长阳离子离子液体和不同配比甘油水溶液中的光异构化过程.我们发现IR125和HDITCP在甘油水溶液中的光异构化速率均随着体系的粘度增大而减小,而它们在离子液体中这种粘度对光异构化过程的影响会被花菁分子与离子液体之间的静电相互作用造成的影响所掩盖.IR125和HDITCP在离子液体中的光异构化速率比在它们等粘度的甘油水溶液慢了2-3倍,花菁分子与离子液体间的静电相互作用使花菁分子的光异构化过程的能垒增大2 kJ·mol-1左右.
(1) Hallett,J.P.;Welton,T.Chem.Rev.2011,111,3508.doi:10.1021/cr1003248
(2) Coleman,D.;Gathergood,N.Chem.Soc.Rev.2010,39,600.doi:10.1039/b817717c
(3) Petkovic,M.;Seddon,K.R.;Rebelo,L.P.;Silva Pereira,C.Chem.Soc.Rev.2011,40,1383.doi:10.1039/c004968a
(4) Jessop,P.G.;Jessop,D.A.;Fu,D.;Phan,L.Green Chem.2012,14,1245.doi:10.1039/c2gc16670d
(5)Wellens,S.;Thijs,B.;Binnemans,K.Green Chem.2012,14,1657.doi:10.1039/c2gc35246j
(6) Welton,T.Green Chem.2011,13,225.doi:10.1039/c0gc90047h
(7) Wilkes,J.S.Green Chem.2002,4,73.doi:10.1039/b110838g
(8) Li,H.;Bhadury,P.S.;Song,B.;Yang,S.RSC Adv.2012,2,12525.doi:10.1039/c2ra21310a
(9)Arzhantsev,S.;Ito,N.;Heitz,M.;Maroncelli,M.Chem.Phys.Lett.2003,381,278.doi:10.1016/j.cplett.2003.09.131
(10) Zhang,X.X.;Liang,M.;Ernsting,N.P.;Maroncelli,M.J.Phys.Chem.B2013,117,4291.doi:10.1021/jp305430a
(11) Ito,N.;Arzhantsev,S.;Maroncelli,M.Chem.Phys.Lett.2004,396,83.doi:10.1016/j.cplett.2004.08.018
(12) Gangamallaiah,V.;Dutt,G.B.J.Phys.Chem.B2013,117,12261.doi:10.1021/jp4078079
(13) Gangamallaiah,V.;Dutt,G.B.J.Chem.Phys.2011,135,174505.doi:10.1063/1.3656694
(14) Mali,K.S.;Dutt,G.B.;Mukherjee,T.J.Chem.Phys.2008,128,124515.doi:10.1063/1.2883954
(15)Koch,M.;Rosspeintner,A.;Angulo,G.;Vauthey,E.J.Am.Chem.Soc.2012,134,3729.doi:10.1021/ja208265x
(16)Li,X.;Liang,M.;Chakraborty,A.;Kondo,M.;Maroncelli,M.J.Phys.Chem.B2011,115,6592.doi:10.1021/jp200339e
(17) Rodrigues,C.A.;Graca,C.;Macoas,E.;Fedorov,A.;Afonso,C.A.;Martinho,J.M.J.Phys.Chem.B2013,117,14108.doi:10.1021/jp408616r
(18) Hayaki,S.;Kimura,Y.;Sato,H.J.Phys.Chem.B2013,117,6759.doi:10.1021/jp311883f
(19) Bhattacharya,B.;Samanta,A.J.Phys.Chem.B2008,112,10101.doi:10.1021/jp802930h
(20) Behar,D.;Gonzalez,C.;Neta,P.J.Phys.Chem.A2001,105,7607.doi:10.1021/jp011405o
(21) Grodkowski,J.;Neta,P.J.Phys.Chem.A2002,106,5468.doi:10.1021/jp020165p
(22) Brooks,C.;Doherty,A.P.J.Phys.Chem.B2005,109,6276.doi:10.1021/jp040554e
(23) Song,L.;Elsayed,M.A.;Lanyi,J.K.Science1993,261,891.doi:10.1126/science.261.5123.891
(24) Gai,F.;Hasson,K.C.;McDonald,J.C.;Anfinrud,P.A.Science1998,279,1886.doi:10.1126/science.279.5358.1886
(25) Hayakawa,R.;Higashiguchi,K.;Matsuda,K.;Chikyow,T.;Wakayama,Y.ACS Appl.Mater.Interfaces2013,5,11371.doi:10.1021/am403616m
(26) Goulet-Hanssens,A.;Barrett,C.J.J.Polym.Sci.Part A:Polym.Chem.2013,51,3058.doi:10.1002/pola.26735
(27)Zhang,Z.;Wang,Y.;Yan,F.;Peng,D.;Ma,Z.Chin.J.Chem.2011,29,153.doi:10.1002/cjoc.v29.1
(28) Sundstroem,V.;Glllbro,T.J.Phys.Chem.1982,86,1788.doi:10.1021/j100207a012
(29)Velsko,S.P.;Waldeck,D.H.;Fleming,G.R.J.Chem.Phys.1983,78,249.doi:10.1063/1.444549
(30) Sitzmann,E.V.;Eisenthal,K.B.J.Phys.Chem.1988,92,4579.doi:10.1021/j100327a004
(31) Vaveliuk,P.;Scaffardi,L.B.;Duchowicz,R.J.Phys.Chem.1996,100,11630.doi:10.1021/jp953618h
(32)Xu,Q.H.;Fleming,G.R.J.Phys.Chem.A2001,105,10187.doi:10.1021/jp011924r
(33)Adamson,B.D.;Coughlan,N.J.;da Silva,G.;Bieske,E.J.J.Phys.Chem.A2013,117,13319.
(34) Datta,A.;Mandal,D.;Pal,S.K.;Bhattacharyya,K.Chem.Phys.Lett.1997,278,77.doi:10.1016/S0009-2614(97)00979-2
(35) Pal,S.K.;Datta,A.;Mandal,D.;Bhattacharyya,K.Chem.Phys.Lett.1998,288,793.doi:10.1016/S0009-2614(98)00353-4
(36)Heilemann,M.;Margeat,E.;Kasper,R.;Sauer,M.;Tinnefeld,P.J.Am.Chem.Soc.2005,127,3801.doi:10.1021/ja044686x
(37) Jia,K.;Wan,Y.;Xia,A.;Li,S.;Gong,F.J.Phys.Chem.A2007,111,1593.doi:10.1021/jp067843i
(38)Redmond,R.W.;Kochevar,I.E.;Krieg,M.;Smith,G.;McGimpsey,W.G.J.Phys.Chem.A1997,101,2773.doi:10.1021/jp963001f
(39) Lee,H.;Berezin,M.Y.;Henary,M.;Strekowski,L.;Achilefu,S.J.Photochem.Photobiol.A:Chem.2008,200,438.doi:10.1016/j.jphotochem.2008.09.008
(40)Dempsey,G.;Bates,M.;Kowtoniuk,W.E.;Liu,D.R.;Tsien,R.Y.J.Am.Chem.Soc.2009,131,18192.doi:10.1021/ja904588g
(41) Jee,A.Y.;Park,S.;Lee,M.Phys.Chem.Chem.Phys.2011,13,15227.doi:10.1039/c1cp20835g
(42) Wei,Z.;Nakamura,T.;Takeuchi,S.;Tahara,T.J.Am.Chem.Soc.2011,133,8205.doi:10.1021/ja110716b
(43) Dunkelberger,A.D.;Kieda,R.D.;Shin,J.Y.;Rossi Paccani,R.;Fusi,S.;Olivucci,M.;Crim,F.F.J.Phys.Chem.A2012,116,3527.doi:10.1021/jp300153a
(44) Wurth,C.;Pauli,J.;Lochmann,C.;Spieles,M.;Resch-Genger,U.Anal.Chem.2012,84,1345.doi:10.1021/ac2021954
(45) Tatikolov,A.S.;Akimkin,T.M.;Pronkin,P.G.;Yarmoluk,S.M.Chem.Phys.Lett.2013,556,287.doi:10.1016/j.cplett.2012.11.097
(46) Ghosh,S.;Mandal,S.;Banerjee,C.;Rao,V.G.;Sarkar,N.J.Phys.Chem.B2012,116,9482.doi:10.1021/jp305095n
(47) Ivanov,D.A.;Petrov,N.K.;Klimchuk,O.;Billard,I.Chem.Phys.Lett.2012,551,111.doi:10.1016/j.cplett.2012.09.024
(48) Tamura,H.;Arai,T.Chem.Lett.2011,40,594.doi:10.1246/cl.2011.594
(49)Asaka,T.;Akai,N.;Kawai,A.;Shibuya,K.J.Photochem.Photobiol.A:Chem.2010,209,12.doi:10.1016/j.jphotochem.2009.10.002
(50) Soper,S.A.;Mattingly,Q.L.J.Am.Chem.Soc.1994,116,3744.doi:10.1021/ja00088a010
(51)Yu,A.;Tolbert,C.A.;Farrow,D.A.;Jonas,D.M.J.Phys.Chem.A2002,106,9407.doi:10.1021/jp0205867
