覆盆子总黄酮超声波提取工艺响应面法优化及其抗氧化特性研究
2014-06-23邬玉芬喻卫武
邬玉芬,吴 俊,喻卫武*
(1.宁海县林特技术推广总站,浙江 宁海 315600;2.浙江农林大学,浙江 杭州 311300)
覆盆子为蔷薇科悬钩子属植物的果实,其干燥成熟果实为常用中药,性甘、酸、温,归肝、肾、膀胱经,益肾固精缩尿,养肝明目,用于遗精滑精,遗尿尿频,阳痿早泄,目暗昏花[1]。成熟果实是新型高营养的野生或半野生果品,用于食疗和保健,是高营养、高抗性、无污染的绿色新型第3代水果。主产自浙江、江苏、安徽、江西、福建、广西等省。生长在阳光较充足、海拔400~800m的山坡灌丛和林缘现代研究表明[2],覆盆子含有萜类、黄酮、甾醇、氨基酸等化学成分,具有抑菌、抗氧化、壮阳兴痿、健脑益智、美容养颜、防治癌症的作用,同时还有保护或提高视力、减肥等功效[3~6]。文献中对黄酮类化合物成分的抗氧化作用研究报道较多[7~10]。
超声提取具有提取时间短、温度较低、收率高的优点[11~13]。目前,关于超声提取覆盆子黄酮化合物的工艺研究较少。本研究采用响应面法优化超声提取覆盆子总黄酮的最佳提取工艺,并分析了总黄酮对羟自由基(OH·)及超氧阴离子自由基(O2-·)的清除率,以期得到较优提取工艺和覆盆子总黄酮的抗氧化特性,为覆盆子进一步开发利用打下基础。
1 材料与仪器
试验所用覆盆子于2011年5月20日采自台州仙居县横溪镇,经浙江农林大学何福基教授鉴定为华东覆盆子(Rubus chingii)。
芦丁(生化试剂,上海晶纯试剂有限公司);乙醇、亚硝酸钠、硝酸铝、氢氧化钠、过氧化氢、水杨酸、盐酸、硫酸亚铁、硫代硫酸钠等化学试剂均为分析纯(AR)。
FA2104N电子天平(上海精密科学仪器有限公司);UV-2100紫外分光光度计(尤尼柯上海仪器有限公司);FW-型高速万能粉碎机(北京中信伟业科技公司);KQ-250B超声仪(昆山市超声仪器有限公司)。
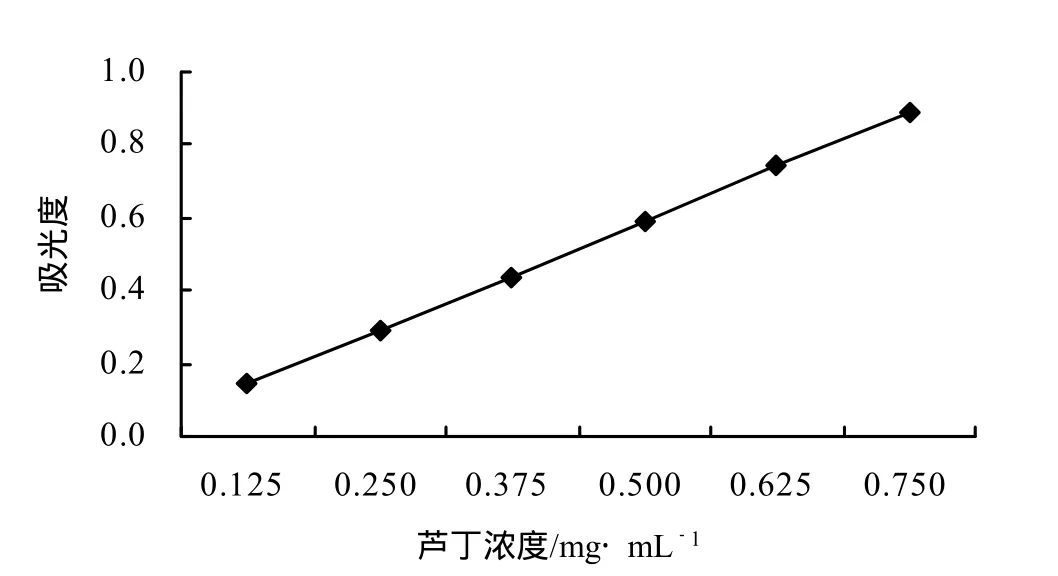
图1 芦丁的标准曲线

表1 响应面分析因素与水平
2 方法
2.1 标准曲线的制备
准确称取芦丁标准品25.00mg于100m L量瓶中,加入少量80%乙醇,超声溶解后定容到刻度,得芦丁标准溶液。精确量取芦丁对照品溶液0.5、1.0、1.5、2.0、2.5、3.0m L分别置于10m L的比色管中,加5%NaNO2溶液0.4m L,摇匀,放置6min;然后各加10%的Al(NO3)3溶液0.4m L摇匀,放置6min;然后各加4%的NaOH溶液4 m L摇匀,最后用水稀释到刻度,混匀,放置15 m in,以80%乙醇同法处理为参比,在最大吸收波长510 nm处测定吸收光度值A。以A为纵坐标,浓度C为横坐标绘制标准曲线,得回归方程A=0.948 57C-0.003 1,R²=0.999 6,在考查范围内呈良好的线性关系。
2.2 覆盆子总黄酮提取和测定
称取覆盆子粉末约5 g置于烧杯中,再加入乙醇,将烧杯置于已经设定好超声时间和温度的超声仪中进行超声提取。超声完毕将提取溶液过滤,80%乙醇定容至100m L,移取2m L置于10m L容量瓶中,80%乙醇定容备用。按照2.1标准曲线制备项下操作,测供试液的吸光值,结果以3次测定的平均值计。
2.3 响应面法中心试验的试验设计
采用响应面法来优化影响用超声辅助提取覆盆子总黄酮提取率的参数,根据Box-Behnken的中心组合实验设计原理[12],选取超声时间、料液比及超声温度三个因素,采用三因素三水平分析法,分析因素及水平设计见表1。
2.4 覆盆子总黄酮的抗氧化性测定
2.4.1 覆盆子总黄酮对羟自由基清除率的测定 采用紫外分光光度法[14]测定总黄酮对羟自由基(OH·)的清除率。取5支具塞试管依次向其中各加入2.0mmol/L的FeSO42.0m L、1.0mmol/L的H2O22.0m L振荡,摇匀。再加入6.0mmol/L的水杨酸3.0m L,摇匀,于37℃水浴加热20m in,加热完毕于510 nm 波长处分别测定吸光度A0。之后分别向5支试管中加入待试样品0.2、0.4、0.6、0.8、1.0m L,接着再分别添加超纯水0.8、0.6、0.4、0.2、0.0m L,摇匀,继续水浴加热20min,待加热完毕后再次分别测其吸光度Ax。对照实验:用2.0m L蒸馏水取代H2O2溶液,重复上述过程,测吸光度,则样品对羟自由基的清除率计算见以下公式:
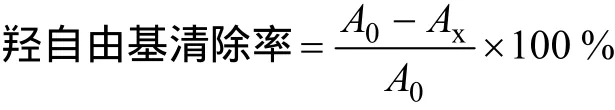
2.4.2 覆盆子总黄酮对超氧阴离子自由基(O2-·)清除率的测定 采用紫外分光光度法对总黄酮O2-·的清除率进行测定。取6支试管,分别编号为0、1、2、3、4、5,各加入4.5m L pH8.2的50mmol/L Tris-HCl缓冲液,再分别加入黄酮提取液0.0、0.2、0.4、0.6、0.8、1.0m L,然后依次加蒸馏水1.0、0.8、0.6、0.4、0.2、0.0m L,混匀后在25℃恒温水浴中保温20min,取出后立即加入在25℃预热过的3mmol/L邻苯三酚溶液0.3m L(以10 mmol/L HCl溶液配制)。5m in后加4滴10mol/L盐酸终止反应。以管0为空白,测其他样品在325 nm处的吸光度。按照以下公式计算各质量浓度总黄酮提取液对O2-·的清除率。
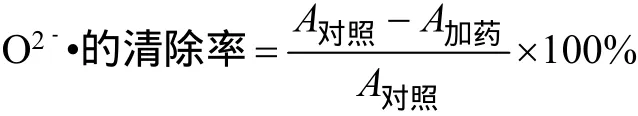
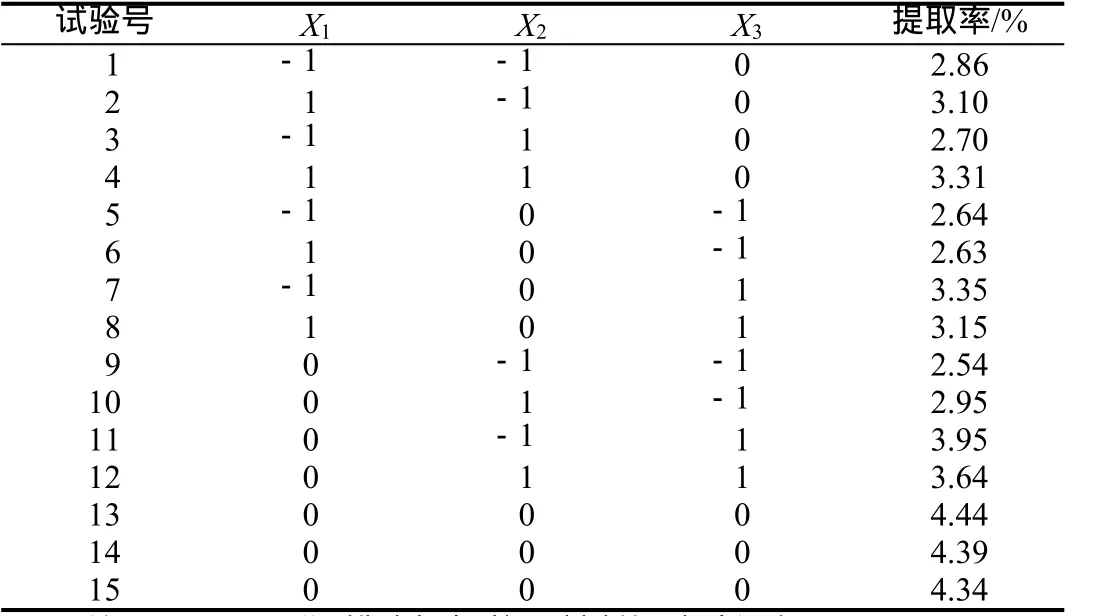
表2 响应面分析方案及试验结果
3.1 响应面法优化覆盆子总黄酮提取工艺
对覆盆子总黄酮超声提取工艺进行响应面分析,试验方案见表2。15个试验分为析因点和零点,试验号1~12是析因试验,13~15是中心试验。其中析因点为自变量取值在X1,X2,X3所构成的三维定点,零点区域为中心点,零点试验重复3次,以估计试验误差。
采用Design Expert7.0.0软件对中心组合试验数据进行回归分析,结果见表3。以覆盆子总黄酮得率为响应值,经回归拟合后,得到回归方程:

回归方程中各变量对指标(响应值)影响的显著性,由F检验来判定,概率P(F>Fα)的值越小,则相应变量的显著程度越高。
由表3可知,上述回归方程在描述各因子与响应值之间的关系时,其因变量和全体自变量之间的线性关系显著(R2=0.961 8)。说明该回归方程对试验拟合情况好,可以很好地描述各因素与响应值之间的真实关系。在一次项和二次项中都有显著性因素,因此各试验因子对响应值的影响不是简单的线性关系。响应值Y与X3,,2呈极显著相关,与X呈显著相关。
响应面图形是响应值Y对各试验因子X1、X2、X3所构成的三维空间曲面图,从响应面图上可清晰地看出最佳参数及各参数之间的相互作用关系。当特征值为正值时的响应面分析图为山谷形曲面,可以得到极小值;当特征值为负值时则为山丘曲面,有极大值存在;当特征值有正有负时为马鞍形曲面,无极值存在。由图2、图3、图4可较为直观地看出各因素对覆盆子总黄酮得率的影响,曲线越陡峭,表明该因素对覆盆子总黄酮得率的影响越大,响应值的变化亦愈大。由等值线图可以看出存在极值的条件应该在圆心处。
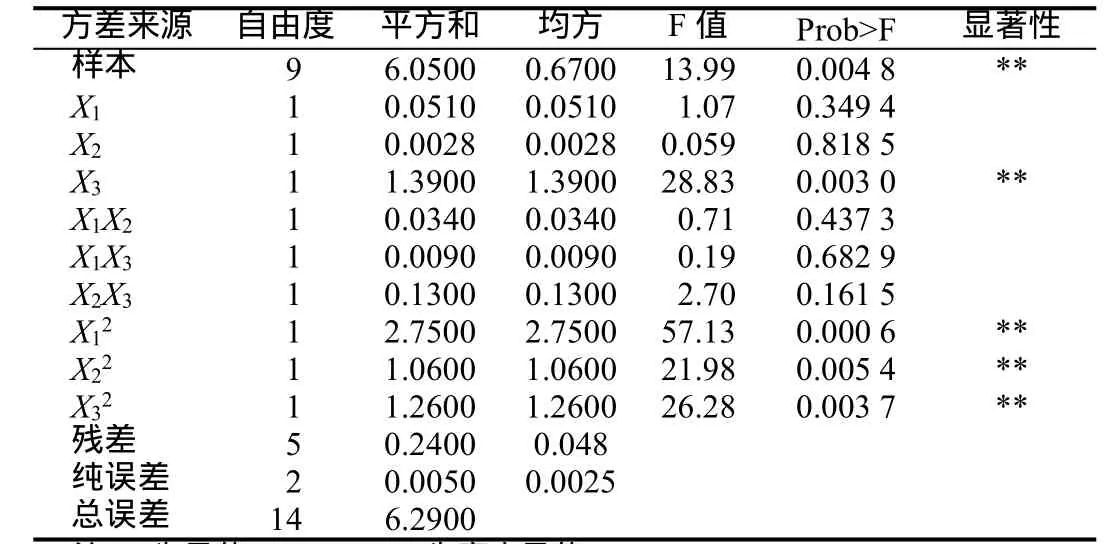
表3 总黄酮提取参数数学回归分析结果

图2 提取时间与液料比对得率影响的响应面与等值线

图3 提取时间与提取温度对得率影响的响应面与等值线

图4 液料比与提取温度对得率影响的响应面与等值线
对回归方程求一阶偏导数,解得X1=0.04,X2=0.35,X3=0.23,代入变换公式即得提取时间91.2min,液料比33.5:1,提取温度42.3℃,此条件下覆盆子总黄酮的得率预测值为4.81%。采用优化条件进行提取试验,实际得率为4.52%,与理论预测值基本吻合。
3.2 覆盆子总黄酮抗氧化性的测定
3.2.1 覆盆子总黄酮对羟自由基的清除作用 羟基自由基是一种较活泼的氧自由基粒子,具有反应活性强、毒性大等特点。它可以与生物体内的多种物质发生高效、快速的反应,导致生物机体的损伤和各种病变发生。研究表明黄酮类化合物主要通过清除自由基作用,有效阻止脂质过氧化引起的细胞破坏。由表4可以看出,覆盆子总黄酮对羟自由基有较好的清除率,在12.75~51.00mg/L的范围内随着总黄酮浓度的增大清除作用明显增强,在黄酮浓度大于51.00mg/L后清除率趋于恒定。

表4 覆盆子总黄酮对羟自由基的清除率
3.2.2 覆盆子总黄酮对超氧阴离子自由基的清除作用 O2-·是氧气在生物体内的电子传递和一些生物分子的还原作用下得到一个电子而生成的,有着很强的活性,可直接导致细胞内的DNA损伤,还能转化为氧化性更强的羟基自由基,从而引发含有大量不饱和脂肪酸的细胞膜的脂质过氧化,形成链式反应,破坏膜结构,造成细胞损伤。由表5可以看出,覆盆子总黄酮对超氧阴离子自由基有一定的清除率,在8.51~34.24mg/L的范围内随着总黄酮质量浓度的增大清除作用显著增大,在黄酮浓度大于34.24mg/L后清除率增加趋势减缓。
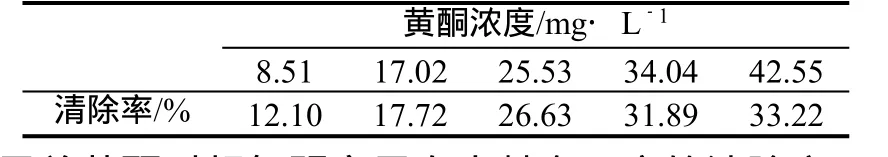
表5 覆盆子总黄酮对超氧阴离子自由基的清除率
4 讨论
本试验响应面分析法考察了超声提取时间、液料比、提取温度对覆盆子总黄酮提取率的影响,建立了影响黄酮提取率的二次多项数学模型,依据回归分析结果可知,覆盆子总黄酮超声提取最佳条件为提取时间 91.2m in,液料比33.5:1,提取温度42.3℃,总黄酮的得率预测值为4.81%。通过验证实验,实际得率为4.52%,与理论预测值基本吻合。对覆盆子总黄酮抗氧化研究表明:覆盆子总黄酮对羟自由基和超氧阴离子自由基都有一定的清除率,并在一定范围内随着黄酮质量浓度的增大而增大。随着植物提取物抗氧化活性研究不断的深入,越来越多的有抗氧化活性物质被应用到化妆品、保健品和药品领域,表现出了广阔的开发前景。通过本实验证明覆盆子总黄酮具有较强的羟自由基和超氧阴离子自由基清除率。因此,本实验可以为覆盆子总黄酮的提取和在化妆品、保健品和药品等领域进一步开发利用提供参考。
[1]中国药典第一部[S].北京,2010.
[2]汪传佳,徐小静,康志雄,等.覆盆子资源开发利用研究综述[J].浙江林业科技,2004,24(1):66-69.
[3]肖洪明,祖灵博,李石平,等.掌叶覆盆子化学成分的研究[J].中国药物化学杂志,2011,21(3):220-226.
[4]伍淑文,樊柏林,刘晓燕,等.湖北掌叶覆盆子叶营养和植物化学物成分分析[J].公共卫生与预防医学,2012,23(2):44.
[5]侯忠杰,齐善厚,张家瑞.覆盆子黄酮萃取分析[J].食品研究与开发,2012,33(10):67-70.
[6]孙金旭.覆盆子干果黄酮提取研究[J].食品研究与开发,2012,33(9):14-17.
[7]曹晓霞,李翠芹,王喆之.翅茎香青中黄酮物质的提取及其抗氧化活性研究[J].现代生物医学进展,2008,8(4):691-693.
[8]周晔,李一峻,陈强,等.覆盆子等8味中药的抗超氧阴离子自由基作用研究[J].时珍国医国药,2004,15(2):68-69.
[9]杨润亚,明永飞,王慧.无花果叶中总黄酮的提取及其抗氧化活性测定[J].食品科学,2010(16):78-82.
[10]郭增军,谭林,徐颖,等.小丛红景天总黄酮抗氧化活性研究[J].中药材,2011,34(1):104-107.
[11]郭孝武.超声提取分离[M].化学工业出版社,2008.
[12]鄢贵龙,纪丽莲,罗玉明,等.超声-微波协同提取野马追中抗氧化活性成分[J].南京工业大学学报(自然科学版),2013,35(1):71-75.
[13]Wu Q,Wang M,Simon JE.Determ ination of isoflavones in red cloverand related speciesby high-performance liquid chromatography combinedw ith ultravioletandmassspectrometric detection[J].JChromatogr A,2003,1016(2):195-209.
[14]张海悦,张守媛.响应面优化黑葵花籽壳中黄酮的提取及抗氧化性研究[J].中国酿造,2011(9):44.
