限制性内切酶酶切确证河豚鱼成分PCR检测结果
2014-06-21曲良苗陈文炳缪婷玉邵碧英江树勋
曲良苗,陈文炳*,缪婷玉,邵碧英,彭 娟,江树勋
(1.福建出入境检验检疫局检验检疫技术中心,福建 福州 350001;2.福建农林大学食品科学学院,福建 福州 350003);3.福建省检验检疫技术研究重点实验室,福建 福州 350001)
自1980年代聚合酶链式反应(polymerase chain reaction,PCR)技术发明以来,已被广泛应用于食品中的动植物成分鉴别[1-8],在鱼制品鱼类成分的鉴别中的应用也越来越多[9-11],DNA分子标记技术在河豚鱼种类鉴别及遗传分析方面也有不少报道[12-22]。但普通PCR方法存在扩增结果出现假阳性的可能,如果PCR扩增所使用的引物序列与非目的物种的某段DNA的序列有部分互补性,就会扩增出与目的物种大小相似的PCR产物,仅靠凝胶电泳图谱判断,可能因假阳性结果而产生误判[23],因此有必要采取确证措施加以排除。目前常用的PCR检测结果的确证方法主要有DNA限制性内切酶技术与DNA测序方法[24-25]。
我国海域广阔,河豚鱼种类繁多,鱼类加工食品中因混有河豚鱼,使得消费者误食而中毒的事件时有发生,2007年发生了由于出口美国的鮟鱇鱼混有河豚鱼,导致顾客误食而中毒的事件,这些事件对我国食品出口贸易造成负面影响。同年日本食品检验部门在我国南方某食品有限公司出口的马面鲀鱼干中检出河豚鱼成分。为了保证消费者的健康与权益,保障水产加工制品的质量与安全,急需一种能够在食品中快速检测出河豚鱼成分的方法。本研究基于作者于2011年建立的河豚鱼成分检测PCR方法[22]检测河豚鱼与其他样品,发现在金枪鱼与鲈鱼中也能扩增出与河豚鱼DNA片段大小(423 bp)接近的PCR产物,产生了假阳性结果。因此,本实验应用限制性内切酶与DNA测序方法,分析了13 种河豚鱼样品与2 种非河豚鱼(金枪鱼与鲈鱼)的PCR结果的差别,建立了有效的排除假阳性结果的方法,并将PCR产物测序结果在GenBank中进行DNA同源性查询比对(BLAST)加以确证,为准确鉴定河豚鱼成分提供科学依据。
1 材料与方法
1.1 材料
9 个已知物种名称的河豚鱼样品、4 个未知种类的河豚鱼样品、5 个非河豚鱼样品(表1)搜集自福建省莆田、厦门、福州等地水产养殖场、农贸市场和超市。
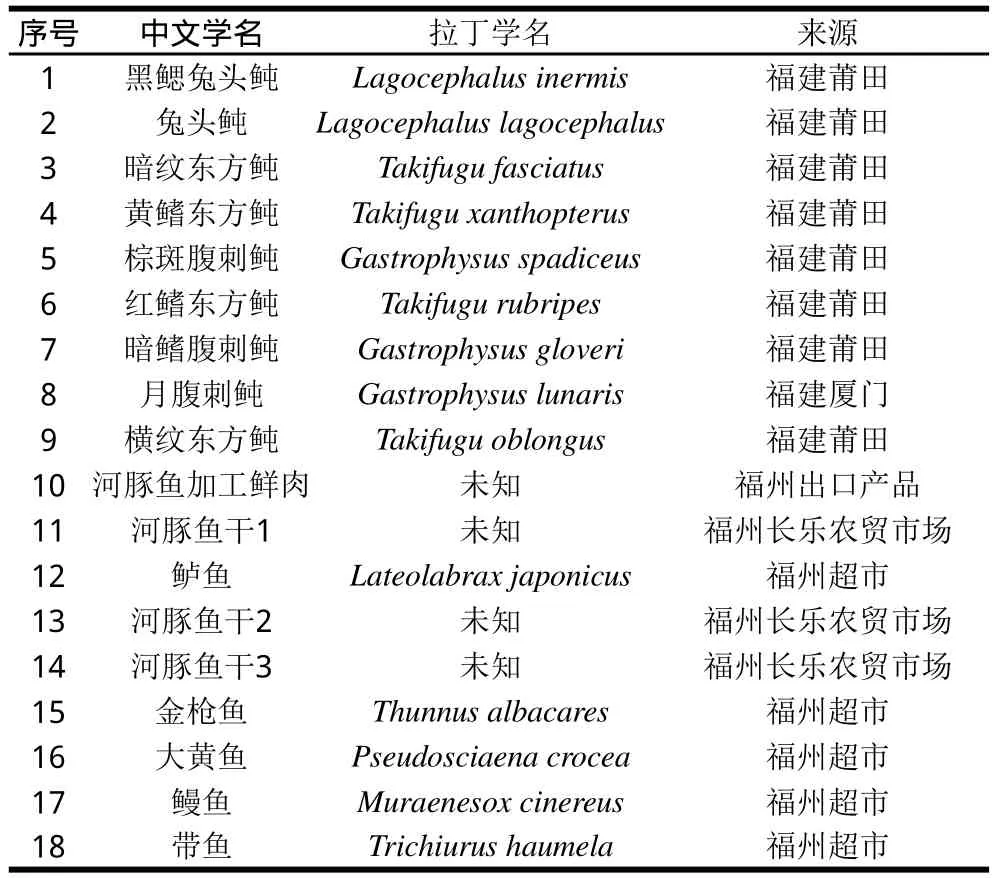
表 1 18 个河豚鱼及其他鱼类供试样品Table 1 Eighteen samples of puffer fish and other fishes
1.2 试剂与引物
限制性内切酶NmeA Ⅲ(2000 U/mL) 北京纽英伦生物技术有限公司。其他参照文献[22]。
按照文献[21],由上海生工生物工程有限公司合成鱼源性成分检测引物(FISH)与河豚鱼成分引物(HT-1),引物碱基序列、PCR产物片段长度与适合的退火温度(Tm值)见表2。

表 2 鱼源性成分与河豚鱼成分的PCR检测用的引物序列与退火温度Table 2 Primer sequences and annealing temperatures for PCR detection of fish components and puffer fish component
1.3 方法
1.3.1 DNA提取、PCR扩增、限制性内切酶消化
参照文献[21]优化确立的DNA提取CTAB方法与PCR引物、扩增体系和温度程序,进行DNA提取、PCR扩增、PCR产物凝胶水平电泳与凝胶成像,每个PCR重复3 次。按照产品使用说明书规定,在10 L的PCR产物中,加入2.0 L 10× Cutsmart Buffer、1.0 L限制性内切酶NmeA Ⅲ、0.05 L S-腺苷甲硫胺酸(S-adenosylmethionine,SMA)溶液,再加纯净水6.95 L使总体积达到20 L,在37 ℃条件下消化16~18 h,然后进行琼脂糖凝胶电泳与成像拍照。
1.3.2 DNA碱基序列测定
PCR产物通过凝胶电泳后,检出阳性结果的PCR扩增产物委托上海生工生物技术有限公司进行克隆、测序。
1.3.3 序列比对与酶切位点确定
应用DNAMAN 5.2.2版软件对各个样品PCR产物序列进行整理分析,结果以MASED Document/DNAMAN1格式输出,同时在GenBank中进行BLAST分析。应用NEBcutter 2.0软件进行限制性内切酶NmeA Ⅲ酶切位点分析。
2 结果与分析
2.1 鱼类内源基因PCR扩增

图 1 18 种河豚鱼与非河豚鱼样品的鱼成分内源基因PCR扩增电泳图Fig.1 PCR amplification results of 18 fish samples using primers targeting FISH components
通过样品的鱼类内源基因PCR扩增,监控DNA质量。13 个河豚鱼样品与5 个非河豚鱼样品的鱼类特异性基因(线粒体DNA)的PCR扩增结果见图1。18 个鱼类样品均能扩增出大小为224 bp的鱼成分PCR产物,说明各样品的DNA提取是成功的,适合于PCR扩增。
2.2 河豚鱼特异基因PCR扩增
应用河豚鱼PCR检测引物(HT-1)对13 个河豚鱼样品与5 个非河豚鱼样品提取的DNA进行河豚鱼线粒体特异性基因(Cyt b)PCR扩增,结果见图2,13 个河豚鱼样品与2 个非河豚鱼样品(金枪鱼与鲈鱼)共15 个样品检出PCR产物,为疑似阳性结果。另外3 种非河豚鱼类的大黄鱼、鳗鱼、带鱼与空白对照(ddH2O)均未扩增出DNA条带,判为阴性结果。

图 2 引物HT-1对河豚鱼成分的PCR扩增结果Fig.2 PCR amplification results of 18 fish samples with HT-1 primers targeting puffer fishes component
2.3 PCR产物酶切图谱分析
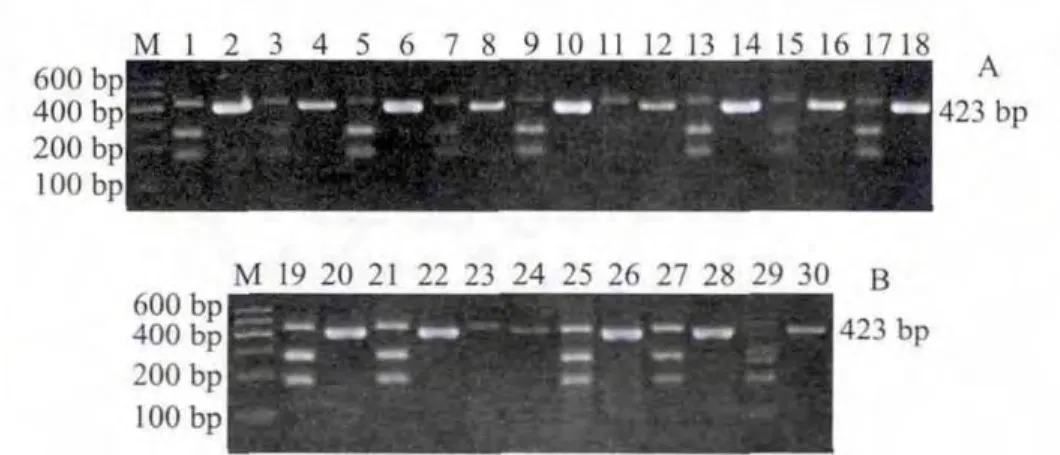
图 3 PCR产物及其酶切结果电泳图谱Fig.3 Electrophoresis patterns of PCR products of puffer fishes with and without restriction endonuclease digestion
15 个检出河豚鱼成分疑似阳性结果的样品PCR产物及其经酶切消化后的产物电泳图谱见图3。图3A与图3B中9 个已知学名与4 个未知学名的的河豚鱼样品,在奇数号泳道均检出酶切产物,各样品图谱相同,均有2 条新的片段较小的条带,分别在300 bp与200 bp的下方。由图3B可知,23、24号泳道分别为鲈鱼酶切与未经酶切的PCR产物,前者无新的条带出现,29、30号泳道为金枪鱼的酶切与未经酶切的PCR产物,酶切的电泳图谱出现4 条新的条带,图谱与河豚鱼明显不同。可见,应用限制性内切酶NmeA Ⅲ酶切可以区别河豚鱼与非河豚鱼,进而排除2 个非河豚鱼的假阳性结果。图3A与图3B中所有疑似阳性样品的PCR产物酶切后残留PCR产物片段条带位置都高于未经酶切处理的原PCR产物条带,出现该现象的原因是加入的限制性内切酶(蛋白)与DNA结合,使得分子质量比原来纯DNA片段更大。毛细管电泳结果(本文略)表明,经内切酶消化酶切后切断的与未切断残留的DNA片段,因结合了内切酶,其大小都比实际的DNA片段大。
2.4 PCR产物的DNA序列与酶切位点分析
本实验所用的河豚鱼成分PCR检测正向引物25 个碱基,反向互补20 个碱基(表2),结果正向引物有20 个连续碱基、反向互补有10 个连续碱基与7 个连续碱基分别与金枪鱼Cyt b部分片段序列两端互补,鲈鱼中也存在类似情况,于是在2 个非河豚鱼样品中也能扩增出PCR产物,出现假阳性现象.

图 4 河豚鱼(兔头鲀)Cyt b部分片段PCR产物碱基序列与限制性内切酶NmeAⅢ酶切位点NEB cutter分析图Fig.4 Partial sequences of the Cyt b gene of puffer fish and NmeAⅢ cleavage sites
应用NEB cutter 2.0软件对13 种河豚鱼与2 种非河豚鱼(鲈鱼及金枪鱼)样品的PCR产物碱基序列进行限制性内切酶酶切位点分析,结果表明,NmeA Ⅲ酶切位点为5’...GCCGAG(N)21N...3’或3’... CGGCTC(N)19N...5’。河豚鱼样品的PCR产物均为423 个碱基(仅出示兔头鲀序列,其他种类河豚鱼DNA序列资料略),NmeA Ⅲ酶切位点都只有1个(图4),在5’端起的第256/254碱基位置,被切成2段,即电泳图出现的2 条新带(图3),大小为256/254 bp与167/169 bp。金枪鱼PCR产物为422 个碱基,NmeA Ⅲ酶切位点有2 个(图5),分别在5’端起的第339/337 碱基与252/250碱基的位置,被切成4 段,大小为339/337、83/85 bp与252/250、170/172 bp(图3B 第29泳道)。鲈鱼PCR产物为423个碱基,其序列无NmeA Ⅲ限制性内切酶酶切位点(图6),NEB cutter 2.0软件无法生成酶切分析图,电泳结果无新条带出现(图3B),二者结果吻合。
2 个非河豚鱼样品中也能扩增出与河豚鱼相似的PCR产物,出现假阳性现象,原因是,河豚鱼成分PCR检测所用的正向引物25 个碱基,反向互补20 个碱基(表2),结果正向引物有20 个连续碱基、反向互补有10 个连续碱基与7 个连续碱基分别与金枪鱼Cyt b部分片段序列两端互补,鲈鱼中也存在类似情况。
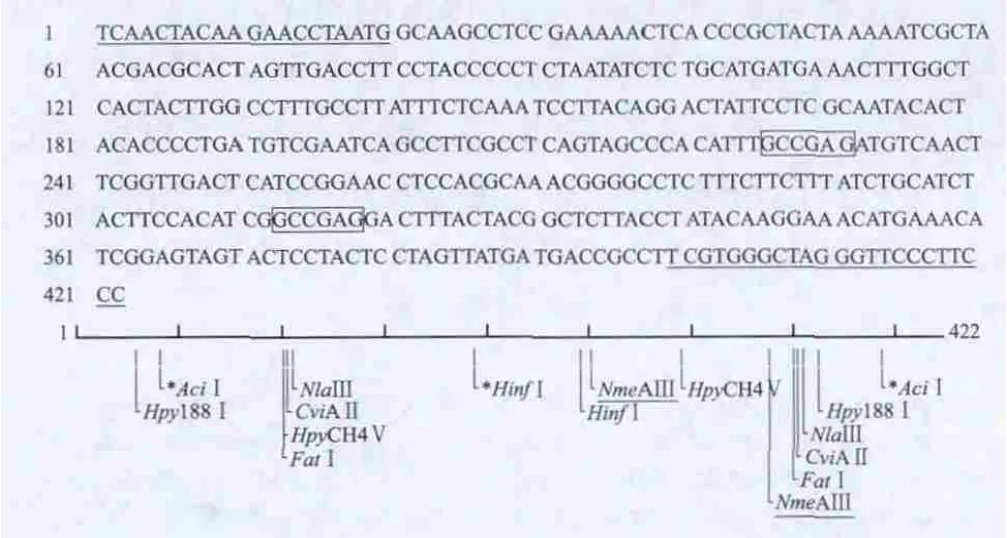
图 5 金枪鱼Cyt b部分片段PCR产物碱基序列与限制性内切酶NmeAⅢ酶切位点NEB cutter分析图Fig.5 Partial sequences of the Cyt b gene of tuna and NmeAⅢ cleavage sites

图 6 鲈鱼Cyt b部分片段PCR产物碱基序列Fig.6 Partial sequences of the Cyt b gene of weever
2.5 PCR产物碱基序列的GenBank查询比对与同源性分析
13 个河豚鱼样品与2 个非河豚鱼(金枪鱼与鲈鱼)样品的PCR产物碱基序列在GenBank数据库中进行查询比对(BLAST)结果表明,13 个河豚鱼的序列与GenBank数据库中河豚鱼线粒体b基因(Cyt b)的部分序列(序列号有多个,略)同源性在98%~100%之间,其中有9 个样品为100%,3 个为99%,1 个为98%。金枪鱼与鲈鱼的序列BLAST结果表明,金枪鱼序列422 个碱基中有408个与数据库中的Thunnus albacares(金枪鱼)Cyt b部分序列(JN086153.1)同源性为99%(408/410,图7),鲈鱼的序列423 个碱基中有391 个与数据库中的Lateolabrax japonicus(鲈鱼)Cyt b部分序列(DQ351530.1)同源性为99%(391/392,图8),可见2 个非河豚鱼PCR产物不是河豚鱼成分,验证了限制性内切酶NmeA Ⅲ的酶切结果,可有效排除假阳性误判。
3 结论与讨论

图 7 金枪鱼样品序列(Query)与GenBank数据库中的Thunnus albacares(金枪鱼)Cyt b基因部分序列(JN086153.1)比对结果图Fig.7 BLAST results between sequences (Query) of tuna sample and partial sequences (JN086153.1)of the Cyt b gene of Thunnus albacares in GenBank

图 8 鲈鱼样品序列(Query)与GenBank中的鲈鱼(Lateolabrax japonicus Cyt b基因部分序列(DQ351530.1)比对结果图Fig.8 BLAST results between sequences (Query) of weever sample and partial sequences (DQ351530.1) of the Cyt b gene of Lateolabrax japonicus in GenBank
普通PCR方法的缺陷之一是有时会出现假阳性现象,除了实验环境与试剂可能受污染以及PCR反应退火温度不恰当外,引物特异性不够强是主要原因,而引物的特异性也不是绝对的,只要所使用的引物序列与非目的物种的某段DNA的序列有部分互补性,就会扩增出与目的片段大小相似的PCR产物,凝胶电泳图谱与阳性结果接近或相同,肉眼无法判别而出现假阳性现象[23],导致结果误判。本实验应用文献[21]建立的河豚鱼成分(部分Cyt b基因特异序列)PCR检测方法检测13 个河豚鱼样品与5 个非河豚鱼样品,结果发现,在金枪鱼与鲈鱼2 个非河豚鱼样品中也能扩增出片段大小与河豚鱼接近或相同的PCR产物,出现假阳性现象。目前常用的排除PCR检测假阳性结果的确证方法主要有DNA限制性内切酶技术[24-25]与DNA测序方法[22],本研究应用这两种方法对河豚鱼成分PCR检测结果加以确证。金枪鱼及鲈鱼的PCR产物碱基序列经与GenBank数据库DNA序列比对,分别确认为Thunnus albacares(金枪鱼)与Lateolabrax japonicus(鲈鱼),表明2个非河豚鱼PCR产物不是河豚鱼成分,验证了NmeA Ⅲ限制性内切酶酶切结果,可见该方法可用于河豚鱼成分PCR检测结果的确证。为了验证本实验建立的NmeA Ⅲ限制性内切酶方法是否具有广泛的适用性,将进一步在更多的其他鱼类中可能出现的假阳性结果进行确证应用,为该方法的推广应用提供更丰富的科学依据。
[1]陈文炳, 邵碧英, 廖宪彪, 等. 加工食品中若干动物成分的PCR检测技术应用研究[J]. 食品科学, 2005, 26(8): 338-342.
[2]陈文炳, 邵碧英, 江树勋, 等. 食品中若干植物源性成分的PCR检测[J].食品科学, 2006, 27(11): 404-408.
[3]陈颖, 钱增敏, 徐宝梁, 等. 保健品中牛羊源性成分的PCR检测[J].食品科学, 2004, 25(10): 215-218.
[4]才华, 栾凤侠, 关学佳, 等. 马铃薯、番茄内源基因PCR检测引物设计及特异性分析[J]. 食品科学, 2011, 32(22): 192-195.
[5]张驰, 邱皓璞, 张筠. 荧光定量PCR检测肉制品中鸭源性成分[J]. 食品科学, 2013, 34(18): 154-157.
[6]李富威, 张舒亚, 叶军, 等. 实时荧光聚合酶链式反应检测食品中香蕉成分[J]. 食品科学, 2013, 34(12): 243-246.
[7]范丽丽, 李培, 傅春玲, 等. 食品中鸡源性成分实时荧光PCR检测方法的建立[J]. 食品科学, 2014, 35(2): 248-251.
[8]李富威, 张舒亚, 叶军, 等. 食品中木瓜成分实时荧光PCR检测方法[J]. 食品研究与开发, 2013, 34(11): 51-56.
[9]REHBEIN H, KRESS G, SCHMIDT T. Application of PCR-SSCP to species identification of fishery products[J]. Journal of the Science of Food and Agriculture, 1997, 74: 35-41.
[10]LIN Wenfeng, HWANG D F. A multiplex PCR assay for species identification of raw and cooked bonito[J]. Food Control, 2008, 19:879-885.
[11]李进波, 李想, 谌鸿超, 等. 实时荧光PCR法鉴定食品中鲑亚科鱼成分[J]. 食品科学, 2013, 34(20): 194-198.
[12]陈超, 石拓, 孙曙光, 等. 应用RAPD标记对东方豚属进行种类鉴别及其聚类分析[J]. 海洋水产研究, 2001, 22(3): 32-36.
[13]邵爱华, 郑峰, 吴胜, 等. 暗纹东方豚mtDNA的分离与纯化及其细胞色素b基因的分子克隆[J]. 中国水产科学, 2005, 24(5): 4-7.
[14]邵爱华, 朱江, 陈葵, 等. 暗纹东方豚粒体细胞色素b及其侧翼tRNA基因的克隆与序列分析[J]. 中国水产科学, 2005, 12(6): 675-681.
[15]邵爱华, 朱江, 陈葵, 等. 暗纹东方豚线粒体COⅡ及两侧tRNA基因的克隆和序列分析[J]. 动物学杂志, 2005, 40(6): 1-8.
[16]邵爱华, 朱江, 陈葵, 等. 暗纹东方豚线粒体CO Ⅰ及其侧翼tRNA基因的克隆与序列分析[J]. 遗传, 2006, 28(8): 963-971.
[17]邵爱华, 朱江, 史全良, 等. 暗纹东方豚线粒体COⅢ克隆及序列分析[J].水产科学, 2006, 25(8): 391-396.
[18]邵爱华, 薛峰, 陈葵, 等. 暗纹东方豚线粒体ND1及其侧翼tRNA基因的克隆及序列分析[J]. 苏州科技学院学报: 自然科学版, 2007,24(4): 61-66.
[19]邵爱华, 杜建, 陈葵, 等. 暗纹东方豚线粒体DNA 16S rRNA基因克隆、测序与在分子系统发育分析中的应用[J]. 江苏农业科学,2009(2): 15-19.
[20]邵爱华 杜建, 陈葵, 等. 暗纹东方豚线粒体ATPase8和ATPase6基因的克隆与序列分析[J]. 苏州科技学院学报: 自然科学版, 2010,21(7): 41-46.
[21]陈文炳, 赵晨, 邵碧英, 等. PCR方法检测河豚鱼的引物筛选及反应体系的优化[J]. 食品科学, 2011, 31(20): 376-381.
[22]陈文炳, 林少华, 邵碧英, 等. 河豚鱼Cyt b基因的部分DNA序列分析与应用[J]. 食品科学, 2012, 33(20): 227-232.
[23]梁国栋. 最新分子生物学实验技术[M]. 北京: 科学出版社, 2001:131-133.
[24]王波, 郭勇, 鲜灵. 一种野生蘑菇的鉴定[J]. 西南农业学报, 2013,26(2): 672-674.
[25]郝旭光, 孙寓娇, 鲜灵. PCR-酶切技术在石油烃降解菌筛选鉴定中的应用[J]. 环境工程学报, 2010(10): 449-452.
