毛囊来源的神经嵴干细胞修复大鼠坐骨神经缺损
2014-06-19张路张洁元李兵仓刘争刘彬
张路,张洁元,李兵仓,刘争,刘彬
1 西南大学生命科学学院,重庆 400715 2 第三军医大学大坪医院野战外科研究所 创伤、烧伤与复合伤国家重点实验室,重庆 400042 3 淡水鱼类资源与生殖发育教育部重点实验室,重庆 400715 4 重庆医科大学生理学教研室 神经科学研究中心,重庆 400016
周围神缺损修复一直是人们关注的问题[1-3]。周围神缺损修复的目的是为了实现缺损部位感觉和 (或) 运动机能的部分乃至完全恢复。感觉功能检测[4]和运动功能检测[5]是评价周围神缺损修复效果的比较直观的方法。目前,国内外所报道的实验结果大多处于组织学和电生理水平[6-8]。为了实现周围神经缺损修复的更好效果,本领域的各项探索仍具有其必要性。对轴突生长提供一个相对封闭的微环境[9]是神经导管设计的初衷。由于考虑到物质交换的问题,在神经导管管壁预留一系列的孔隙也是目前普遍采用的思路,也有研究表明神经导管管壁孔隙的存在会阻滞轴突生长的进程[9]。因此,在本研究中,采用了孔隙率低的导管。聚乳酸-聚羟基乙酸共聚物(Poly lactic acid co glycolic acid copolymer, PLGA)[10]、细胞外基质(Extracellular matrix, ECM)[11]由于具有良好的生物相容性及生物可降解性而被应用于人工神经的研究中。ECM的主要成分为胶原和其他一些对细胞生长和粘附有促进作用的物质[12],在本研究中将ECM预置在PLGA神经导管中是试图为种子细胞的生长和粘附提供三维支架,并促进其生长。利用种子细胞修复周围神经缺损是一个被普遍认同的学术思路。雪旺氏细胞 (Schwann cells,SC)[13]、嗅球成鞘细胞 (Olfactory ensheathing cells, OEC)[14]、骨髓基质细胞 (Bone marrow stromal cells, BMSC)[15]、神经干细胞 (Neural stem cells, NSC)[16]等都被作为种子细胞。它们对促进周围神经缺损修复均有正效应,但都未实现其完全修复。影响周围神经缺损修复效果的因素很多,探索其他种子细胞或许能为这一问题的解决提供更多的方案。毛囊来源的神经嵴干细胞 (Epidermal Neural Crest Stem Cell, EPI-NCSC)由于取材方便,具有多种分化潜能[17-18],是一种具有良好应用前景的组织工程种子细胞。目前,在神经缺损修复领域中,EPI-NCSC主要被应用于脊髓损伤的修复。研究证实,在脊髓损伤处移植EPI-NCSC,在术部局部可观察到结构和功能的部分恢复[19]以及神经再生和髓鞘形成[20]。
为了探讨 EPI-NCSC对周围神经缺损的修复作用,本研究以成年GFP、SD大鼠触须垫为材料,原代培养EPI-NCSC。考察其体外性质,并以其为种子细胞,将其等量与ECM混合后,预置入 PLGA导管中,桥接 SD大鼠坐骨神经10 mm距离的缺失。在移植4周后,通过感觉功能检测,神经行为学观测和术部组织学观察,来探讨EPI-NCSC对周围神经缺损的修复作用,从而为相关研究提供参考数据。
1 材料与方法
1.1 PLGA材料的制备
将PLGA (85:15, Sigma) 溶于三氯甲烷,制备成5% (W/V) 的溶液,置于玻璃培养皿内,在通风橱中挥发 48 h,以制备厚度为 25 µm 的PLGA膜。用自制模具制备内径为1.5 mm,壁厚0.5 mm,长度为15 mm的PLGA导管。将二者进行γ射线(2.5 Mrad)照射灭菌,在无菌条件下保存备用。
1.2 EPI-NCSC的原代培养
EPI-NCSC 的原代培养按文献[17]报道的方法进行。取成年GFP、SD大鼠 (雌性,体重200 g,由第三军医大学大坪医院实验动物中心提供)1只,过量麻醉致死,取其触须垫,解剖出完整毛囊,切除毛囊球部,剖开结缔组织鞘,取出毛囊外根鞘,保持隆突部的完整。置于被鼠尾胶原包埋过的培养皿中,25 min后加入1.5 mL培养液(含达尔伯克(氏)改良伊格尔(氏)培养基(Dulbecco's Modified Eagle's medium, DMEM)/F12 1:1,10%FBS,2% B27,20 ng/mL bFGF),37 ℃﹑5% CO2培养。3 d后半量换液,6 d后剔除毛囊,0.25%胰蛋白酶消化传代培养,培养液同前,每3天换液一次。
1.3 EPI-NCSC的鉴定
EPI-NCSC 的鉴定按文献[17]报道的方法进行。将粘附有细胞的载玻片用PBS漂洗3次,用4%多聚甲醛常温下固定30 min,PBS漂洗3次各5 min,用1%BSA室温封闭30 min,倾去液体,加入小鼠抗Nestin (1∶100, Abcam, USA)和兔抗SOX10 (1∶1 000, Abcam, USA) 4 ℃孵育24 h。PBS漂洗3次,每次5 min。加入Alexa Flour 594山羊抗兔IgG (1∶50,碧云天,中国)和Cy5山羊抗小鼠IgG (1∶50,碧云天,中国)37 ℃孵育1 h。PBS漂洗3次,每次10 min。室温晾干避光,抗荧光淬灭剂 (KPL,USA) 封片。荧光显微镜下观察。
1.4 EPI-NCSC与PLGA膜的共培养及其观察
将浓度为 1×106个/mL的细胞悬液接种至PLGA膜上,在37 ℃、5% CO2孵箱内培养。同时以相同数量的细胞接种到被鼠尾胶原包被的盖玻片上,作为对照组培养。培养3 d后,取材用荧光显微镜。扫面电镜样品置入固定液,4 ℃冰箱固定24 h,样品经过梯度脱水后再喷金。
1.5 EPI-NCSC在PLGA膜表面的相对增殖率及初期附着率的噻唑蓝(Methyl thiazolyl tetrazolium, MTT)比色分析
用明胶预衬 96孔板后,在各孔中滴加 5%(W/V) 的PLGA三氯甲烷溶液,迅速挥发干,用γ射线照射灭菌,接种浓度为1×106个/mL的细胞悬液 (n=3)。在37 ℃、5% CO2条件下分别培养4、8、12、16 h,去上清液,加入MTT工作液100 µL (含DMEM/F12+20% FBS培养基稀释,终浓度为1 mg/mL) 37 ℃孵育4 h,再加入150 μL二甲基亚砜 (DMSO) 溶液,DDHZ-300台式恒温振荡器37 ℃孵育30 min直至结晶产物完全溶解,用未经处理的96孔板为对照组。用全波长酶标测定仪 (Thermo, USA) 在570 nm波长处检测其OD570值。根据以下公式折算初期附着率。
初期附着率=OD570值(实验组)/OD570(对照组)×100%
按以上相同的方法处理后,分别测定在第1、3、5和7天的OD570值,根据以下公式折算细胞相对增殖率 (Relative growth rate, RGR)。
RGR=OD570值(实验组)/OD570值(对照组)×100%
1.6 细胞周期及DNA倍体分析
将EPI-NCSC与PLGA膜进行共培养,分别在第1、3、5和7天取PLGA膜,用0.25%的胰蛋白酶+0.02% EDTA消化收集细胞,DMEM/F12+20% FBS培养液终止消化,1 000 r/min离心5 min,弃上清,75%酒精重悬固定,制成密度为1×106个/mL的单细胞悬液,4 ℃过夜。1 000 r/min离心 5 min,去除酒精固定液,加入碘化丙啶(PI,50 µg/mL) 染料 (含 RNA 酶 A 0.1 mg/mL),4 ℃孵育25 min。用Epics XLMCL型流式细胞仪进行检测,并根据公式计算出样品细胞的DNA指数 (DNA index,DI),增殖指数PI,以确定PLGA材料对EPI-NCSC的细胞周期、DNA含量及倍体水平的影响。以单独培养的EPI-NCSC为对照。
DI=实验组-G1期细胞百分比/对照组-G1期细胞百分比
PI=(S+G2/M)/(G0/G1+S+G2/M)
1.7 动物实验
1.7.1 模型的建立与分组
将体重200−220 g SD大鼠(第三军医大学大坪医院实验动物中心)20只随机分为2组,每组10只。实验组为EPI-NCSC细胞悬液和ECM的混合液25 μL注射入PLGA神经导管;对照组将等量的 ECM 和 DMEM 的混合液注射入PLGA神经导管。用3%戊巴比妥钠40−50 mg/kg腹腔注射麻醉,俯位固定。在右侧坐骨神经走向处切开皮肤,暴露右侧坐骨神经,追踪坐骨神经至梨状肌下缘5 mm处,切除该点以下的坐骨神经,形成10 mm的缺损。取PLGA导管套接于神经断端,8-0无创缝线缝合神经外膜于PLGA导管上。依次缝合肌间膜、皮肤,皮下注射青霉素10万单位/kg。术前1 d及术后1周内每日腹腔注射环孢霉素4 mg/kg。实验动物分笼饲养。
1.7.2 组织标本的获取和制备
在术后第4周,取实验组大鼠。3%戊巴比妥钠腹腔注射麻醉后,取仰卧位固定,剖胸显露心脏,剪开右心耳,同时左心室插管,快速灌注生理盐水100–200 mL,待流出液体清亮后,灌注4%多聚甲醛200 mL左右。灌注结束后,取材桥接管内再生组织10 mm,继续后固定6 h,20%蔗糖饱和至组织沉底。冰冻纵行切片,片厚10 μm,荧光显微镜和进行H.E染色观察。
1.7.3 感觉功能检测
感觉功能检测按文献[4]报道的方法进行。将大鼠轻轻固定,后足浸入热水浴中 (50 ℃),记录后足回缩时间,以回缩时间的长短来量化痛温觉。术后每周均进行回缩反射检测,先测实验侧,再测正常侧作为对照。对照组方法同上。注意后足浸入热水浴中若5 s后仍无回缩,后足立即移出热水浴,以防止组织损伤。
1.7.4 运动功能检测
运动功能检测按文献[5]报道的方法进行。自制大鼠足印行走盒,宽10 cm,长80 cm。记录清晰的大鼠双侧后足足印。测量双侧后足的印长 (Print length, PL),趾展 (Toe spread, TS),中间趾展(Intermediary toe spread, ITS),每只至少测量 5对足印,术后1周开始测量,每周测量一次。按照Bain-Mackinnon-Hunter坐骨神经功能指数公式计算出SFI值。
SFI= –38.3×PLF+109.5×TSF+13.3×ITF–8.8
其 中 PLF=(EPL–NPL)/NPL, TSF=(ETS–NTS)/NTS,ITF=(EIT–NIT)/NIT。E代表实验侧(Experimental side),N 代表正常侧 (Normal side)。正常大鼠的SFI值约为0,坐骨神经完全损伤后SFI值约为–100。
2 结果与分析
2.1 EPI-NCSC的原代培养及鉴定
GFP大鼠毛囊在体外培养3 d时,EPI-NCSC从隆突处爬出 (图1A)。EPI-NCSC细胞经第一次传代后,在荧光显微镜下被激发出绿色荧光(图 1B)。行 Nestin (图 1C) 和 SOX10 (图 1D) 荧光免疫组化鉴定,细胞呈阳性,胞浆被激发出蓝色和红色荧光,细胞核阴性。由此可以确定原代培养的细胞为EPI-NCSC。
2.2 EPI-NCSC与PLGA膜的共培养及其观察
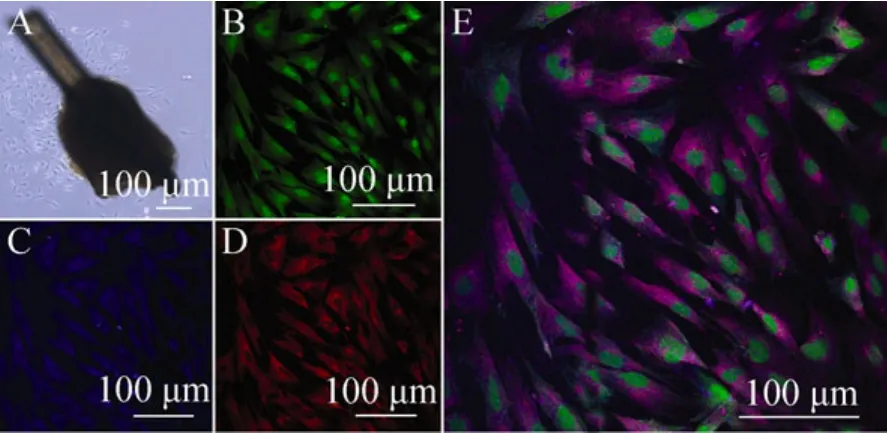
图1 EPI-NCSC的原代培养及鉴定Fig. 1 Culture and immunofluorescence staining for EPI-NCSC. (A) Hair follicle and EPI-NCSC on the 3th day. (B) Observed with fluophot. (C)Immunofluorescence staining of Nestin. (D)Immunofluorescence staining of SOX10. (E)Immunofluorescence staining of SOX10 and Nestin.

图2 EPI-NCSC与PLGA膜的共培养观察Fig. 2 EPI-NCSC co-cultured with materials. (A)EPI-NCSC on a coverslip (fluophot). (B) EPI-NCSC on a PLGA membrane (fluophot). (C) EPI-NCSC on a coverslip (SEM). (D) EPI-NCSC on a PLGA membrane(SEM).
EPI-NCSC在分别与被鼠尾胶原包被的盖玻片 (图2 A,C) 和PLGA膜 (图2 B,D) 共培养3 d后,在荧光显微镜 (图2 A,B) 和扫描电子显微镜 (图2 C,D) 下均观察到了细胞。在盖破片上的细胞形态大部分呈梭形,有的突起多,细胞之间靠分支相连;在 PLGA膜上细胞形态呈长梭形,有突起,细胞聚集生长。
2.3 EPI-NCSC细胞在PLGA膜表面的相对增殖率及初期附着率的MTT分析
EPI-NCSC在接种PLGA膜上4 h到16 h,OD值呈增加趋势,略低于对照组,但两者在统计学上无显著性差异 (P>0.01) (图 3)。EPI-NCSC在PLGA膜上的初期粘附率为89.7%。
EPI-NCSC接种于 PLGA膜上 1−7 d,OD值与对照组均呈递增态势,但两者在统计学上无显著性差异 (P>0.01) (图4)。EPI-NCSC在1、3、5、7 d的细胞相对增殖率分别为 89.3%、87.6%、85.6%和96.6%。
2.4 细胞周期及DNA倍体分析
PLGA组的G0/G1期 (静止期/DNA合成前期) 细胞百分比不断减少,S期 (DNA合成期)细胞百分比不断增加,与对照组 EPI-NCSC的细胞周期变化趋势相同,PLGA组的G2/M期细胞百分比与正常的细胞百分比变化趋势也相同,两者无显著性差异(*P> 0.01) (图5),说明PLGA并不影响EPI-NCSC的细胞周期变化。
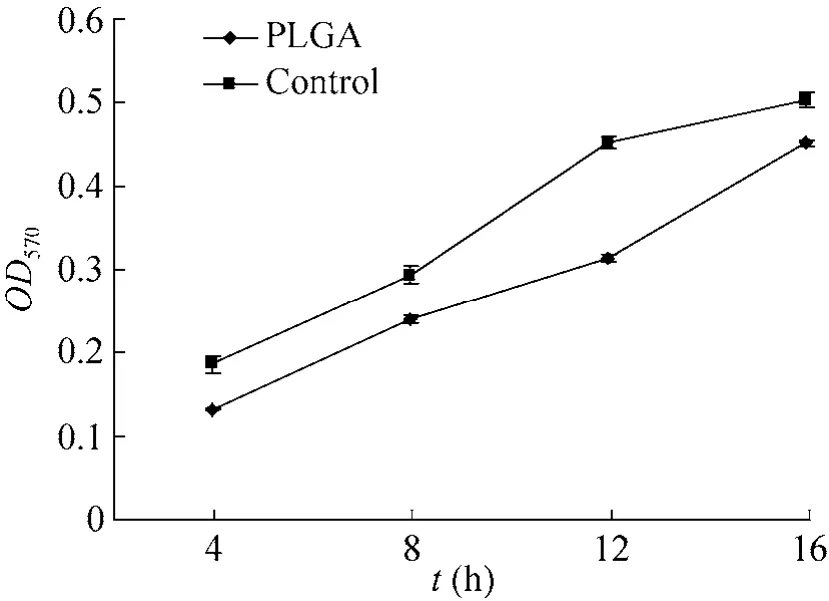
图3 EPI-NCSC在PLGA膜上的粘附试验 (MTT)Fig. 3 Adhesion of EPI-NCSC on a PLGA membrane(MTT).
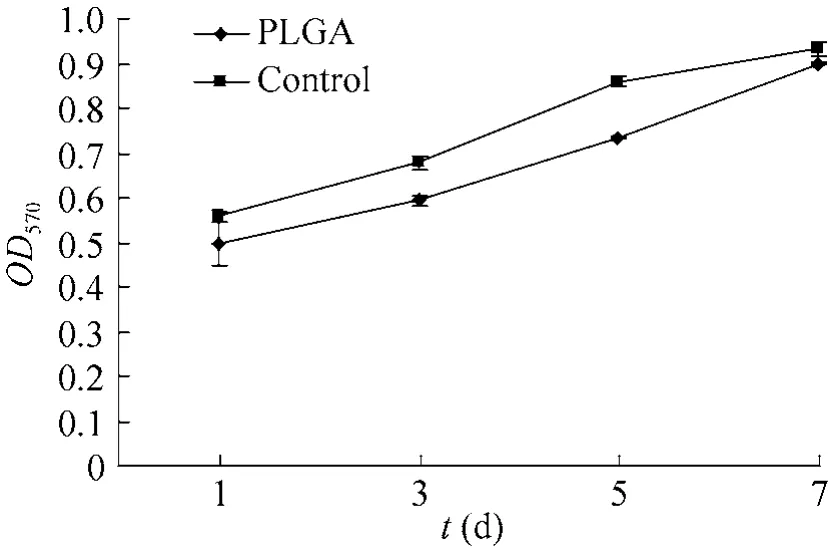
图4 EPI-NCSC在PLGA膜上的增殖试验 (MTT)Fig. 4 Development of EPI-NCSC on a PLGA membrane (MTT).
PLGA组在1−7 d DNA指数 (DI值) 均在1.0±0.1范围内 (表1),为正常DNA二倍体细胞,证实PLGA材料对EPI-NCSC无致癌性,二者联合应用对机体无害。
PLGA组在1−7 d增殖指数 (PI值) 与对照组增值变化相同,都有增加趋势。两者无显著性差异 (P>0.01) (图 6)。PLGA 对 EPI-NCSC的增值变化影响不大。
2.5 术部的形态学观察
在移植4周后,PLGA导管仍然保持着管状形态 (图7A)。移植体内被细胞充满,多数细胞显示出绿色荧光 (图7E, E′)。与正常坐骨神经组织 (图7B, B′) 相比,移植体内的细胞排列无顺序,细胞之间比较紧密,细胞形态不规则。在ECM/DMEM 组(对照)中 (图 7C, C′),移植体组织结构松散,组织间有泡状空隙,细胞数量比细胞移植组明显减少。
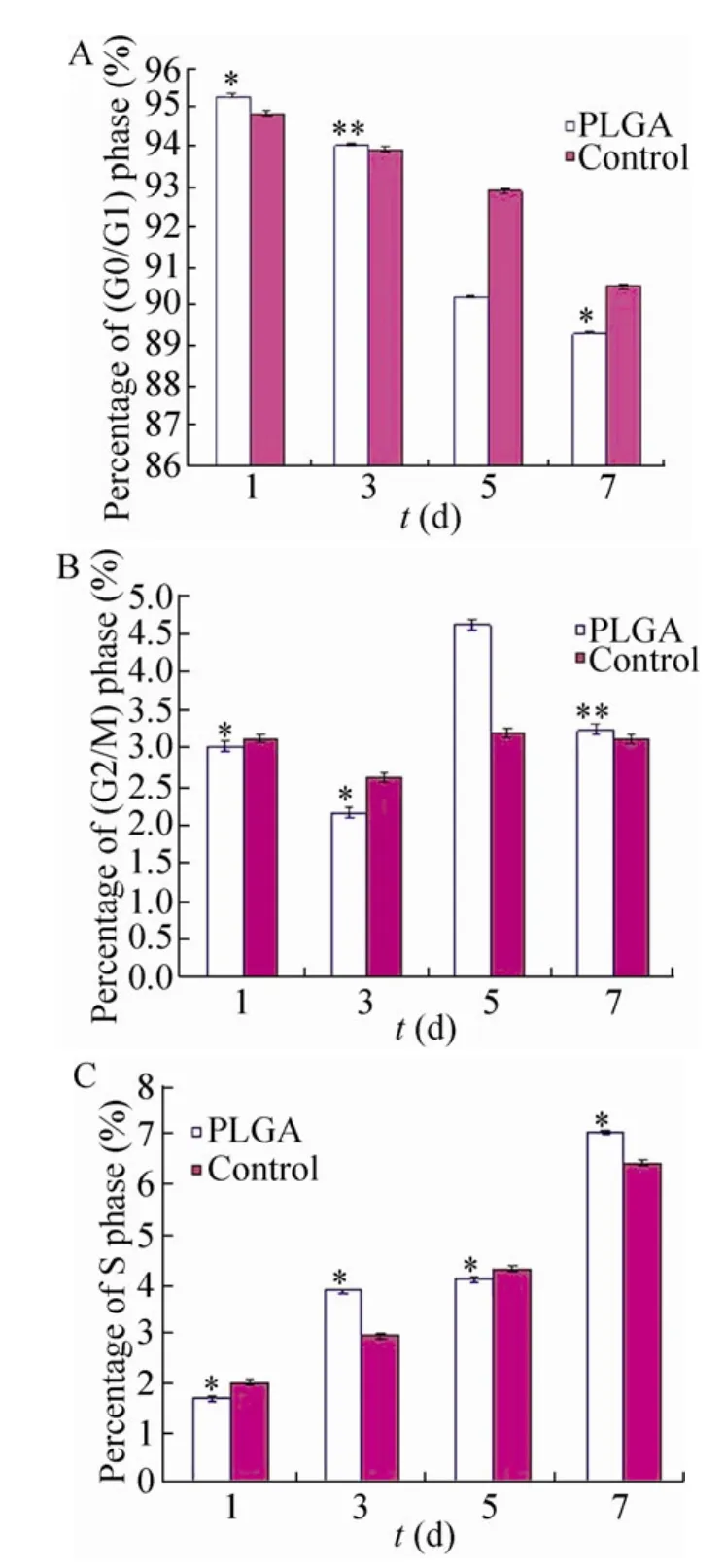
图5 EPI-NCSC的细胞周期分析Fig. 5 Cell cycle of EPI-NCSC. (A) Percentage of G0/G1 phase cells. (B) Percentage of G2/M phase cells.(C) Percentage of S phase cells. *Values are not significantly different at P>0.01 (t-test). **Values are not significantly different at P>0.05 (t-test).
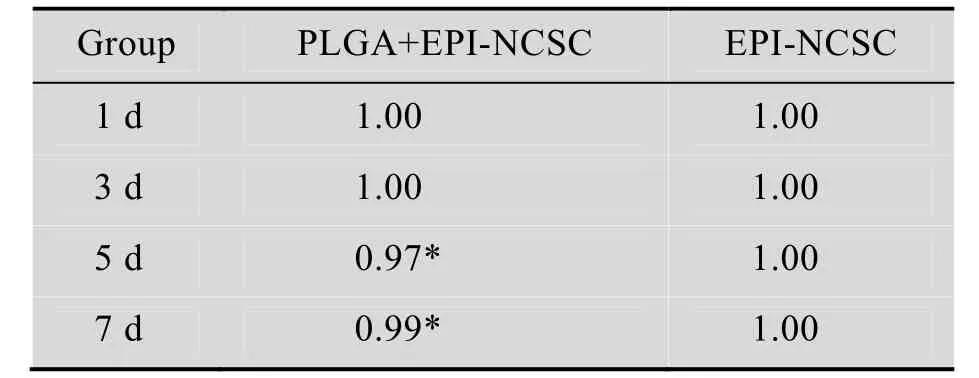
表1 不同时间点的DI值Table 1 DI values of time

图6 不同时间点PI值变化Fig. 6 PI values of time.

图7 移植4周后术部神经的形态Fig. 7 Defected sciatic nerve after four weeks of transplant. (A) Area of transplant. (B) Cross section of normal sciatic nerve (H.E). (B') Longitudinally cut section of normal sciatic nerve (H.E). (C) Cross section of control group (H.E) . (C') Longitudinally cut section ofcontrol group (H.E). (D) Cross section of experiment group (H.E). (D') Longitudinally cut section of experiment group (H.E). (E) Longitudinally cut section of experiment group (fluophot). (E') Cross section of experiment group (fluophot).
2.6 感觉功能检测
正常大鼠后足回缩时间在1.46−1.49 s之间。术后 1周各组实验侧的后足回缩时间较正常侧延长2.5 s左右,与正常侧回缩时间有显著性差异 (P<0.01)。术后3 周实验组出现感觉功能的改善,对照组无明显的改善。在 4周时,实验组感觉功能继续好转,回缩时间恢复至(2.93±0.02) s,而对照组 (在PLGA导管中,以等量的ECM/DMEM代替EPI-NCSC和ECM的混合物) 感觉功能仍未改善 (表2)。
2.7 运动功能检测
正常大鼠的SFI值为0。术后1周,由于后足足印长度急剧增加,趾展、中间趾展的大幅减小,各组SFI值均降至–97~–100之间。术后3周实验组SFI值有显著提高,对照组SFI值无明显提高。在4周时,实验组SFI值继续增加,而对照组提高不明显 (表3) (P<0.05)。
表2 术后各组回缩反射时间Table 2 Time of leg contraction (s,±s, n=5)
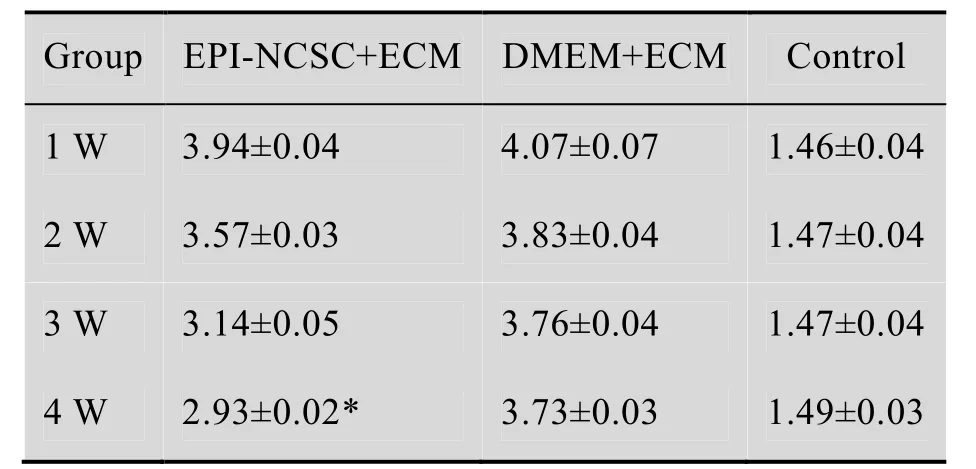
表2 术后各组回缩反射时间Table 2 Time of leg contraction (s,±s, n=5)
*Values are significantly different at P<0.01 (t-test).
表3 术后不同时间点各组SFI值Table 3 SFI value of time (±s, n=5)
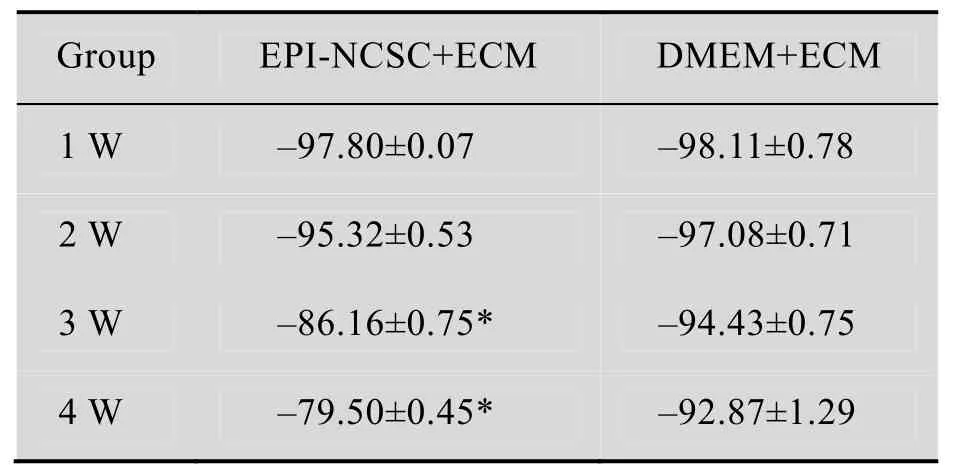
表3 术后不同时间点各组SFI值Table 3 SFI value of time (±s, n=5)
*Values are significantly different at P<0.05 (t-test).
3 讨论
本实验所培养的细胞符合大鼠EPI-NCSC[17]的鉴定特征。通过与 PLGA膜的共培养,EPI-NCSC在 PLGA膜上的初期粘附率为89.7%。EPI-NCSC在1、3、5、7 d时,在PLGA上的细胞相对增殖率分别为 89.3%、87.6%、85.6%和 96.6%。这些都说明 PLGA材料对EPI-NCSC具有很好的亲和性。通过细胞周期及DNA倍体分析,结果显示EPI-NCSC在与PLGA的共培养中,其细胞周期的变化趋势与单独培养的 EPI-NCSC相同。说明 PLGA并不影响EPI-NCSC的细胞周期变化。
在移植4周后,PLGA导管仍然保持着管状形态,这是由 PLGA在动物体内的降解性质所决定的。移植体内被细胞充满,多数细胞显示出绿色荧光。这说明神经断端的细胞和外源性添加的 EPI-NCSC共同参与了神经缺损修复。这些新生组织细胞组成,可能包含了雪旺氏细胞[21]、成纤维细胞和早期神经元或成熟神经元,同时也可能包含了处于不同分化阶段的EPI-NCSC。将EPI-NCSC移植入严重损伤的神经处,该细胞大部分转化为雪旺氏细胞,雪旺氏细胞为神经元的再生提供营养支持。与正常坐骨神经组织相比,移植体内的细胞排列较为松散,这说明,需要为实验动物提供更久的时间,以达到更好的修复效果。在 ECM/DMEM对照组中,神经组织没有再生,移植体内成空泡状,细胞数量明显少于细胞移植组。这说明,外源性添加 EPI-NCSC对于神经缺损的修复是必要的。
在感觉功能检测试验中,大鼠后足回缩的动作,部分可能是由隐神经的感觉作用以及腿部皮肤、肌肉和韧带的弹性回缩。但是,在本实验中,术后各组回缩反射时间随时间变化呈现出一个缩短的趋势,这说明坐骨神经的功能得到了部分恢复。
在运动功能检测试验中, 术后各组SFI值随时间变化体现出一个提高的趋势,这也说明坐骨神经的功能得到了部分恢复。但是,为了更明确地阐明其修复作用,还有很多工作需要开展。比如,需要进一步地阐明在移植部位 (图7E, E′),坐骨神经缺损在修复过程中,新生组织的细胞组成及其来源,以及新增细胞与轴突的间的排列方式等。
4 结论
PLGA材料对EPI-NCSC具有很好的生物相容性。外源性添加 EPI-NCSC对于神经缺损的修复是必要的。在4周的时间内,EPI-NCSC使10 mm缺失的坐骨神经结构和功能得到了部分恢复。
[1]Liu B, Ke JX, Cai SX, et al. Analysis of an acellular pigskin based nerve scaffold. Chin J Biotech, 2012, 28(3): 349–357 (in Chinese).
刘彬, 可金星, 蔡绍皙, 等. 神经支架性质的体外评价. 生物工程学报, 2012, 28(3): 349–357.
[2]Bellamkonda RV. Peripheral nerve regeneration:An opinion on channels, scaffolds and anisotropy.Biomaterias, 2006, 27(19): 3515–3518.
[3]Zhang YJ, Jin Y, Nie X,et al. Tissue engineering peripheral nerve with TGF-β repair sciatic nerve defect. J Biomed Eng, 2007, 24(2): 394–398 (in Chinese).
张勇杰, 金岩, 聂鑫, 等. 复合转化生长因子-β的组织工程化周围神经修复坐骨神经缺损. 生物医学工程学杂志, 2007, 24(2): 394–398.
[4]Young C, Miller E, Nicklous DM, et al. Nerve growth factor and neurotrophin-3 affect functional recovery following peripheral nerve injury differently. Restor Neurol Neurosc, 2001, 18(4):167–175.
[5]Varejao AS, Meek MF, Ferreira AJ, et al.Functional evaluation of peripheral nerve regeneration in the rat: walking track analysis. J Neurosci Met, 2001, 108(1): 1–9.
[6]Rosen JM, Padilla JA, Nguyen KD, et al. Artificial nerve graft using glycolide trimethylene carbonate as a nerve conduit filled with collagen compared to sutured autograft in a rat model. J Rehabil Res Dev,1992, 29(2): 1–12.
[7]Itoh S, Suzuki M, Yamaguchi I, et al. Development of a nerve scaffold using a tendon chitosan tube.Artif Organs, 2003, 27(12): 1079–1088.
[8]Matsumoto K, Ohnishi K, Sekine T, et al. Use of a newly developed artificial nerve conduit to assist peripheral nerve regeneration across a long gap in dogs. ASAIO J, 2000, 46(4): 415–420.
[9]Meek MF, Den Dunnen WF. Porosity of the wall of a nerve conduit hampers nerve regeneration.Microsurgery, 2009, 29(6): 473–478.
[10]Li HY, Liu Y, He XT, et al. Electrospinning technology in tissue engineering scaffolds. Chin J Biotech, 2012, 28(1): 15–25 (in Chinese).
李好义, 刘勇, 何雪涛, 等. 应用于组织工程支架制备的电纺技术. 生物工程学报, 2012, 28(1):15–25.
[11]Guo Y, Liu L, Hao QX, et al. Effects of extracellular matrix producedin vitroon growth and differentiation of MC3T3-E1 cells. Chin J Biotech, 2011, 27(11): 1606–1612 (in Chinese).
郭勇, 刘璐, 郝庆新, 等. 体外培养所形成的细胞外基质对 MC3T3-E1 细胞生长和分化的影响.生物工程学报, 2011, 27(11): 1606–1612.
[12]Liu B, Cai SX, Ma KW, et al. Fabrication of a PLGA-collagen peripheral nerve scaffold and investigation of its sustained release propertyin vitro. J Mater Sci: Mater Med, 2008, 19(3):1127–1132.
[13]Sinis N, Schaller HE, Schulte-Eversum C, et al.Nerve regeneration across a 2-cm gap in the rat median nerve using a resorbable nerve conduit filled with Schwann cells. J Neurosurg, 2005,103(6): 1067–1076.
[14]Li Y, Decherchi P, Raisman G. Transplantation of olfactory ensheathing cells in spinal cord lesions restores breathing and climbing. J Neurosci, 2003,23(3): 727–731.
[15]Mimura T, Dezawa M, Kanno H, et al. Peripheral nerve regeneration by cell-derived Schwann cells in adult rats.transplantation of bone marrow stromal. J Neurosurg, 2004, 101(5): 806–812.
[16]Heine W, Conant K, Griffin JW, et al. Transplanted neural stem cells promote axonal regeneration through chronically denervated peripheral nerves.Exp Neurol, 2004, 189(2): 231–240.
[17]Clewes O, Narytnyk A, Gillinder KR, et al. Human epidermal neural crest stem cells (hEPI-NCSC)characterization and directed differentiation into osteocytes and melanocytes. Stem Cell Rev, 2011,7(4): 799–814.
[18]Delfino-Machín M, Chipperfield TR, Rodrigues FS, et al. The proliferating field of neural crest stem cells. Dev Dyn, 2007, 236(12): 3242–3254.
[19]Hu YF, Gourab K, Wells C, et al. Epidermal neural crest stem cell (EPI-NCSC)-mediated recovery of sensory function in a mouse model of spinal cord injury. Stem Cell Rev, 2010, 6(2): 186–198.
[20]Sieber-Blum M, Schnell L, Grim M, et al.Characterization of epidermal neural crest stem cell(EPI-NCSC) grafts in the lesioned spinal cord. Mol Cell Neurosci, 2006, 32(1/2): 67–81.
[21]Wang A, Tang Z, Park IH, et al. Induced pluripotent stem cells for neural tissue engineering.Biomaterials, 2011, 32(22): 5023–5032.
