兔支气管败血波氏杆菌的分离鉴定及药敏试验
2014-06-18李书光胡琳琳林初文刘吉山杨立芳沈志强
李书光,胡琳琳,李 峰,林初文,张 娜,刘吉山,杨立芳,沈志强
(1.中国农业大学动物医学院,北京 100083;2.山东省滨州畜牧兽医研究院,山东滨州 256600;3.山东绿都生物科技有限公司,山东滨州 256600)
随着家兔集约化、规模化养殖的发展,兔支气管败血波氏杆菌成为困扰家兔养殖业的重要疾病之一。该病原菌在自然界中分布广泛,为家兔的呼吸道常在菌,应激或者其他因素导致机体免疫力下降会引起家兔的慢性鼻炎、咽炎、支气管肺炎及脓包型肺炎等症状[1-2]。该病常发生于春秋季节,不同年龄的家兔均易感。幼兔、仔兔常呈急性型,成年兔一般呈慢性型。一旦兔群发病,能够通过空气传播迅速波及全群,不及时控制该病,能够导致高达50%的病死率。
2014年3月初山东枣庄某大型养殖场带病兔来到山东省滨州畜牧兽医研究院技术服务中心开展疾病诊断。
1 材料与方法
1.1 材料
1.1.1 病料 山东枣庄某兔场送检病兔。
1.1.2 试剂及动物 胰蛋白大豆琼脂(TSA)、胰蛋白大豆肉汤(TSB)培养基,美国BD公司产品;试验用药敏纸片,北京天坛药物生物技术开发中心产品;昆明系小鼠,购自山东大学;试验用30d健康易感兔,购自滨州某兔场,试验前取试验兔鼻拭子进行PCR检测,无兔支气管败血波氏杆菌感染。
1.2 方法
1.2.1 病兔的剖检观察及病料采集 按照常规方法无菌处理家兔体表,观察临床症状,无菌操作取主要病变部位及肝脏、脾脏等组织,为后期试验做好准备。
1.2.2 病原菌的分离 取主要病变组织肺脏新鲜创面,涂布加血的TSA培养基,同时使用脾脏、肝脏等同样做细菌的分离鉴定,培养30h左右,观察分离菌株的生长状态,并挑取典型菌落涂片,革兰染色镜检。
1.2.3 病兔疾病的特异性PCR病原检测 取肝脏、脾脏、肺脏组织开展兔瘟的PCR检测,取分离的优势病原菌开展常见病原菌的多重PCR检测[3]。
1.2.4 药物敏感性试验 无菌放置干燥抗菌药物纸片紧贴于密集划线接种了菌种的培养基表面,每个直径90mm的平皿贴7个药敏纸片,盖上平皿,倒置平皿置37℃温箱培养24h,取出测量观察结果,判断标准按2010版CLSI M100-S20执行,≤5 mm为不敏感;≥6mm≤10mm为低度敏感;≥11 mm≤20mm为敏感;≥21mm为高度敏感。使用筛选到的敏感药物配合波氏杆菌疫苗对兔群进行综合防控。
1.2.5 动物致病性试验
1.2.5.1 小鼠的致病性试验 挑取鉴定纯培养的兔支气管败血波氏杆菌分离株,接种于成品TSB中37℃培养18h后,活菌倍比稀释计数,调整浓度至1×109CFU/mL。10只20g左右的健康昆明系小鼠,随机分成2组,每组5只,1号组腹腔注射0.2mL菌液,2号组腹腔注射等量生理盐水做对照组,隔离饲养观察7d。
1.2.5.2 30d家兔的致病性试验 挑取鉴定纯培养的兔支气管败血波氏杆菌分离株,接种于成品TSB中37℃培养18h后,活菌计数,调整浓度至1×109CFU/mL。6只30d左右的健康、PCR检测无波氏杆菌污染的新西兰白兔,随机分成2组,每组3只,1号组耳静脉注射0.2mL菌液,2号组耳静脉注射等量生理盐水作为对照组,隔离饲养观察14d。
2 结果
2.1 发病状况
该批家兔发病日龄约30d,每天有2%左右的死亡率,用过兔瘟疫苗和瘟巴二联疫苗,没用过波氏杆菌的疫苗,病兔精神不振、被毛蓬乱,有的兔子流脓性鼻液或黏液。剖检可以观察到肺充血水肿,有出血点偶见化脓灶,鼻腔、咽喉部及气管内有淡黄色黏液,其他临床症状不明显。
2.2 病原菌的分离培养
取病死兔的肺脏、肝脏、脾脏进行病原菌的分离培养;脾脏和肝脏病料在TSA培养基上基本无细菌生长,肺脏病料有两种菌落生长(经鉴定另一种为大肠埃希菌),其中一种优势菌菌落光滑致密,呈灰白色突起。经革兰染色镜检为革兰阴性短小杆菌,大小均一(图1)。
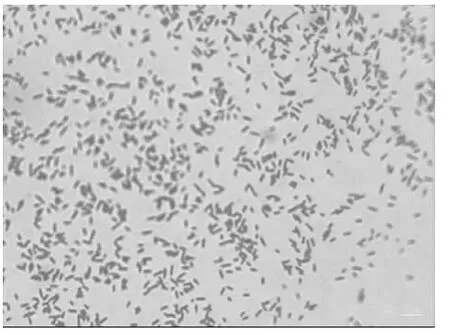
图1 分离菌的革兰染色镜检(1 000×)Fig.1 Gram staining bacterial under microscope(1 000×)
2.3 病原菌的PCR种属鉴定
挑取单菌落进行PCR种属的鉴定,图2中显示可见260bp处有一条目的条带,可以确定该分离株为兔支气管败血波氏杆菌。
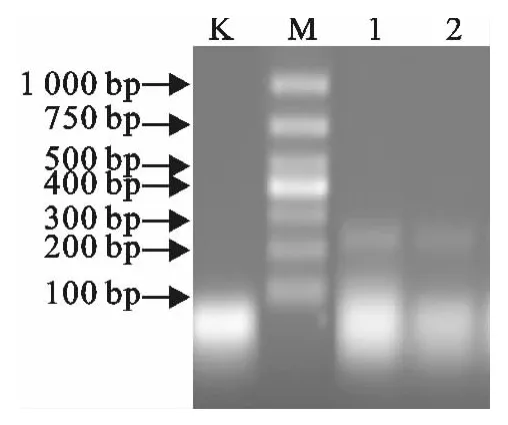
图2 波氏杆菌PCR鉴定Fig.2 PCR identification of Bordetella
2.4 药物敏感试验
药敏试验结果显示,氟苯尼考、多西环素、红霉素为高敏药物;四环素、链霉素中敏;对阿莫西林等9种药物耐药,试验数据见表1。

表1 药物敏感性试验结果Table 1 The results of drug susceptibility test
2.5 致病性试验
昆明系小鼠在接种后表现精神沉郁,16h左右时1号攻毒组5只全部死亡,2号对照组一切正常。家兔组1号攻毒组和2号对照组,观察7d均未死亡,且没有明显的症状差异,攻毒7d后剖检观察,1号攻毒组未出现明显的肺脏异常,仅鼻腔出现轻微的充血和稍浑浊黏液。证实该分离株对小鼠有一定的致病力,但是对健康家兔致病力不强。
2.6 药物防治
根据病原分离结果及药敏试验结果,使用波氏杆菌疫苗紧急防疫并配合氟苯尼考针剂注射,迅速控制了兔群的持续性死亡。
3 讨论
根据发病兔中分离菌的培养特性、染色镜检、PCR检测等快速确定病兔肺脏优势分离病原菌为兔支气管败血波氏杆菌[4]。该病原菌对昆明系小鼠具有较强的致病性,但是在使用本动物进行攻毒试验时,未出现典型的发病和病变,可能和实验动物中心养殖环境较好有关,在该试验条件下无法复制发病兔场的应激环境[5-6]。另外,在本试验中使用肺脏进行病原菌分离鉴定,其中还有一种细菌经PCR鉴定为大肠埃希菌,其分离率仅为1%~2%,因此,可以确定本次疫情的主要致病菌是兔支气管败血波氏杆菌。
兔支气管败血波氏杆菌的传统鉴定方法主要是病原菌的革兰染色、镜检及生化试验,在本文试验过程中采用传统方法和分子生物学相结合的试验方法[7-8],首先使用传统方法进行革兰染色镜检确定细菌的大致形态,为分子生物学检测方法指明方向,在此基础上挑取疑似菌株PCR引物进行鉴定,在短时间内快速确定病原菌株。传统方法和分子生物学方法相结合,省去了生化试验的步骤,同时比单纯的分子生物学大范围的筛选鉴定要节约很多试剂和时间,在生产实践的一线更具有实际应用意义[9]。
本次病例发生的兔场相对规模较大,主要的疫苗如兔瘟疫苗、巴氏杆菌疫苗、产气荚膜梭菌疫苗等均已经按照防疫程序正常免疫,忽略了波氏杆菌疫苗的防疫,造成了本次疫情的发生。在管理良好的兔场,发生兔波氏杆菌一般较少,但是在天气变化、饲养人员变动等应激条件下,若场内有波氏杆菌的存在,则会导致兔群暴发该病。本病的预防措施主要是搞好环境卫生,防止外来病原菌的入侵[10-11]。由于病原菌的入侵途径的多样化和不可预测性,不要存在侥幸心理过度相信厂区的管理水平,做好兔群波氏杆菌的正常防疫,提高饲养管理水平,减少兔群应激,降低条件性致病菌的发病概率[12-13]。
[1]曲永成,邸文礼,王宝双.兔支气管败血波氏杆菌病的诊治[J].养殖技术顾问,2013(5):208.
[2]张国胜,张克文,鹿明广.兔波氏杆菌病[J].中国畜禽种业.2012(5):111.
[3]赵战勤,裴 洁,薛 云,等.猪源支气管败血波氏杆菌的分离鉴定及生物学特性研究[J].中国农业科学,2008(12):4209-4217.
[4]王 伟,朱瑞良,李新苍,等.兔支气管败血波氏杆菌的分离鉴定及其免疫原性检测[J].中国兽医学报,2008(8):897-900.
[5]林锦鸿.兔的支气管败血波氏杆菌感染实验[J].国外兽医学:畜禽疾病,1983(6):30-33.
[6]刘荣欣,鲁改儒,聚 芹.中药方剂对幼兔生长性能及免疫功能的影响[J].动物医学进展,2013,34(7):127-130.
[7]钱 微,刘 燕,肖琛闻,等.兔支气管败血波氏杆菌TaqMan荧光定量PCR检测方法的建立与应用[J].农业生物技术学报,2013(4):498-504.
[8]王一霖,孟 洋,王丽萍,等.兔支气管败血波氏杆菌的分离与鉴定[J].野生动物,2013(4):226-228.
[9]熊富强,王 芳,恽时锋,等.兔支气管败血波氏杆菌双夹心ELISA检测方法的建立[J].江苏农业学报,2010(1):120-125.
[10]李长安,方艳琴,陈晓霖,等.兔支气管败血波氏杆菌的分离与鉴定[J].西北农业学报,2011(10):16-19.
[11]王雪鹏,麻名文.兔支气管败血波氏杆菌病的实验室诊断[J].山东畜牧兽医,2010(4):23.
[12]汪 洋,赵德明.一起兔支气管败血波氏杆菌病的诊治[J].中国畜牧兽医,2008(8):93-94.
[13]李 峰,沈志强,管 宇,等.兔支气管败血波氏杆菌的分离与鉴定[J].畜牧与兽医,2008(9):68-70.