自组装白蛋白纳米粒的制备及体外释药行为
2014-06-15王志昆孙晓岩王东凯
王志昆,张 欢,孙晓岩,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
自组装白蛋白纳米粒的制备及体外释药行为
王志昆,张 欢,孙晓岩,王东凯*
(沈阳药科大学 药学院,辽宁 沈阳 110016)
目的以紫杉醇为难溶性药物模型,制备自组装紫杉醇白蛋白纳米粒。方法 谷胱甘肽作为还原剂,经细胞超声制备白蛋白纳米粒,通过正交试验筛选出最优处方。结果结果表明BSA浓度为1.5 g•L-1,谷胱甘肽用量为90 mg,紫杉醇/白蛋白质量比为1∶20时,可以制备出表面圆整,粒径为91.19 nm,zeta电位-12.8 mv,包封率为90.8%,载药量为4.5%的紫杉醇白蛋白纳米粒,体外药物释放符合peppas模型,n=0.29,主要以扩散释药为主。结论 自组装法制备出的白蛋白纳米粒粒径均一可控,并可显著提高白蛋白对难溶性药物的包封率。
药剂学;白蛋白纳米粒;自组装;紫杉醇;粒径
蛋白质具有无毒、生物相容性好、可降解等特点,因而备受科研工作者们的青睐。从来源上常用的有2种,即植物蛋白和动物蛋白。其中,又以人血清白蛋白和牛血清白蛋白作为药物载体应用的最为广泛。2005年,由FDA批准上市的用于治疗乳腺癌的Abraxane®,就是以人血清白蛋白包载紫杉醇研制成功的纳米制剂,其毒性小、使用方便、靶向性强,治疗效果远远优于传统的Taxol®。基于此研发出的多西紫杉醇、雷帕霉素、烯丙基氨基格尔德霉素的白蛋白纳米制剂也已进入临床研究[1]。
常见的白蛋白纳米粒制备方法为去溶剂化法和乳化超声法[2]2种,前者应用于难溶性药物包封率极低,后者则因制备出的粒径较大,且油相极难除去而受到限制。为解决上述问题,本文作者选用了来源广泛、价格便宜的牛血清白蛋白作为难溶性药物载体,以安全无毒的谷胱甘肽作还原剂,诱发白蛋白自组装形成白蛋白纳米粒,再经细胞超声粉碎进一步控制和减小粒径。此种方法不仅可以控制粒径在几百纳米以下,而且可以有效提高难溶性药物的包封率。制备过程中无需使用有毒的溶剂如二氯甲烷、氯仿等,仅使用少量乙醇。另外,纳米粒表面保留了丰富的游离氨基,有利于对纳米粒表面进行进一步的修饰(例如聚乙二醇化、叶酸修饰等)以提高制剂的靶向性,因此本方法具有广泛的应用前景。
1 仪器与材料
BS110S型精密电子天平(北京Sartorius仪器系统有限公司),PB-10 Sartorius 普及型pH计(德国Sartorius股份公司),Zetasizer Nano ZS90粒度测定仪(英国Malvern公司),PF-101T集热式恒温磁力搅拌器(巩义市英峪予华仪器厂),TGL-16G台式高速离心机(上海医用分析仪器厂),JEM-100B透射电镜(日本JEOL公司),LC-10A高效液相色谱仪(日本Shimadzu公司)。
紫杉醇原料药(武汉神曲生物化工有限公司,含量质量分数为99%,批号∶120812),牛血清白蛋白(Ⅴ,安徽合肥Biosharp生物科技公司),透析袋(美国Viskase公司,截留相对分子质量∶8 000~14 000),三硝基苯磺酸、氯化钠、乙醇(分析纯,市售),乙腈(色谱纯,市售)。
2 方法与结果
2.1 检测方法的建立
2.2.1 高效液相色谱法测定紫杉醇含量
经紫外扫描,确定检测波长为227 nm。经筛选优化,确立流动相组成及比例为V(乙腈):V(水)=60∶40,进样体积10 μL,流速1.0 mL•min-1,样品经0.22 μm微孔滤膜过滤。该条件下,紫杉醇保留时间约8 min,溶剂、白蛋白等对紫杉醇的测定无干扰,色谱图见图1。经方法学研究,紫杉醇在1.09~54.4 mg•L-1质量浓度内线性良好(A=38384ρ-386.27,r=0.999 9);低(1 mg•L-1)、中(20 mg•L-1)、高(50 mg•L-1)3个质量浓度的平均回收率为100.1%,RSD为1.21%;日内精密度和日间精密度良好(RSD<2.0%);溶液室温24 h内的稳定性良好(RSD=1.99%)。上述结果表明建立的HPLC法适用于紫杉醇含量检测。
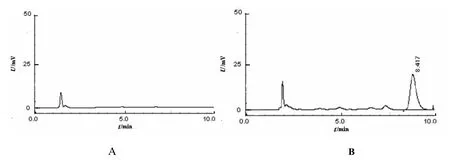
图 1 白蛋白和紫杉醇白蛋白纳米粒的高效液相色谱图Fig. 1 The HPLC chromatograghs of BSA and PTX-BSA-NPs
2.2.2 包封率和载药量的测定
取紫杉醇白蛋白纳米粒适量,高速离心(15 000 r•min-1,30 min),分离得到上清液。另取纳米粒适量置量瓶中,加入乙腈,超声10 min,充分提取药物,乙腈定容。按“2.2.1”条分别测定上清液和总的药物浓度,计算包封率和载药量。包封率(EE /%)=/ ρ总× 100%;载药量式中,ρ总为总的药物质量浓度(g•L-1),ρ游离为游离的药物质量浓度为紫杉醇的加入质量(mg),m总为载药纳米粒的总质量(mg)。
2.2.3 表面游离氨基的测定
取0.1 g•L-1的三硝基苯磺酸(trinitro-benzene-sulfonic acid ,TNBS)溶液250 μL,加入到500 μL 0.5 g•L-1的白蛋白纳米粒中,37 ℃振摇2 h。高速离心30 min(15 000 r•min-1),取上清液。用紫外分光光度计在345 nm处测定未反应的TNBS[3-4]。另取TNBS,用重蒸水代替纳米粒,同法操作。经计算单位质量纳米粒中所含表面活性氨基的摩尔数为6.46。
2.2.4 成球率的测定
取紫杉醇白蛋白纳米粒溶液适量,高速离心30 min(15 000 r•min-1),取上清液,蒸馏水稀释适宜倍数,与考马斯亮兰应用液反应10 min,于595 nm处测定吸光度,代人标准曲线方程计算得到未去溶剂化的BSA(bovine serum albumin)浓度[5-6]。纳米粒收率(%)=(投入的BSA总量-未形成纳米粒BSA量)/投入的BSA总量×100%。
2.2.5 纳米粒的形态、粒径及zeta电位
取处方优化纳米粒混悬液适量,加去离子水稀释10倍,摇匀[7-8]。用Malvern激光散射粒度分析仪测定粒径分布及zeta电位(见图2)。取经稀释100倍的白蛋白纳米粒混悬液,磷钨酸负染,透射电镜观察粒子形态(见图3)。由图3可见,纳米粒呈类球形。由图2可见,平均粒径为91.19 nm, zeta电位为-12.8 mV,表明白蛋白纳米粒比较稳定。
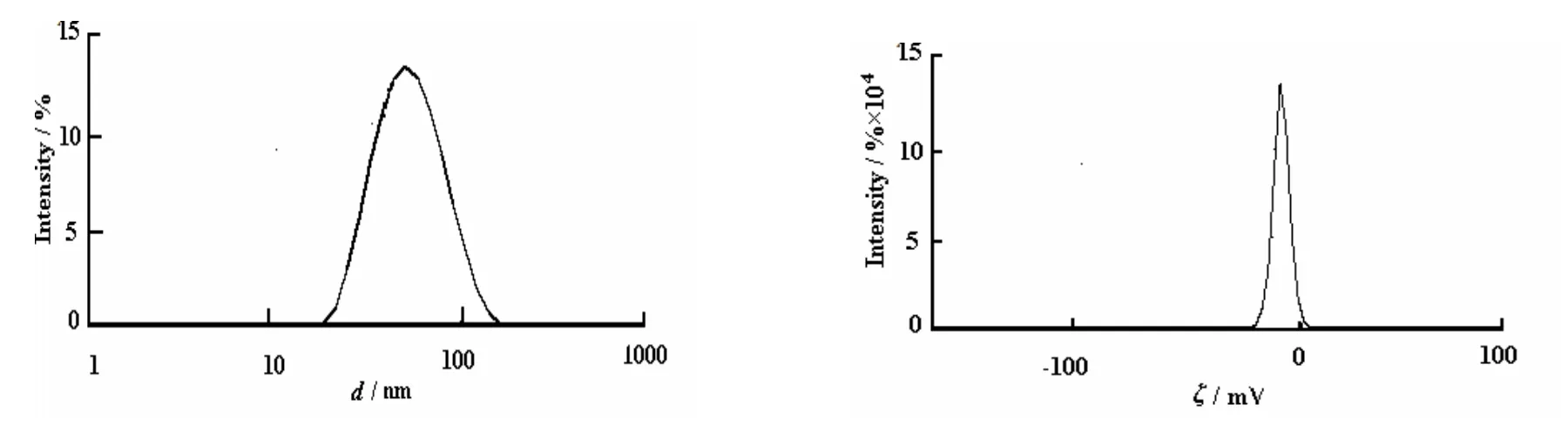
图 2 紫杉醇白蛋白纳米粒的粒径分布及zeta电位Fig. 2 Size distribution and zeta potential of PTX-BSA-NPs

图 3 紫杉醇白蛋白纳米粒的透射电镜照片Fig. 3 TEM photograph of PTX-BSA-NPs
2.2.6 DSC曲线的测定
分别取紫杉醇原料药、牛血清白蛋白、两者的物理混合物、以及紫杉醇白蛋白纳米粒粉末适量,测定DSC曲线(见图4)。由图可见,紫杉醇白蛋白纳米粒中的DSC曲线未出现紫杉醇(223.9 ℃)的吸收峰,而且有新的吸收峰(216.3 ℃)出现,因此说明紫杉醇被白蛋白包裹,纳米粒形成。
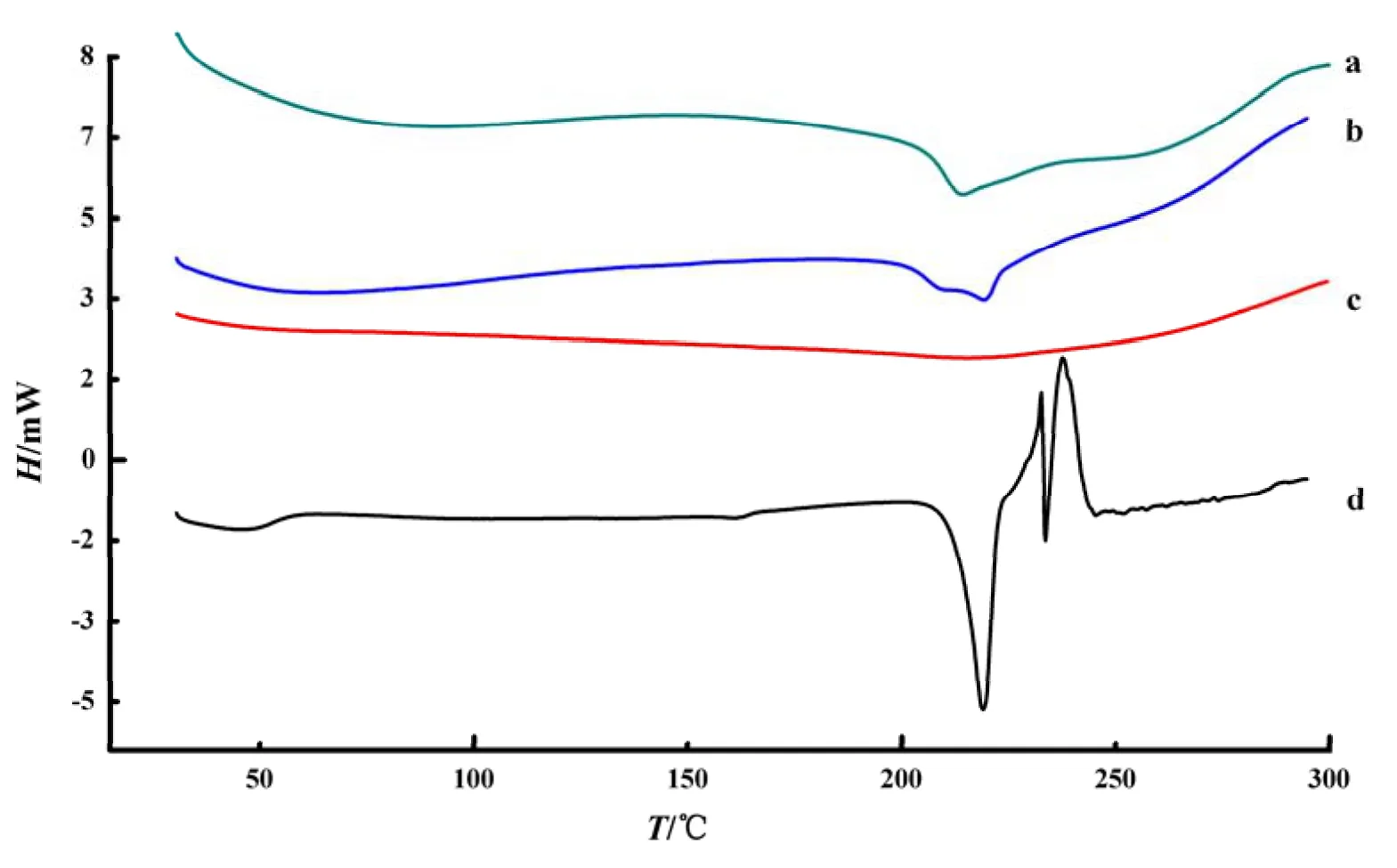
图 4 差示扫描量热法分析结果Fig. 4 The results of DSC analysis
2.2 紫杉醇白蛋白纳米粒的制备
称取牛血清白蛋白(BSA)20 mg,加入20 mL 0.01 mol•L-1的磷酸盐缓冲溶液(pH8.0),超声2 min,使白蛋白充分溶解。置于75 ℃的水浴锅中,预热5 min。搅拌下加入紫杉醇的乙醇溶液100 μL(10 g•L-1),随即加入100 mg谷胱甘肽,充分搅拌,使溶解,保持反应体系15 min。细胞超声(700 W,超声时间3 s,间隔2 s)20次,将纳米粒转移至透析袋中,透析10 h,除去残留的谷胱甘肽和游离药物。
2.3 处方筛选及优化
经过单因素初步考察,确定影响紫杉醇白蛋白纳米粒的粒径和包封率的主要因素为牛血清白蛋白的浓度,谷胱甘肽浓度及紫杉醇/牛血清白蛋白的比例。采用正交试验设计L9(34)对处方做进一步的筛选。各因素及水平见表1。
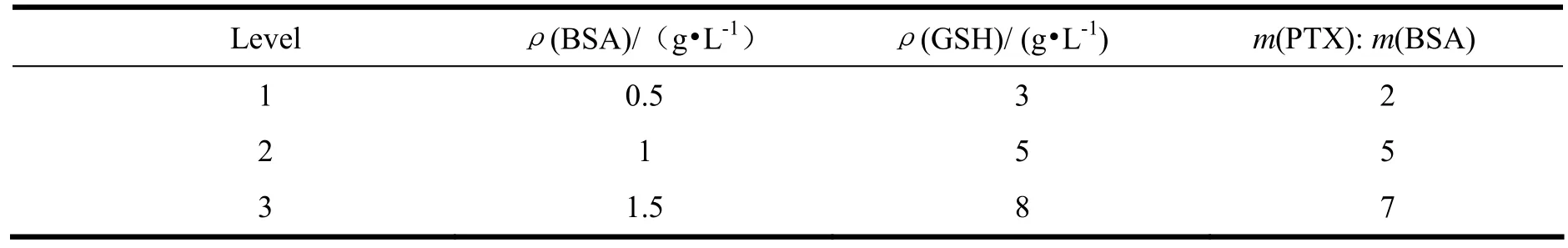
表 1 正交设计因素及水平Table 1 Factors and levels of orthogonal design
以包封率及粒径为主要评价指标,正交试验结果如表2。
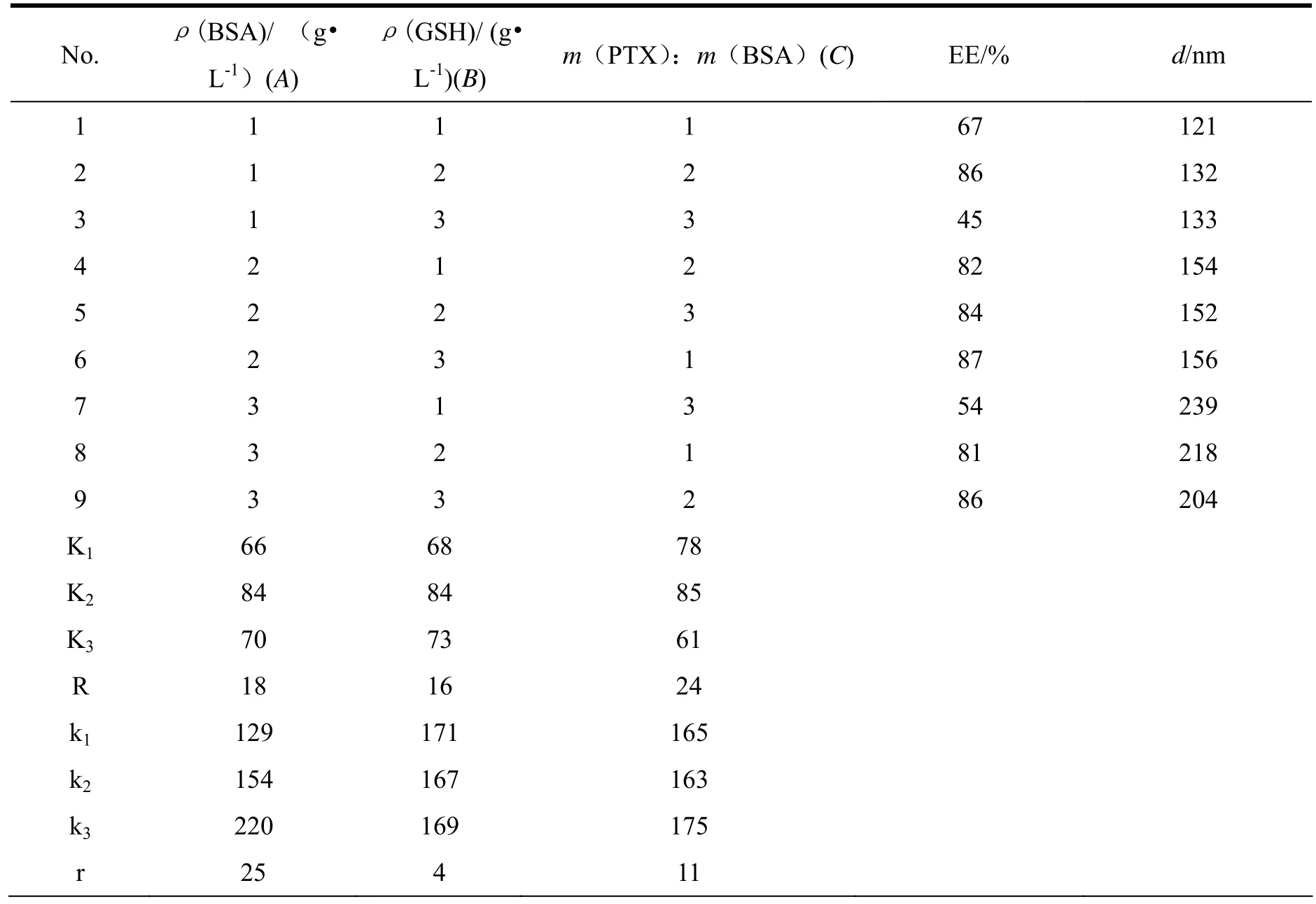
表 2 正交设计粒径和包封率的结果Table 2 The orthogonal experimental results of particle size and EE%
对正交实验表进行极差分析可知,对于粒径来说, 各因素影响的主次顺序是A> C > B,由此得出各因素的最优化组合为A1C2B2。对于包封率来说, 各因素影响的主次顺序是 C>A>B,最优化组合为C2A2B2.。综合分析,在粒径满足要求的前提下,为获得更高的包封率,因此最终优选组合为C2A2B2.。即蛋白质质量浓度1.0 g•L-1,谷胱甘肽5 g•L-1,紫杉醇和白蛋白的质量比为1∶20时,可以获得最优处方。根据所筛选的最优处方,制备3批纳米粒,制备出的紫杉醇白蛋白纳米粒的平均粒径为(91.19 ±2.30) nm,zeta电位(-12.8±0.8) mv,包封率为90.8%,载药量为4.5%,收率为92.3%。说明该处方工艺制备稳定,可重复性强。
2.4 体外释放曲线
移取3份5 mL最优处方紫杉醇白蛋白纳米粒于透析袋中,置于80 mL含1 g•L-1吐温80的磷酸盐缓冲液(pH 7.4)的释放介质中[9-10],37 ℃恒温水浴搅拌,分别于0.5、1、2、4、6、8、12、18、24、36和48 h取出1 mL溶液 (补加1 mL释放介质),样品稀释适当倍数,并按“2.2.1”条件测定紫杉醇含量,然后计算累积释放量,绘制释放曲线。见图5。然后将此释药数据分别用零级、一级、Higuchi以及Peppas方程拟合,结果可见,以Peppas(n=0.29)方程拟合较佳 (见表3)。n=0.29表明该制剂体外释放以扩散机制为主。
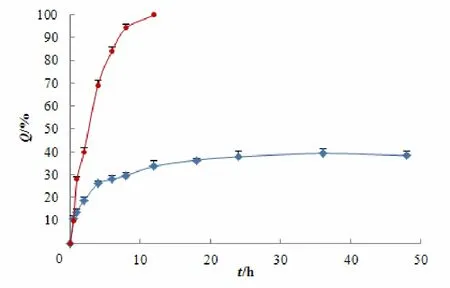
图 5 紫杉醇纳米粒在含1 g•L-1吐温80的pH7.4磷酸盐缓冲液中的释放曲线(n=3)Fig. 5 The release profile of PTX from NPs in 1 g•L-1 Tween80 phosphate buffer(pH=7.4,n=3)
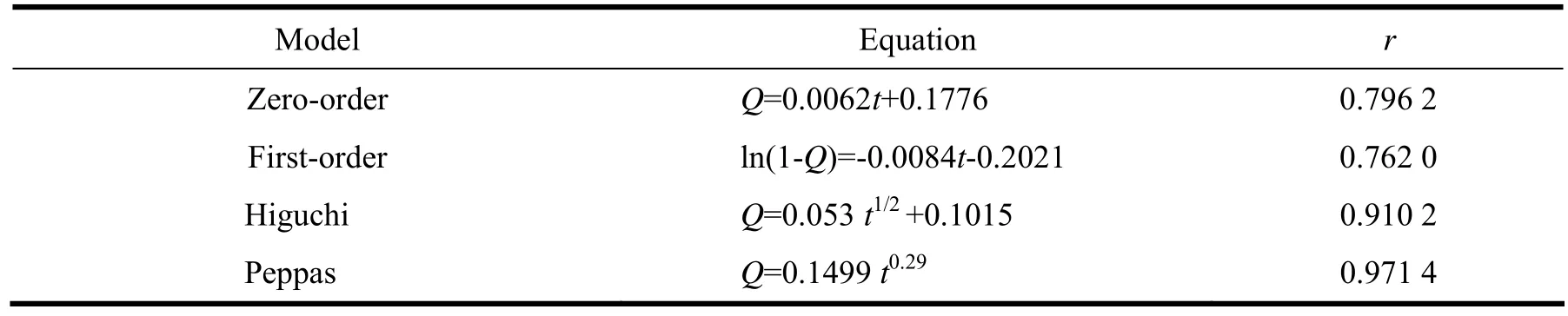
表 3 最优处方释放曲线的拟合结果Table 3 Models of release fitting and correlation coefficient of the optimized formulation
3 讨论
有文献报道,以2-巯基乙醇作还原剂[10-13],制备载药白蛋白纳米粒。但是2-巯基乙醇的毒性极大,并不适用于药物制剂的制备。因此,本研究中,作者选用安全无毒的谷胱甘肽作为体系的还原剂,诱导BSA自组装形成白蛋白纳米粒。
谷胱甘肽具有良好的还原特性,加热条件下可以使BSA中的二硫键打开,从而引发BSA的空间构型的改变。这种空间构型的变化,促使BSA的疏水性基团暴露出来,此时疏水性药物(如PTX)通过疏水作用迅速地与BSA顺利的结合。随着体系温度的降低,反应终止,此时二硫键重新形成,BSA包载疏水性药物形成纳米粒。再经过细胞超声的作用,同样地,产生出的能量可将纳米粒粒径进一步减小,且更加均一稳定。有研究表明[11],药物的加入量直接影响着药物在载体中的存在方式,即载药量较小时,BSA包裹药物形成实心球,形成一种壳-核的结构;而载药量进一步增大,药物和载体形成一种结合物,没有明显的壳-核结构。
与传统方法相比,本研究中,作者所用制备工艺更加简单,且没有使用有毒试剂(如戊二醛、二氯甲烷、2-巯基乙醇等),而且乙醇用量极低,在反应体系加热过程中基本上挥发完全,因此更加安全。更突出的是对疏水性药物极高的包载率,可达90%以上,这是传统的去溶剂化法很难达到的。另外该方法基本不会破坏BSA的结构,由于没有使用交联剂,很好地保留了白蛋白表面的游离氨基,因此有利于制剂的进一步修饰,增加制剂的靶向性延长药物的循环时间。
由释放曲线可见,市售紫杉醇注射液在10 h左右释放完全。而所制得的PTX-BSA-NPs体外释放具有明显的缓释特征。在0.5 h内的释放量在10%(<40%)左右,这主要与BSA靠近表面的药物释放有关,20 h过后释药逐渐趋于平缓,24 h累积释药量基本保持不变,达到40%左右。此时,包裹在BSA内部疏水结构中的药物并未完全释放,随着BSA在更强的条件(例如酶的降解作用)下不断降解,释药可能会更加的完全。释放曲线经peppas模型拟合,计算n=0.29,进一步说明所制备的白蛋白纳米粒释放药物是以扩散为主的释药行为。
4 结论
本研究中,作者以紫杉醇为疏水性药物模型,经处方筛选优化制备出的自组装白蛋白纳米粒,具有外形圆整、粒径均一和高包封率的特点,适用于难溶性药物的白蛋白纳米制剂的制备。
[1] CHETAN Y, DIPESH B, IMRAN V, et al. Proteins∶ emerging carrier for delivery of cancer therapeutics-a review [J]. Expert Opin Drug Deliv, 2013, 10(10)∶ 1429-1447.
[2] WEBER C, KREUTER J, LANGER K. Desolvation process and surface characteristics of HSA-nanoparticles[J]. Int J Pharm, 2000, 196(2)∶ 197-200.
[3] HASAN K, SEYED A S, AMIR M, et al. Optimization of PEGylation conditions for BSA nanoparticles using response surface methodology[J]. AAPS PharmSciTech, 2013, 3(11)∶ 1206-1211.
[4] 张良珂, 侯世祥, 宋相容, 等. 一种白蛋白纳米粒的制备与评价[J]. 中国药学杂志, 2007, 5(42)∶365-367.
[5] 张晓燕, 平其能. 多西紫杉醇白蛋白纳米粒的制备及体外评价[J]. 药学进展, 2008, 5(32)∶223-227.
[6] 王孝平, 邢树礼. 考马斯亮蓝法测定蛋白含量的研究[J]. 天津化工, 2009 3(23)∶40-41.
[7] ULBRICH K, MICHAELIS M, ROTHWEILER F, et al. Interaction of folate-conjugated human serum albumin (HSA) nanoparticles with tumour cells [J]. Int J Pharm, 2011, 406(1-2)∶ 128-134.
[8] JUN J Y, NGUYEN H H, PAIK S, et al. Preparation of size-controlled bovine serum albumin (BSA) nanoparticles by modified desolvation method [J]. Food Chem, 2011, 127(4)∶ 1892-1898.
[9] WANG Hai, ZHAO Ying WU Yan, et al. Enhanced anti-tumor efficacy by co-delivery of doxorubicin and paclitaxel with amphiphilic methoxy PEG-PLGA copolymer nanoparticles [J]. Biomaterials, 2011, 32(32)∶ 8281-8290.
[10] YUAN A-hu, WU Jin-wei, SONG Chen-chen, et al. A novel self-assembly albumin nanocarrier for reducing Doxorubicin-mediated cardiotoxicity[J]. J Pharm Sci, 2013, 102(5)∶ 1626-1635.
[11] JIANG Li-qun, XU Yi-sheng, LIU Qi, et al. A nontoxic disulfide bound reducing method for lipophilic drug-loaded albumin nanoparticle preparation∶Formation dynamics, influencing factors and formation mechanisms investigation [J]. Int J Pharm, 2013, 443(1-2) ∶80-86.
[12] GONG Guang-ming, ZHI Feng, WANG Kai-kai, et al. Fabrication of a nanocarrier system through self-assembly of plasma protein and its tumor targeting[J]. Nanotechnology, 2011, 22(29) ∶295603.
[13] GONG Guang-ming, XU Yan, ZHOU Yuan-yuan, et al. Molecular switch for the assembly of lipophilic drug incorporated plasma protein nanoparticles and in vivo image[J]. Biomacromolecules, 2012, 13(1) ∶23-28.
Fabrication of albumin nanoparticles through self-assembly and its in vitro release characteristics
WANG Zhi-kun, ZHANG Huan, SUN Xiao-yan, WANG Dong-kai*
(School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China)
ObjectiveTo fabricate albumin nanoparticles through self-assembly of BSA, using paclitaxel as a model drug. Methods Glutathione was applied as reducing agent to prepare albumin nanoparticles through ultrasonic cell disrupting, and orthogonal design was used to optimize the formulation. Results Spherical paclitaxel albumin nanoparticles were made with mean particle size 91.19 nm , Zeta potential -12.8 mv , drug entrapment efficiency 90.8% and drug loading 4.5%.The mechanism of release was drug diffusion from matrix by fitting drug release data with Peppas model. Conclusion Albumin-bound hydrophobic drug nanoparticles with controlled particle size and high encapsulation efficiency were obtained through self-assembly method.
pharmaceutics; albumin nanoparticles; self-assembly method; paclitaxel; particle diameter
R 943
A
(2014)04–0115–08
(本篇责任编辑:曹霞)
2014–03–21
王志昆(1988–),女(汉族),黑龙江牡丹江人,硕士研究生,E–mail zhikunmishu@163.com;*通讯作者:王东凯(1962–), 男(汉族),辽宁沈阳人,教授,博士,博士生导师,主要从事药物新剂型的研究, Tel. 024-23986310, E–mail wangycsyphu@126.com。
