番茄红素对大鼠脑缺血再灌注损伤的保护作用及脑组织caspase-3表达的影响
2014-06-14匡稳定匡双玉周容容
匡稳定,匡双玉,周容容,李 熠
(1南华大学附属第二医院,湖南衡阳421001;2南华大学医学院诊断学教研室)
番茄红素是类胡萝卜素中的一种,其通过抗氧化、清除自由基、诱导细胞间信息传递、抑制增殖、增加免疫力等多种生物样作用,起到防癌抗癌、预防心血管疾病、提高免疫功能和延缓衰老等作用。国外流行病学资料显示,高番茄红素摄入量的人群有较低的心脑血管疾病发病率,血浆低番茄红素有更高的急性心肌梗死和脑卒中的危险性[1~7]。2011年9月~2012年3月,我们通过建立大脑中动脉缺血模型,观察了番茄红素对大鼠脑缺血再灌注损伤的保护作用及脑组织天冬氨酸特异性半胱氨酸蛋白酶(caspase)-3表达的影响。
1 材料与方法
1.1 材料 雄性SD大鼠(南华大学动物实验部购买)36只,番茄红素(Sigma公司),DAB染色试剂盒(武汉博士德生物工程有限公司),BCA蛋白定量试剂(Hyclone.Pierce公司),caspase-3抗体(Santa Cruz公司),其他试剂均为进口或国产分析纯。CO2培养箱(美国Shill公司);病理组织切片机(美国AO公司);光学显微照相系统(日本 Olympus公司);垂直电泳仪及转膜系统(美国BioRad公司)。
1.2 大鼠脑缺血模型制备及番茄红素给予方法 参照文献[8]的方法,利用线栓法制备SD大鼠大脑中动脉缺血模型。栓线选用冠王牌2.0号鱼线(直径0.235 mm),用头端接近烁热的烙铁,加热成光滑球面,光镜下打磨,使得头端光滑圆钝,直径为0.25~0.30 mm,截断为5cm长。模型制备成功后将36只大鼠随机分为3组各12只,对照组以羧甲基纤维素钠溶液灌胃,番茄红素组以40 mg/kg番茄红素(羧甲基纤维素钠悬溶)灌胃,银杏叶片组以40 mg/kg银杏叶片(羧甲基纤维素钠悬溶)灌胃,共干预14 d。
1.3 大鼠神经行为学评估 按照Bederson6级5分评分标准[9],由不知情观察者进行神经行为学评分(灌胃120 h及14 d后),真实记录各大鼠神经行为学评分。选取评分为1~4分的大鼠,删除有蛛网膜下腔出血症状的大鼠,每组缺失大鼠在后续实验中补充。评分分为0分(5级:无功能障碍)、1分(4级:对侧上肢不能完全伸展)、2分(3级:向对侧推时抵抗力下降)、3分(2级:提尾时向对侧转圈)、4分(1级:自动转圈)、5分(0级:无自发性活动伴意识障碍)。
1.4 大鼠脑组织病理学观察 暴露大鼠心脏及腹主动脉,于腹主动脉处抽血2 mL缓慢注入试管中,夹闭腹主动脉,从左心室插管至主动脉弓,剪除右心耳,用生理盐水快速灌注冲洗至右心耳流出液清亮后,再用备好的多聚甲醛灌注,灌注早期可见大鼠全身肌肉抽搐,后期全身僵硬,灌注约30 min后,断头取脑,在视交叉及其后4 mm两处作冠状切片,片厚约4 mm,用4%多聚甲醛固定6 h,再用0.1 mol/L PBS浸泡过夜,-20℃冰箱保存,用梯度乙醇脱水,二甲苯透明标本,最后石蜡包埋保存,显微镜下观察。
1.5 大鼠脑组织caspase-3检测 大鼠脑组织匀浆裂解后,5 000 r/min离心去除沉淀,BCA试剂测定蛋白含量,上样缓冲液调各组蛋白浓度使各组一致,经10%SDS-聚丙烯酰胺凝胶,电泳2 h(积层胶80 V,分离胶120 V)后电转移(4℃,100 mA,3 h)至聚偏二氟乙烯膜上,丽春红染色观察转移效果,并确定蛋白相对分子质量标准的位置。用含5%脱脂奶粉的TBST封闭1 h,按1∶1 000加入兔抗鼠caspase-3一抗,37℃孵育2 h,TBST洗3次,1∶2 000加入辣根过氧化物酶标记羊抗兔二抗,37℃孵育0.5 h,TBST洗3次后,用Western blotting荧光检测试剂盒显影、定影。结果用图象分析仪分析,按照各组灰度面积计算caspase-3相对表达值。
1.6 统计学方法 采用SPSS10.0统计软件。计量资料以±s表示,两样本均数比较采用t检验。P≤0.05为差异有统计学意义。
2 结果
2.1 大鼠神经功能缺损程度评分比较 结果见表1。
表1 三组大鼠神经功能缺损程度评分比较(分,±s)
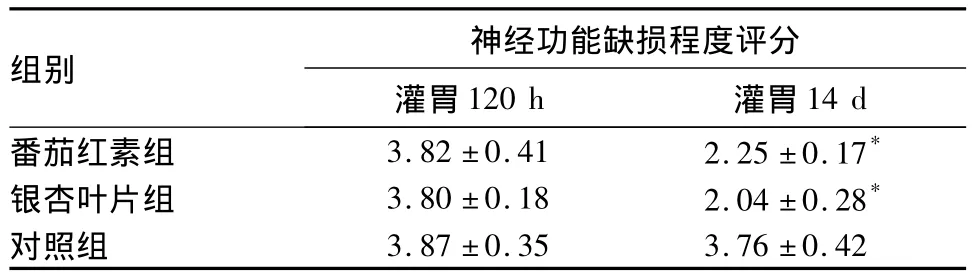
表1 三组大鼠神经功能缺损程度评分比较(分,±s)
注:与对照组比较,*P <0.05
组别14 d番茄红素组 3.82±0.41 2.25±0.17神经功能缺损程度评分灌胃120 h 灌胃*银杏叶片组 3.80±0.18 2.04±0.28*对照组3.87±0.35 3.76±0.42
2.2 大鼠脑组织病理学变化 结果见图1~3(各组随机选1只)。由图1~3可见,对照组神经组织大片坏死,周围残存组织结构不完整,神经细胞水肿明显,大量空泡形成。番茄红素组与银杏叶片组神经组织结构明显改善、坏死区域缩小,梗死灶周围残存组织较多。
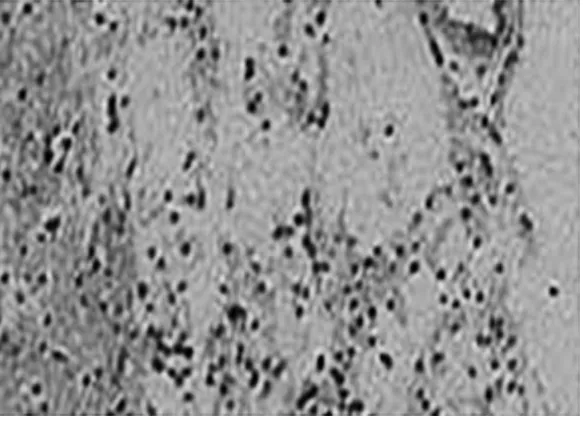
图1 对照组大鼠脑组织病理学变化

图2 番茄红素组大鼠脑组织病理学变化
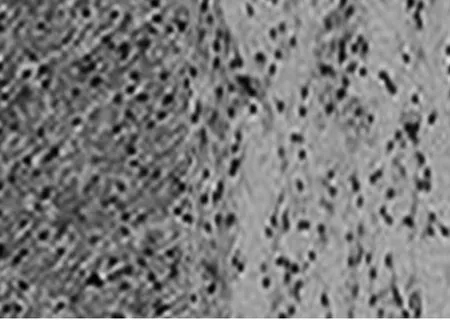
图3 银杏叶片组大鼠脑组织病理学变化
2.3 大鼠脑组织caspase-3表达变化 番茄红素组、银杏叶片组、对照组caspase-3表达相对值分别为0.2、0.15、1,番茄红素组、银杏叶片组与对照组比较,P 均 <0.05。
3 讨论
脑血管病是导致人类死亡的三大疾病之一,也是中老年人致残的主要原因,其中缺血性脑血管病在脑血管疾病中的发病率最高,脑缺血一定时间后血液恢复供应,其功能不但未能恢复,而且出现了更加严重的脑机能障碍,称之为脑缺血再灌注损伤[10]。由于其病因较多,发病机制复杂,临床上尚缺乏特效的治疗药物,现已成为目前国内外研究的热点之一,因此积极探讨和研究防治脑缺血再灌注损伤的药物具有重要的临床意义。
番茄红素是类胡萝卜素中的一种,近年来其主要用于抗肿瘤的研究,它对心血管系统的作用主要集中在降脂、抗氧化等方面,而目前番茄红素对脑组织缺血再灌注作用的研究较少。一般认为,番茄红素通过高效猝灭单线态氧及清除过氧化自由基、阻断亚硝胺形成、抑制细胞增殖、诱导细胞分化、增加免疫力、减少DNA损伤及对细胞间隙连接通讯的影响等多种作用方式,起到防癌抗癌、预防心血管疾病发生的作用[11,12]。Fujita 等[13]发现,番茄红素可以促进抗氧化酶活性,防止脑缺血再灌注损伤。本研究显示,番茄红素组干预14 d大鼠神经行为缺损得到一定程度改善,脑组织坏死区域缩小,提示番茄红素对大鼠脑缺血再灌注损伤有一定的保护作用。
脑缺血再灌注损伤是脑缺血后脑组织恢复血流灌注时引起脑细胞更严重损伤的一种病理生理现象,其发生、发展是一个复杂的过程,其中包括许多环节,如线粒体损伤、钙超载、氧自由基的累积、炎症反应及细胞凋亡等[14]。研究[15]表明,脑组织缺血早期,缺血区以神经细胞坏死为主,而后期则以细胞凋亡为主。caspase家族是一类天冬氨酸特异性的半胱氨酸蛋白酶,是目前已知的凋亡最后执行因子。caspase目前至少发现14种,类型不同的细胞可能含有不同的caspase群体,不同的凋亡刺激信号激活的caspase也可能是不同的,但最终都需要通过激活caspase-3来完成凋亡,在所有已经被发现的caspase家族成员中,caspase-3是最为重要的凋亡执行者[16~18]。最近研究表明,缺血再灌注后细胞内大量自由基产生,导致细胞膜受损,同时线粒体及内质网等细胞器也损伤,进而能从不同的途径激活caspase-3,导致细胞凋亡。目前认为,caspases-3激活途径主要有三条,即线粒体/细胞色素C通路、死亡受体通路和内质网通路[19]。脑缺血再灌注后,可以通过其中的一个或多个通路转导凋亡信号,进而激活caspase-3,诱导细胞凋亡。本研究显示,番茄红素组干预14 d后caspase-3表达较低,此为进一步探讨番茄红素保护大鼠脑缺血再灌注损伤的机制提供一定的实验依据。
[1]Livny O,Kaplan I,Reifen R,et al.Lycopene inhibits proliferation and enhances gap-junction communication of KB-1 human oral tumor cells[J].J Nutr,2002,132(12):3754-3759.
[2]Siler U,Barella L,Spitzer V,et al.Lycopene and vitamin E interfere with autocrine/paracrine loops in the dunning prostate cancer model[J].FASEB J,2004,18(9):1019-1021.
[3]Blum A,Monir M,Wirsansky I,et al.The beneficial effects of tomatoes[J].Eur Intem Med,2005,16(6):402-444.
[4]Watzl B,Bub A,Briviba K,et al.Supp lementation of a low-carotenoiddiet with tomato or carrot juice modulates immune functions in healthymen[J].Ann Nutr Metab,2003,47(6):255-261.
[5]张卫国,谢国建,刘先军,等.番茄红素对胃癌细胞SGC-7901生长的抑制作用[J].中国药理学通报,2005,21(3):292-296.
[6]曹钰,姚尧.番茄红素对大鼠局灶性脑缺血损伤的影响[J].华西药学杂志,2006,21(1):45-46.
[7]Kim Y,Disilvestro R,Clinton S.Effects of lycopene-beadlet or tomato-powder feeding on carbon tetrachloride-induced hepatotoxicty in rats[J].Phytomedicine,2004,11(3):156-156.
[8]Unh Y,Karapolat S.Effects of implantation of bone marrow cells on cytokine levels in the ischemic heart tissue:An experimental study[J].Cardiothorac Surg,2008,3(1):30-38.
[9]黄澈,闵鹤鸣,闵连秋.原花青素对脑缺血再灌注后大鼠海马内质网应激相关分GRP78和CHOP表达的影响[J].中国新药杂志,2011,20(2):156-161.
[10]王立英,杨世杰.脑缺血—再灌注损伤机制及其药物治疗方法的研究进展[J].吉林大学学报(医学版),2012,38(6):1227-1231.
[11]Al-Malki AL,Moselhy SS,Refai MY.Synergistic effect of lycopene andtocopherol against oxidative stress and mammary tumor igenesis induced by 7,12-dimethyl[a]benzanthracene in female rats[J].Toxicol Ind Health,2012,28(6):542-548.
[12]Thies F,Masson LF,Rudd A,et al.Effect of a tomato-rich diet on markers of cardiovascular disease risk in moderately overweight,disease-free,middle-aged adults:a randomized controlled tria[J].Am J Clin Nutr,2012,95(5):1013-1022.
[13]Fujita K,Yoshimoto N,Kato T.Lycopene inhibits ischemia/reperfusion-induced neuronal apoptosis in gerbil hippocampal tissue[J].Neuroscience Research,2013,38(3):461-469.
[14]王红梅,贺永贵,伊红丽,等.脑缺血再灌注损伤发生机制及治疗进展[J].河北联合大学学报(医学版),2014,16(2):186-188.
[15]Siesjö BK.Pathophysiology and treatment of focal cerebral ischemia.PartⅠ:Pathophysiology.(1992)[J].J Neurosurg,2008,108(3):616-631.
[16]Zheng Li,Jihoon Jo,Jie-Min Jia,et al.Caspase-3 activation via mitochondria is required for long-term depression and AMPA receptor internalization[J].Cell,2010,141(5):859-871.
[17]Srikanth CV,Wall DM,Maldonado-Contreras A,et al.Salmonella pathogenesis and processing of secreted effectors by caspase-3[J].Science,2010,330(6002):390-393.
[18]Loughlin DT,Artlett CM.Precursor of advanced glycation end products mediates ER-stress-induced caspase-3 activation of human dermal fibroblasts through NAD(P)H oxidase 4[J].PLoS One,2010,5(6):e11093.
[19]Faubel S,Edelstein CL.Caspases as drug targets in ischemic organ injury[J].Curr Drug Targets Immune Endocr Metabol Disord,2005,5(3):269.
