GJB2、SLC26A4基因相关耳聋儿童的听力损失特点分析△
2014-06-12崔庆佳王国建张媛杨影康东洋杜延顺赵丽萍黄莎莎张伟孙喜斌戴朴黄丽辉
崔庆佳 王国建 张媛 杨影 康东洋 杜延顺 赵丽萍 黄莎莎 张伟 孙喜斌 戴朴 黄丽辉
据估计,遗传因素导致的听力损失在儿童听力损失患者中高达50%~60%以上[1]。在中国聋人中,GJB2、SLC26A4基因突变导致的耳聋比例非常高[2,3],全球有超过2亿7千8百万聋人,其中8千万是非综合征型聋患者。2006年我国人口抽样调查显示,听力残疾人达53 233例,其中儿童组多重残疾占71.37%,绝大多数为听力言语残疾[4]。因此,研究GJB2、SLC26A4基因突变在婴儿至学龄期儿童的发病特点对制定儿童期耳聋患者的临床基因诊断策略及指导康复干预具有重要的临床意义。为此,本研究选取在0~12岁发病,且携带有GJB2或SLC26A4基因纯合或复合杂合致病性突变而确诊为遗传性聋的儿童患者为研究对象,探讨其听力损失特点。
1 资料与方法
1.1研究对象 2011年5月至2011年9月,北京市18个区县19 883例听力残疾者接受了耳聋基因芯片检测,本研究选取其中0~12岁发病,且因携带纯合或复合杂合致病性突变而确诊为GJB2、SLC26A4基因相关耳聋的832例患儿为研究对象,其中,男399例,女433例;极重度听力损失504例(60.57%),重度151例(18.15%),中重度111例(13.34%),中度66例(7.93%)。553例(66.47%,553/832)为GJB2基因相关耳聋儿童,男278例,女275例,平均发病年龄1.80±2.58岁;279例(33.53%,279/832)为SLC26A4基因相关耳聋儿童,男121例,女158例,平均发病年龄2.25±2.54岁。所有研究对象均在医生指导下由监护人填写了《耳聋病人信息登记表》,包括一般信息、出生史、耳聋发病年龄、家族史、个人史(耳聋前感染病史、耳毒性药物应用史、外伤史等)等,并签署知情同意书。
1.2研究方法
1.2.1耳聋基因芯片检测方法 采用康为世纪全血核酸提取试剂盒从研究对象外周血中提取基因组DNA,用NANO-DROP、ND2000进行DNA定量和纯度检测。采用晶芯遗传性耳聋基因芯片检测试剂盒检测GJB2 (235delC、299_300delAT、176_191dell6、35delG)、SLC26A4(IVS7- 2A>G、2168A>G)、GJB3(538C>T)、线粒体12SrRNA(1555A>G、1494C>T)。按试剂盒说明进行目的基因的PCR 反应、芯片杂交、漂洗等步骤。应用晶芯LuxScanTM10K-B微阵列芯片扫描仪以90的激光扫描强度和532nm激发波长进行芯片扫描,用扫描仪自带软件进行结果判读。每批96例样本包含一组阴性、阳性对照组,以验证芯片检测结果的可靠性,并随机抽取5%进行DNA测序进一步验证芯片检测结果的准确性。
1.2.2发病年龄分组 结合儿童发育年龄分期及《中华人民共和国义务教育法》规定,本组对象按发病年龄分组如下:小于1岁为婴儿期(<1岁组);1岁至满3岁之前为幼儿期(1~岁组);3岁至6岁之前为学龄前期(3~岁组);6岁至12岁为学龄期(6~12岁组)。
1.2.3听力损失程度分级 本研究听力检测方法视患者配合程度选取听觉行为反应测听、游戏测听及纯音测听,以较好耳500、1 000、2 000、4 000 Hz平均纯音听阈判定其听力残疾等级。听力残疾一级为听觉系统的结构和功能方面极重度损伤,较好耳听力损失程度≥91 dB HL;听力残疾二级为重度损伤,听力损失程度81~90 dB HL;听力残疾三级为中重度损伤,听力损失程度61~80 dB HL;听力残疾四级为中度损伤,听力损失程度41~60 dB HL[5]。
1.3统计学方法 使用统计软件SPSS 18.0,对GJB2、SLC26A4基因耳聋人群间的发病年龄构成比及听力损失程度构成比进行χ2检验;并分别对两基因突变人群中不同发病年龄组的听力损失程度构成比进行χ2检验,显著性检验水准均定为a=0.05。
2 结果
2.1GJB2、SLC26A4基因纯合和复合杂合突变基因型及构成比 832例携带GJB2、SLC26A4基因纯合或复合杂合突变耳聋个体中,各基因突变的基因型及构成比见表1。
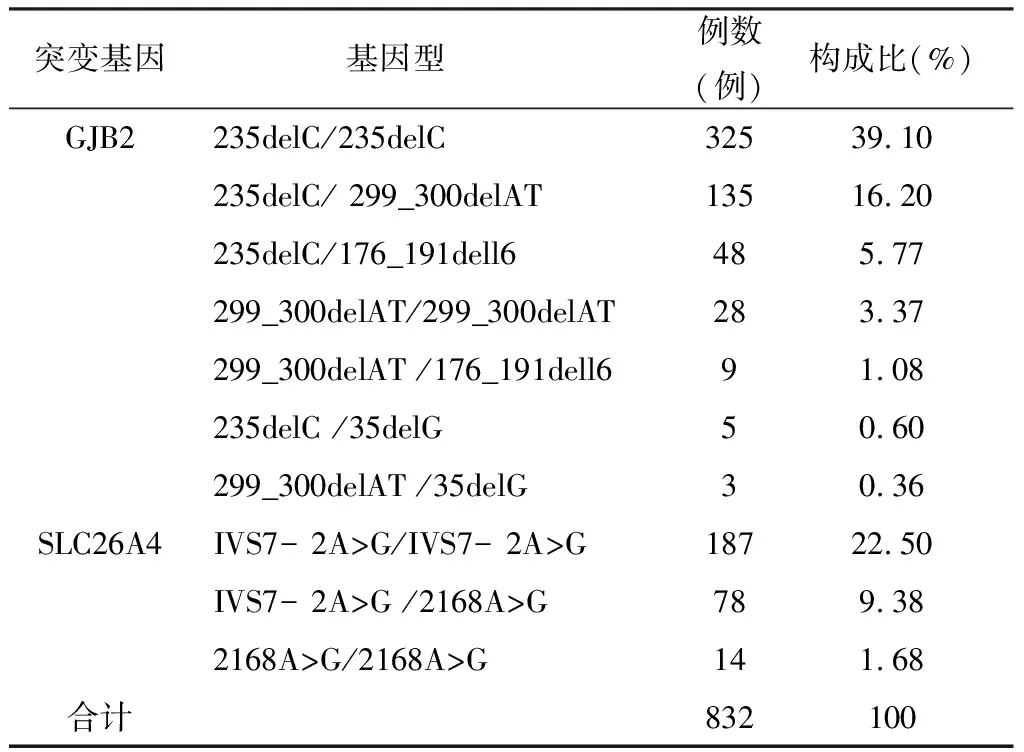
表1 832例GJB2、SLC26A基因突变耳聋患儿的基因型及构成比
2.2GJB2、SLC26A4基因突变患儿发病年龄构成比(表2) GJB2和SLC26A4基因突变患儿在发病年龄构成比上的差异有统计学意义(χ2=45.78,P=0.001);GJB2及 SLC26A4基因突变耳聋患儿的发病年龄主要集中在婴儿及幼儿期(0~3岁),两者在该年龄段所占比例分别为76.31%(422/553)和70.25%(196/279)。
2.3GJB2、SLC26A4基因突变耳聋患儿听力损失程度的比较 GJB2 、SLC26A4基因纯合突变或复合杂合突变引起的听力损失程度差异无统计学意义(χ2=4.40,P=0.221),均以极重度听力损失为主(表3)。
2.4GJB2基因突变耳聋患儿中不同发病年龄组的听力损失程度比较 GJB2基因突变者发病年龄主要分布在婴儿期和幼儿期,各发病年龄组均以极重度听力损失为主(表4)。各发病年龄组听力损失程度构成比的差异有统计学意义(χ2=24.179,P=0.004),随发病年龄增大,极重度听力损失比例逐渐减少。
2.5SLC26A4基因突变耳聋患儿中不同发病年龄组的听力损失程度比较 SLC26A4基因突变耳聋患儿发病年龄主要分布在幼儿期,各发病年龄组均以极重度听力损失为主(表5),各发病年龄组听力损失程度构成比差异无统计学意义(χ2=15.31,P=0.083),但可见6岁以内,随发病年龄增大,极重度听力损失者比例逐渐减少。
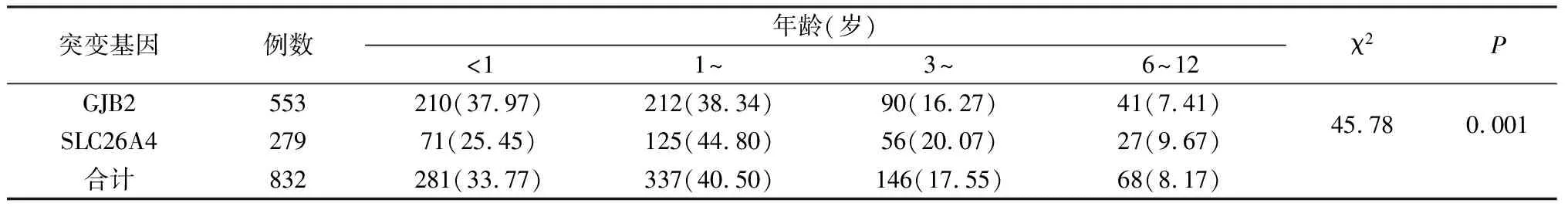
表2 GJB2、SLC26A4基因突变患儿发病年龄构成比(例,%)

表3 GJB2、SLC26A4基因突变患儿听力损失程度比较(例,%)
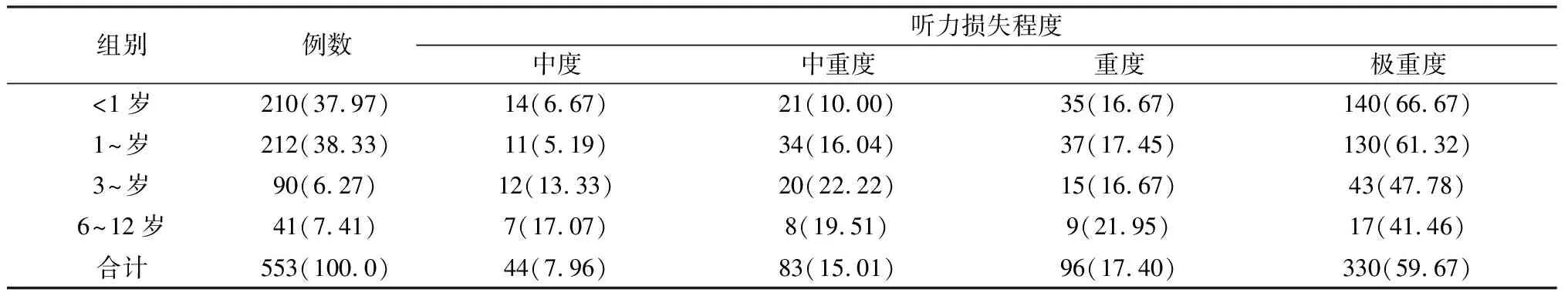
表4 不同发病年龄组GJB2突变者的听力损失程度比较(例,%)
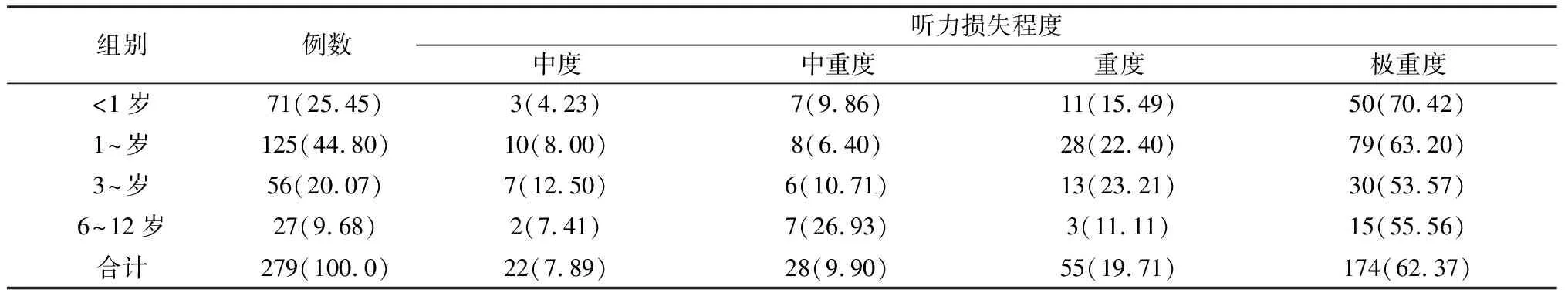
表5 不同发病年龄组SLC26A4突变者的听力损失程度比较(例,%)
3 讨论
从本组GJB2、SLC26A4基因突变相关耳聋儿童的6个热点突变筛查其听力损失特点分析,发现该群体中一些基因型对表型影响的规律如下。
3.1GJB2、SLC26A4基因相关耳聋患儿的发病年龄 文献报道[6~8],GJB2基因突变人群耳聋发病年龄从6~8个月至20岁不等。本研究结果中,GJB2基因突变的发病年龄主要集中在婴儿期(0~1岁,37.97%)和幼儿期(1~3岁,38.34%),提示GJB2基因突变患者常见发病年龄为0~3岁。
SLC26A4是大前庭水管综合征(enlarged vestibular aqueduct syndrome, EVAS)的致病基因,也是中国第二位致聋基因[9]。国内外研究[9~12]表明,SLC26A4基因突变相关耳聋的发病年龄多在婴儿期或幼年期,本研究结果与以上研究相吻合,尤其以1~3岁(44.80%)居多,0~1岁(25.45%)次之。
另外,值得注意的是,GJB2基因突变耳聋患儿以0~1岁发病居多,可以被早期发现;SLC26A4基因突变耳聋患儿的发病年龄则更主要集中在1~3岁,常表现为出生时有较好的残余听力或接近正常的听力,不易被父母察觉。究其原因可能是SLC26A4基因突变导致前庭水管或内淋巴囊扩大,1岁以后患儿开始行走活动,容易发生头部碰撞,碰撞后内淋巴液经扩大的前庭水管从内淋巴囊倒流入耳蜗或前庭,损伤毛细胞,从而导致波动性听力下降。
3.2GJB2、SLC26A4基因突变耳聋患儿的听力损失程度 GJB2基因突变引起的听力损失大多表现为重度或极重度聋[13,14],本研究对象中同样以极重度听力损失为主。另外,本文结果显示,发病年龄越小,极重度听力损失患儿所占比例越大,提示年龄很小时GJB2突变即导致非常严重的听力损失,因而易于发现,同时也提示GJB2耳聋随年龄增长加重的趋势不明显,因而表现为高龄儿童极重度听力损失患儿所占比例有所下降。
研究表明,SLC26A4基因突变导致的听力损失以重度至极重度为主[14]。从文中结果看SLC26A4基因突变耳聋患儿各年龄组也均以极重度听力损失为主;6岁以内,随发病年龄增大,极重度听力损失的比例有所下降。
综上所述,在0~12岁发病且确诊为GJB2、SLC26A4基因相关耳聋儿童中,发病年龄主要集中在婴儿期及幼儿期,并以极重度听力损失为主。GJB2基因突变者发病年龄越小,极重度听力损失比例越大。提示对12岁以下尤其是3岁以内发病的重度、极重度聋患儿,要重视遗传性聋的分子学诊断,以做到早发现、早治疗和早干预,实现聋而不哑,减轻社会和家庭负担,提高患儿生活质量。
值得注意的是,仍有相当数量的重度聋患儿仅发现GJB2或SLC26A4单等位基因突变或未发现突变而无法明确分子病因者,需要进一步行两个基因的全序列分析,以期发现双等位基因突变,提高确诊率;同时,结合基因检测结果和听力检查结果,获得更多耳聋突变位点的基因型与听力表型的相关性,为临床诊疗提供进一步的理论依据。
4 参考文献
1 王秋菊. 新生儿聋病基因筛查——悄然的革命[J]. 听力学及言语疾病杂志,2008,16:83.
2 于飞,韩东一,戴朴,等. 1190例非综合征性耳聋患者GJB2基因突变序列分析[J]. 中华医学杂志,2007,87:2 814.
3 戴朴,袁永一,康东洋,等.1 552例中重度感音神经性聋患者SLC26A4基因外显子7和81例测定及热点突变分析[J].中华医学杂志,2007,87:2 521.
4 孙喜斌,魏志云,于丽玫,等.中国听力残疾人群现状及致疾原因分析[J].中华流行病学杂志,2005,29:643.
5 孙喜斌,李兴启,张华. 中国第二次残疾人抽样调查听力残疾标准介绍[J]. 听力学及言语疾病杂志,2006,14:447.
6 Pampanos A, Economides J, Iliadou V, et al. Prevalence of GJB2 mutations in prelingual deafness in the Greek population[J]. Int J Pediatr Otorhinolaryngol,2002,65:101.
7 Iliadou V, Eleftheriades N, Metaxas AS, et al. Audiologicalprofile of the prevalent genetic form of childhood sensorineural hearing loss due to GJB2 mutations in northern Greece[J]. Eur Arch Otorhinolaryngol,2004,261:259.
8 Liu XZ, Pandya A, Angeli S, et al. Audiological features of GJB2 (connexin 26) deafness[J]. Ear Hear,2005,26:361.
9 Reyes S, Wang G, Ouyang X, et al. Mutation analysis of SLC26A4 in mainland Chinese patients with enlarged vestibular aqueduct[J]. Otolaryngol Head Neck Surg,2009,141:502.
10 Smith RJ, Hone S. Genetic screening for deafness[J]. Pediatr Clin North Am,2003,50:315.
11 Dai P, Yuan Y, Huang D, et al. Molecular etiology of hearing impairment in Inner Mongolia: mutations in SLC26A4 gene and relevant phenotype analysis[J]. J Transl Med,2008,6:74.
12 王国建,袁永一,李荣,等.不同听力学表型人群中常见耳聋基因突变检出率的分析[J]. 临床耳鼻咽喉头颈外科杂志,2011,25:445.
13 Lim LH, Bradshaw JK, Guo Y, et al. Genotypic and phenotypic correlations of DFNB1-related hearing impairment in the Midwestern United States[J]. Arch Otolaryngol Head Neck Surg,2003,129:836.
14 Yang T, Gurrola JN, Wu H, et al. Mutations of KCNJ10 together with mutations of SLC26A4 cause digenicnonsyndromic hearing loss associated with enlarged vestibular aqueduct syndrome[J]. Am J Hum Genet,2009,84:651.
