山核桃属2个树种叶片水浸提物的化感作用及其化感物质的含量比较
2014-06-09何开跃郭丽君
张 博,何开跃*,郭丽君,翟 敏
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.南京绿宙薄壳山核桃科技有限公司,江苏 南京 211500)
山核桃属2个树种叶片水浸提物的化感作用及其化感物质的含量比较
张 博1,何开跃1*,郭丽君1,翟 敏2
(1.南京林业大学森林资源与环境学院,江苏 南京 210037;2.南京绿宙薄壳山核桃科技有限公司,江苏 南京 211500)
以水浸提法提取薄壳山核桃和山核桃2种植物的叶片内含物,研究其对刺槐、萝卜和黑麦草种子萌发和幼苗生长的化感作用。结果表明:水浸提物明显抑制了3种受试植物种子的萌发及其幼苗的生长;生长7 d的幼苗体内,可溶性蛋白、SOD活性、POD活性降低,MDA含量升高。通过氯仿热回流及高效液相色谱法,提取、鉴定了2种植物叶片中的化感物质胡桃醌,并测定其含量。结果表明,薄壳山核桃叶片中所含有的胡桃醌含量高于山核桃。
山核桃属;水浸提物;化感作用;胡桃醌
化感作用(Allelopthy)这一概念是由德国学者Molisch于1937年提出的[1],包括克生抑制[2]、相互促进[3]、自毒等作用[4],是植物自然化学调控现象和适应环境的一种生态机制[5]。由植物通过地上部淋洗和挥发、根系分泌以及植物残体分解等途径释放并对其他生物产生生理效应的次生代谢物质称为化感物质(Allelochemical)。植物化感作用通过化感物质的释放实现。叶以及植物残体分解后产生的化感物质经雨水、露水冲洗后从植物体表淋溶至土壤中。本文通过水浸提的方式模拟雨雾淋溶途径,研究山核桃属薄壳山核桃[Carya illinoensis(Wangenh.)K.Koch]及山核桃(C.cathayensisSarg.)叶对刺槐(Robinia pseudoacaciaLinn.)、萝卜(Raphanus sativus Linn.)和黑麦草(Lolium multiflorumLam.)的化感作用,并在确定叶片存在化感作用后鉴定化感物质。本研究旨在为薄壳山核桃果园、山核桃果园以及2种山核桃与其他植物混交林的建设、优化,提供理论依据,为园林绿化植被的合理配置提供理论和实践依据。
1 材料与方法
1.1 试验材料
供试植物为5年生薄壳山核桃及6年生山核桃,叶片于2011年7月采自江苏省薄壳山核桃良种基地——南京市六合区绿宙薄壳山核桃果园。
受体植物:刺槐、萝卜和黑麦草。刺槐种子由南京林业大学种子中心提供,萝卜种子和黑麦草种子由南京市种子站提供。
1.2 试验方法
1.2.1 叶片水浸提液的制备 参照曾任森等[6]的方法,将薄壳山核桃和山核桃新鲜叶片各100 g,不粉碎,用500 mL自来水恒温28℃浸提24 h,过滤,得水浸提液备用。
1.2.2 叶片水浸提液的化感作用 种子萌发试验参照叶玉娟等[7]的方法,稍作修改。在直径为10 cm的培养皿中铺上4层脱脂纱布,3层直径为9 cm的滤纸,每皿放种子40粒,分别加入水浸提液10 mL,重复3次,盖上保鲜膜(保鲜膜上均匀扎孔),置于光照培养箱中培养,温度28℃,每天光照培养10 h(8:00~18:00),光照时温度为25~30℃,黑暗时温度为20℃,以去离子水作为对照。处理1 d后开始统计刺槐、萝卜、黑麦草种子的发芽数,每天统计1次,7 d后计算种子的发芽率、发芽指数,同时测量幼苗株高、根长、鲜质量,测定幼苗的各项生理指标,并计算化感综合效应指数。
(1)最终发芽率(%)=(发芽种子总数/供试种子总数)×100%。
(2)发芽指数=∑(Gt/Dt)×100%,其中Gt为逐日发芽种子数,Dt为相应的发芽天数。
(3)化感作用效应指数RI=(T/C-1)× 100%,其中C为对照值,T为处理值。RI>0为促进作用,RI<0为抑制作用,RI的绝对值代表作用强度的大小[8]。
(3)可溶性蛋白含量测定采用考马斯亮蓝G-250显色法[9-10]。
(4)超氧化物歧化酶(SOD)活性测定采用氮蓝四唑(NBT)法[9-10]。
(5)过氧化物酶(POD)活性测定采用愈创木酚法[9-10]。
(6)丙二醛(MDA)含量测定采用硫代巴比妥酸法[9-10]。
1.2.3 化感物质的鉴定
(1)样品处理。将新鲜薄壳山核桃和山核桃嫩叶片烘干,机械粉碎后过40目筛。准确称取10 g叶片干粉,分别置于烧瓶中,加入氯仿100 mL,于水浴锅上热回流浸提,浸提温度60℃,浸提时间3 h。将提取液过滤、离心,取上清液,50℃减压蒸馏,蒸干提取液。向蒸干物中加入甲醇12 mL,超声提取10 min,4 000 r/min离心10 min,取上清液,同法再用甲醇12 mL提取2次,上清液合并于50 mL容量瓶中,用甲醇定容,用0.45 μm微孔滤膜过滤,得到提取液,用于测定分析其成分。
(2)HPLC(高效液相色谱)测定。色谱仪型号Agilent 1200;色谱条件:分离柱采用Aglient XDBC18柱,检测波长λ=250 nm,柱温30℃,进样量10 μL,流动相:甲醇-0.5%磷酸(55∶45),流速1 mL/min;进样器:安捷伦自动进样器
(3)标准曲线制作。精密取胡桃醌标准品20 mg,置于10 mL容量瓶中,甲醇溶解,用去离子水定容,作为每个单体标样的母样。梯度倍释,得5,10,20,40,80 μg/mL一系列标样。20 μL进样,在上述色谱条件下,测定每个标样出峰时间、峰面积,求得回归方程。
1.2.4 数据统计分析 所有数据应用Excel2003处理,用SPSS16.0软件进行方差分析及LSR多重比较。
2 结果与分析
2.1 水浸提物对受试植物种子萌发和幼苗生长的影响
2.1.1 对种子萌发的影响 对种子萌发的影响结果见表1。薄壳山核桃叶和山核桃叶水浸提物对刺槐、萝卜、黑麦草3种受试植物种子萌发都有不同程度的抑制作用。与对照相比,薄壳山核桃和山核桃叶水浸提物使刺槐种子发芽率分别降低了5.93%,4.24%,发芽指数分别降低了13.85%,7.59%。薄壳山核桃对刺槐种子发芽率及发芽指数的抑制达到极显著水平;山核桃对刺槐种子发芽率及发芽指数的抑制达到显著水平;2种处理使萝卜种子发芽率分别降低了26.89%,12.60%,发芽指数分别降低了42.81%,25.02%。薄壳山核桃水浸提液对萝卜种子发芽率及发芽指数的抑制均达到显著水平,其中对发芽率的抑制达极显著水平,山核桃水浸提物对萝卜种子发芽率抑制达到显著水平;2种树种叶水浸提物使黑麦草种子发芽率分别降低了6.78%,4.24%,发芽指数分别降低了27.18%,23.88%。薄壳山核桃和山核桃叶水浸提液对黑麦草种子发芽指数的抑制均达到极显著水平,对发芽率的抑制作用均达到显著水平。
Williamson等[11]提出RI>0为促进作用,RI<0为抑制作用,RI的绝对值越大表示化感作用越强。由此可见,山核桃属2种植物叶的水浸提物对3种受试植物发芽率和发芽指数均有抑制作用,对发芽率影响小于发芽指数,2种植物叶水浸提物对受试植物种子萌发的抑制作用为薄壳山核桃>山核桃。

表1 薄壳山核桃及山核桃叶水浸提物对3种受试植物种子萌发的影响
2.1.2 对幼苗生长的影响 由表2可知,薄壳山核桃叶和山核桃叶水浸提物对刺槐、萝卜、黑麦草3种受试植物苗高、根长、鲜质量都有不同程度的抑制作用。2种植物叶水浸提物对刺槐苗高及根长的抑制作用均达极显著水平,对鲜质量的抑制作用达显著水平;对萝卜苗高、根长、鲜质量的抑制作用均达极显著水平;对黑麦草苗高、根长、鲜质量的抑制作用均达极显著水平。2种叶水浸提物对受试植物根长的抑制作用最明显,对苗高和鲜质量的影响次之。叶片水浸提物对3种受试植物幼苗生长的抑制作用均表现为薄壳山核桃>山核桃。
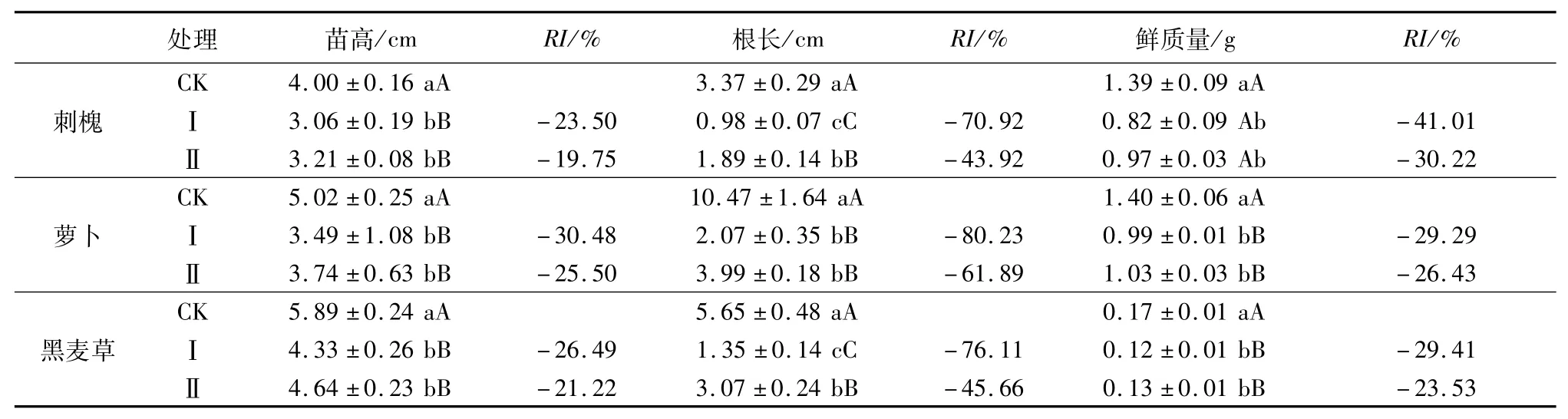
表2 薄壳山核桃及山核桃叶的水浸提物对3种受试植物幼苗生长的影响
2.1.3 水浸提物对受试植物的化感作用综合效应
薄壳山核桃叶和山核桃叶水浸提物对3种受试植物化感综合效应(见图1)。从图1中可以看出,2种植物叶的水浸提物对刺槐、萝卜、黑麦草的化感效应均表现为抑制作用,但化感作用潜力大小各不相同。数据表明,对3种受试植物的化感综合效应大小均表现为薄壳山核桃>山核桃。数据还表明,薄壳山核桃叶和山核桃叶水浸提物对萝卜的化感作用最强,其次是黑麦草,最后是刺槐。薄壳山核桃叶片水浸提液对萝卜的化感抑制作用最强,化感综合效应指数为-41.94%;山核桃叶片水浸提液对刺槐的化感抑制作用最弱,化感综合效应指数为-21.14%。
2.2 水浸提物对3种受试植物幼苗生理指标的影响
与对照相比,薄壳山核桃和山核桃叶水浸提物均使受试植物体内可溶性蛋白含量发生不同程度降低(见图2)。薄壳山核桃叶片水浸提液处理使刺槐、萝卜和黑麦草幼苗体内可溶性蛋白含量分别下降22.80%,64.23%,36.40%;山核桃叶片水浸提液处理,可溶性蛋白含量分别下降8.74%,20.63%,11.26%。对刺槐的抑制作用不显著,其他均达到显著或极显著水平。

图1 山核桃属2种植物叶水浸提物对3种受试植物的化感综合效应
SOD是植物体内重要的保护酶,能清除体内过多积累的自由基,以缓解逆境的伤害[12-13]。与对照相比,2种植物叶的水浸提物均不同程度降低了受试植物体内SOD活性。方差分析可知,薄壳山核桃叶水浸提物对萝卜及黑麦草的SOD活性的抑制作用达到极显著水平,对刺槐的抑制作用不显著,山核桃叶水浸提物对萝卜及黑麦草的SOD活性的抑制作用达到显著水平,对刺槐的抑制作用不显著。
薄壳山核桃叶片水浸提液处理使刺槐、萝卜和黑麦草幼苗POD活性分别下降29.65%,45.17%,52.52%;山核桃叶片水浸提液处理使POD活性分别下降14.42%,17.90%,25.60%。方差分析可知,薄壳山核桃叶水浸提物和山核桃叶水浸提物对刺槐、萝卜及黑麦草的POD活性抑制作用达到显著水平。
2种叶水浸提液使3种受试植物MDA含量有不同程度的升高。薄壳山核桃叶片水浸提液处理使刺槐、萝卜和黑麦草幼苗MDA含量分别升高58.61%,67.46%,52.52%;山核桃叶片水浸提液处理使刺槐、萝卜和黑麦草幼苗MDA含量分别升高33.08%,39.44%,17.88%。方差分析可知,薄壳山核桃叶和山核桃叶水浸提物使刺槐、萝卜及黑麦草的MDA含量的升高作用达到显著水平,其中薄壳山核桃叶水浸提物使刺槐、萝卜的MDA含量的升高作用达到极显著水平。
山核桃属2种植物叶片水浸提物对3种受试植物幼苗生理指标的影响作用均表现为薄壳山核桃>山核桃。

图2 薄壳山核桃叶及山核桃叶水浸提物对3种受试植物幼苗生理指标的影响
2.3 山核桃属2种植物叶中化感物质的含量
在试验选定的色谱条件下,胡桃醌标准品色谱如图3所示。

图3 胡桃醌标样色谱

图4 胡桃醌的回归方程
由图4可以看出,标样质量浓度与峰面积的相关性良好,相关系数达到1.000 00。将薄壳山核桃和山核桃叶提取物在确定的色谱条件下进样,2种植物的色谱图如图5,6。

图5 薄壳山核桃叶提取物检测色谱

图6 山核桃叶提取物检测色谱
可以看出,2种植物叶片中均含有胡桃醌成分,但含量不同。图7中数据为薄壳山核桃和山核桃叶中胡桃醌的含量,由表中数据可知,薄壳山核桃叶片中所含有的胡桃醌含量高于山核桃,山核桃叶片中的胡桃醌含量约为薄壳山核桃叶中胡桃醌含量的24.6%。

图7 薄壳山核桃和山核桃叶中胡桃醌的含量
3 结论与讨论
本研究表明,薄壳山核桃及山核桃叶片水浸提液显著抑制了受试植物根长、苗高。这与Fukuhara等[7]关于茄科植物Solanum arundo Mattei的根皮中分离鉴定出的糖苷生物碱对莴苣幼苗的生长抑制作用相一致。由数据可以看出,2种植物水浸提物对植物根系生长的影响明显大于对苗高的影响,这与李雪枫等[12]关于冷蒿对3种禾本科植物种子萌发和幼苗生长的化感作用研究相一致,原因可能是水浸提液中的化感物质首先直接与植物幼苗的根系相接触,因而对根部的影响较大。Ye等[13]在关于茄科植物S.lyratum的化感作用研究中发现,从S.lyratum中分离的化感物质对Medicago hispida Gaertn和Agrostemma githagol的胚根生长均具有抑制作用。化感物质对植物幼苗地上部分和地下部分作用差异的根本原因有待进一步研究。
由化感综合效应指数可知,2种植物叶片水浸提液对3种受试植物均表现出抑制作用。但化感潜力强弱也存在着差异。薄壳山核桃叶的水浸提液对萝卜幼苗的生长抑制最强,对黑麦草的抑制次之,对刺槐的抑制则最弱。山核桃叶片的水浸提物对3种幼苗的抑制也表现出与薄壳山核桃相同的规律。选择性是化感作用的一个显著特点。许多研究均表明了化感作用具有选择性[14-15]。对于同一种受试植物而言,薄壳山核桃叶水浸提物的化感作用均高于山核桃。可能与叶片所含有化感物质多少有关。
研究中对受试植物幼苗生理指标测定结果表明:薄壳山核桃和山核桃植物叶片水浸提液使受试植物幼苗体内可溶性蛋白含量降低,SOD、POD活性下降,MDA含量上升。郭鸿儒等[16]在关于黄花蒿化感物质对受体燕麦化感作用机理的初步研究中发现:黄花蒿水提取物可抑制燕麦(Avena fata)体内超氧化物歧化酶(SOD)、过氧化物酶(POD)的活性,与本试验结果相一致。刘建新等[17]在关于黄瓜地上部水浸液对番茄的化感抑制效应的研究中也得出了相似的结果。Li等[18]发现芦苇能分泌一种化感抑藻物质,该化感物质使得藻细胞内的金属离子外渗,降低了SOD和POD的活性。Yu等[19]用黄瓜根分泌物和浸提物处理其幼苗后,POD,SOD和膜过氧化反应明显增加。薄壳山核桃和山核桃植物叶片水浸提液中存在的化感物质,降低了受试植物体内的SOD、POD等抗氧化酶的活性,导致受试植物幼苗代谢所产生的活性氧不能被及时有效地清除,进而导致膜脂发生过氧化,使MDA含量增加,质膜透性增大,膜结构和功能受到破坏。可溶性蛋白含量降低,表明受试植物幼苗体内蛋白质合成受阻,膜结构和功能的破坏阻碍了受试植物幼苗体内蛋白质合成代谢。由此表明,薄壳山核桃与山核桃叶中的化感物质通过诱发受试植物幼苗内的活性氧积累导致膜结构与功能受损而产生化感作用。
醌类是化感物质最常见的种类,其中的胡桃醌为胡桃科核桃属植物胡桃楸和核桃中存在的重要活性物质,在山核桃属植物中也存在。胡桃醌是现已证明唯一由高等植物产生的萘醌类克生物质,能够抑制其他植物的生长。Böhm等[20]发现低浓度胡桃醌能增强大豆根细胞过氧化物酶活性,但高浓度时抑制其活性。在大豆或玉米的培养液中,施以适当浓度的胡桃醌,大豆或玉米根细胞线粒体中电子传递受到抑制。胡桃醌也抑制H+-ATP酶的活性,使得质子泵受到影响,最终抑制呼吸作用[21]。
本文通过氯仿热回流提取法及HPLC法,从薄壳山核桃、山核桃叶片中提取并鉴定了胡桃醌成分,确定了一种由薄壳山核桃及山核桃释放的对其他植物有着抑制作用的化感物质。薄壳山核桃叶片中所含有的胡桃醌含量高于山核桃,因此可以推断,胡桃醌的含量与薄壳山核桃和山核桃化感作用潜力大小有着一定的相关性。但Einhellig[22]认为,几乎所有植物的化感潜力都是由2种或2种以上的化合物的互作所引起的。因此薄壳山核桃及山核桃是否可能含有其他化感物质,有待进一步研究。
[1] Molisch H.Der Einfluss einer pflanze auf die andere-Allelopathie[M].Jena:Gustav Fischer Verlag,1937:13-20.
[2] Rice E L.Allelopathy[M].Academic Press Inc,1984:320-343.
[3] Inderjit,Duke S O.Ecophysiological aspects of allelopathy[J]. Planta,2003,217(4):529-539.
[4] 周 凯,郭维明,王智芳,等.菊花不同部位及根际土壤水浸液处理对光合作用的自毒作用研究[J].中国生态农业学报,2009,17(2):318-322.
[5] 江贵波,曾任森.艾的挥发性物质化感作用研究[J].生态科学,2006,25(2):106-108.
[6] 曾任森,李蓬为.窿缘桉和尾叶桉的化感作用研究[J].华南农业大学学报,1997,18(1):6-10.
[7] 叶玉娟,何开跃.深山含笑对3种植物的化感作用研究[J].林业科技开发,2009,23(6):35-39.
[8] 彭 婧,薛书浩.大蒜根系分泌物的化感作用研究[J].吉林农业,2010(10):54.
[9] 西北农业大学植物生理生化教研组.植物生理学实验指导[M].西安:陕西科学技术出版社,1987:69-93.
[10]李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:119-263.
[11]Williamson G B,Richardson D.Bioassays for allelopathy:measuring treatment responses with independent controls[J].Journal of Chemical Ecology,1988,14(1):181-187.
[12]李雪枫,王 坚,许文博,等.冷蒿对三种禾本科植物种子萌发和幼苗生长的化感作用[J].应用生态学报,2010,21(7):1702-1708.
[13]Ye W C,Wang H,Zhao S X.Steroidal glycoside and glycoalkaloid from Solanum lyratum[J].Biochemical Systematics and Ecology, 2001(29):421-423.
[14]孔垂华,胡 飞.植物化感(相生相克)作用及其应用[M].北京:中国农业出版社,2001.
[15]邓明华,文锦芬,邹学校,等.辣椒植株水浸提液对生菜和大白菜化感作用的初步研究[J].云南农业大学学报,2007,22(3):452-455.
[16]郭鸿儒,沈慧敏,杨顺义,等.化感物质对受体燕麦化感作用机理的初步研究[J].甘肃农业大学学报,2008,43(1):102-104.
[17]刘建新,胡浩斌,王 鑫.黄瓜地上部水浸液对番茄的化感抑制效应[J].中国生态农业学报,2009,17(2):312-317.
[18]Li F M,Hu H Y.Isolation and characterization of a novel antialgal allelochemical from Phragmites communis[J].Applied and Environmental Microbiology,2005(71):6545-6553.
[19]Yu J Q,Ye S F,Zhang M F.Effects of root exudates and aqueous root extracts of cucumber(Cucumis sativus)and allelochemicals,on photosynthesis and antioxidant enzymes in cucumber.[J].Biochemical Systematics and Ecology,2003(31):129-139.
[20]Böhm P A F,Zanardo M L.Peroxidase activity and lignification in soybean root growth-inhibition by juglone[J].Biologia Plantarum,2006,50(2):315-317.
[21]Angela M H,Karen L K.Juglone disrupts root plasma membrane H+-ATPase activity and impairs water uptake,root respiration,and growth in soybean(Glycine max)and corn(Zea mays)[J]. Journal of Chemical Ecology,2004,30(2):453-471.
[22]Einhellig F A.Interaction involving allelopathy in cropping systems[J].Agronomy Journal,1996(88):886-893.
Study on allelopathy of the leaves of two Carya species
ZHANG Bo1,HE Kai-yue1*,GUO Li-jun1,ZHAI Min2
(1.College of Forest Resources and Environment,Nanjing Forestry University,Nanjing 210037,China;2.Nanjing Green Universe Pecan Science&Technology Co.,Ltd.Nanjing 211500,China)
The allelopathic effects of the water extract of Carya illinoensis(Wangench.)K.Koch andCarya cathayensisSarg.leaves on the seed germination and seedling growth ofRobinia pseudoacacia,Raphanus sativus,Lolium multiflorumwere studied in this paper.The results indicated that their water extract had significant inhibitiory effect.The protein content,the activities of SOD and POD in the seven days'seedlings were decreased,but malondiadehyde(MDA)in them was increased.Juglone was extracted from their leaves and its content was determined with chloroform thermal reflux and high performance liquid chromatography(HPLC).Our result showed that the content of juglone inCarya illinoensis(Wangench.)K.Koch was higher than that inCarya cathayensisSarg.
Carya Nutt;Water extract;Allelopathic effect;Juglone
S664
A
10.3969/j.issn.1001-7380.2014.01.001
1001-7380(2014)01-0001-06
2013-12-10
张 博(1987-),男,硕士,主要从事树木生理生化研究。
*通信作者:何开跃(1959-),女,四川重庆人,教授,博士,主要从事树木生理生化研究。E-mail:1940557508@QQ.com。
