经皮穿刺脾静脉栓塞建立继发性脾功能亢进的动物模型和射频消融治疗研究
2014-06-09王素赵卫胡继红易根发王滔
王素,赵卫,胡继红,易根发,王滔
·实验研究Experimental research·
经皮穿刺脾静脉栓塞建立继发性脾功能亢进的动物模型和射频消融治疗研究
王素,赵卫,胡继红,易根发,王滔
目的介绍一种快速建立的继发性脾功能亢进(脾亢)的猪动物模型,并在此模型基础上进行射频消融治疗(RFA)研究。方法在B型超声或CT导向下经皮穿刺猪脾静脉主干并栓塞引起淤血性脾肿大,再进行RFA治疗,观察动物外周血细胞变化,了解脾脏影像学变化以及组织病理学改变。结果脾静脉栓塞后1周外周血红细胞、血小板即下降,第3周以后二者下降明显(P<0.05),红细胞和血小板减少,脾肿大可持续6周以上。术后第2周起,脾脏组织学改变符合脾淤血改变。射频热能引起脾脏局部凝固坏死,脾内血管闭塞、广泛微血栓导致血栓性梗死形成。结论经皮脾静脉栓塞建立继发性脾亢方法简单、确切,可以作为脾亢外科或介入治疗的较理想模型,RFA治疗是一种有效的干预措施。
继发性脾功能亢进;脾静脉栓塞;射频消融;动物模型;猪
肝硬化门静脉高压是临床上常见的一种病症,常合并脾肿大、脾功能亢进(脾亢)、腹水、食管胃底静脉曲张及破裂出血;脾亢导致血小板、红细胞、白细胞的下降,并使病情进一步恶化,且妨碍抗病毒的治疗。随着对脾脏功能的进一步研究,脾脏的功能得到充分认识及肯定;探索如何保留部分脾脏,有效控制脾亢,成为临床面临的重要课题。我们成功建立了一种快速、继发性脾亢的动物模型,并对其进行脾亢射频消融(RFA)治疗,取得满意结果,现报道如下。
1 材料与方法
1.1 材料
1.1.1 实验对象健康猪18头(昆明医科大学动物科提供),体重35~40 kg,雌雄不拘。
1.1.2 主要实验试剂及设备盐酸氯胺酮注射液2 m l∶0.1 g(由江苏恒瑞医药股份有限公司生产)、地西泮注射液2m l∶10 g、玻璃水柱、自制脾静脉栓塞弹簧圈:将临床废弃的Cordis金属导丝剪去头尾,抽出内芯后,将螺旋钢丝紧密缠绕在不同直径(6~10 mm)的钢柱上乙醇灯加热,去火后,塞入释放器中,消毒备用。
B型超声(EUB-5500 JAPAN)、平板DSA血管造影机(PHILLIPS FD-20荷兰)、RFA-1型多极RFA系统及RFA-1315型多极RFA电极(北京博莱德光电技术有限公司),SOMATOM Emotion 16层面CT(德国)。
1.2 方法
1.2.1 动物分组18只动物随机分为3组:Ⅰ组(正常组,未行栓塞,n=4),Ⅱ组(对照组,脾静脉栓塞组,n=8),Ⅲ组(实验组,脾亢模型行脾RFA,n=6)。
1.2.2 动物模型建立Ⅱ组、Ⅲ组实验动物空腹过夜,用盐酸氯胺酮(20 mg/kg)、地西泮(0.8 mg/kg)、阿托品(0.5~1 mg/只)肌内注射全麻后,Ⅱ组、Ⅲ组实验动物腹部备皮,常规消毒,建立静脉通道,侧卧并固定于平板DSA手术台,B型超声定位、导向下用千叶针或深静脉留置针经皮经肝穿刺门静脉右支(左侧卧)一次成功后,透视下分别将两条5 F单弯导管置于脾静脉主干近门脉处(栓塞导管)及脾静脉脾门区端(测压导管),先行上述两点测压(玻璃水管法测门静脉的压力),通过栓塞导管用合适型号的自制弹簧圈进行脾静脉主干栓塞(弹簧圈大小根据个体差异在6~10mm直径内选择),通过测压导管造影证实脾静脉是否已被致密栓塞(栓塞前造影可见脾静脉、门静脉显影完全,栓塞后造影见脾静脉血流完全停滞认为已达到致密栓塞),并进行栓塞后压力测定;将两导管撤出,穿刺点包扎后送回动物科饲养,温度(24±2)℃,常规喂养。
1.2.3 RFA治疗脾亢模型成功建立后(脾静脉栓塞后第3周末),Ⅲ组空腹过夜,全麻(方法同前),腹部、腿部备皮在腿部粘贴电极护片。常规消毒铺巾,在B型超声引导下将RFA-1315型多极RFA电极插入脾脏,接上RFA-1型多极RFA系统(功率为0~300 W,温度上限设为90℃),单次消融时间为20 min。RFA每烧灼1次后收针,后退2 cm,再将多极RFA针打开进行烧灼,直至脾包膜下,更换穿刺部位再插入脾脏内对另一处(方法同前)进行RFA。退出电极前电凝针道防止出血。穿刺点包扎后送回动物科饲养,温度(24±2)℃,常规喂养。
1.2.4 病理组织检查取Ⅰ组动物1只全麻(方法同前),手术切除脾脏并用4%甲醛固定制片作为标准对照,向静脉注入50ml空气处死动物。Ⅱ组动物术后第1到第6周末(以术后第1天算起)同法取脾脏病理标本,每周末标本取样1只;Ⅲ组术后第1到3周末同法取脾脏病理标本,每周末标本取样1只。
1.2.5 外周血细胞检查3组动物在栓塞术前1周经耳缘静脉抽静脉血2ml行血常规检查,作为正常参考数据。Ⅱ组除做病理检查动物外,在栓塞术后每周末经耳缘静脉抽静脉血2 ml行血常规检查,连续6周,结果作为对照组数据。Ⅲ组在栓塞术后第3周末经耳缘静脉抽静脉血2 ml行血常规检查,结果作为RFA术前数据。在脾脏RFA术后,除去做病理检查的动物外,每周末经耳缘静脉抽静脉血2m l行血常规检查,连续6周,作为实验组数据。
1.2.6 影像学检查除去用作病理组织检查的动物,分别对Ⅱ组和Ⅲ组动物每周末CT扫描了解脾脏增大情况,结合血常规结果,确定脾亢模型是否成功建立,并对RFA术后的脾脏变化进行分析。
1.3 统计学处理
统计分析应用SPSS11.5软件包。计量数据以均数±标准差(±s)表示,两组间均数比较采用t检验,多组间均数采用方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 术后动物观察
动物于脾静脉栓塞和脾脏RFA后第1天即恢复正常饮水、进食,无烦躁、呕吐、厌食等症状,体重无明显变化,穿刺点无感染、出血,实验动物全部存活。
2.2 门静脉、脾静脉压力变化
栓塞前脾静脉压力(16.86±2.64)cmH2O,栓塞后脾静脉压力(30.49±4.71)cmH2O,栓塞前后差异有统计学意义(P<0.05);栓塞前门静脉压力(15.76±2.38)cmH2O,栓塞后门静脉压力(9.24± 1.81)cmH2O,栓塞前后差异有统计学意义(P<0.05),见表1。
2.3 外周血细胞计数的变化
Ⅱ组、Ⅲ组第1、2、3、4、5、6周末RBC、PLT、WBC改变分别见表2、3,Ⅱ组RBC及PLT下降与Ⅰ组比较差异有统计学意义(P<0.05)。Ⅲ组RBC及PLT上升与Ⅱ组比较差异有统计学意义(P<0.05),WBC无明显改变。
表1 脾静脉栓塞前后脾静脉、门静脉压力变化(±s)

表1 脾静脉栓塞前后脾静脉、门静脉压力变化(±s)
时间脾静脉压力/(cmH2O)门静脉压力/(cmH2O)栓塞前16.86±2.64 15.76±2.38栓塞后30.49±4.71 9.24±1.81 t值-7.132 6.175 P值<0.01<0.01
2.4 脾脏影像学表现
表2 脾静脉栓塞后各周未动物外周血常规变化(±s)

表2 脾静脉栓塞后各周未动物外周血常规变化(±s)
注:P值为与正常参考值比较
参数正常参考值1周2周3周4周5周6周RBC(×1012/L)7.91±0.76 7.03±0.69 6.59±0.45 6.30±0.51 6.40±0.27 6.49±0.36 6.58±0.27 P值-<0.05<0.05<0.05<0.05<0.05<0.05 PLT(×109/L)465±46 394±59 347±38 307±39 333±16 337±33 357±14 P值-<0.05<0.05<0.05<0.05<0.05<0.05 WBC(×109/L)23.04±4.33 24.76±5.73 23.86±3.68 24.40±2.08 23.79±1.75 23.71±1.10 23.49±1.17 P值-------
表3 脾脏RFA动物各周外周血常规变化(±s)

表3 脾脏RFA动物各周外周血常规变化(±s)
参数RFA术前1周2周3周4周5周6周RBC(×1012/L)6.21±0.51 6.98±0.4 7.21±0.49 7.55±0.47 7.18±0.4 7.21±0.49 7.55±0.47 P值-<0.05<0.05<0.05<0.05<0.05<0.05 PLT(×109/L)307±39 363±37 424±47 443±10 433±37 424±47 443±10 P值-<0.05<0.05<0.05<0.05<0.05<0.05 WBC(×109/L)23.04±4.33 24.76±5.73 23.86±3.68 24.40±2.08 23.79±1.75 23.71±1.10 23.49±1.17 P值-------
CT扫描提示脾静脉栓塞后2周脾脏体积均明显增大,可持续6周以上。Ⅲ组脾脏毁损病灶可见高密度的凝固性坏死区,其内有片状低密度气体影,消融灶周围条带状稍低密度影。
2.5 组织病理学表现(图1、2)

图1 RFA术前后血细胞变化曲线图及栓塞前后脾静脉、门静脉压力变化图
与正常脾脏结构相比,脾静脉栓塞后2周末Ⅱ组脾脏明显充血肿大,脾窦扩张,可见大量RBC破坏后形成的含铁血黄素巨噬细胞;4~6周除脾窦扩张外,脾脏内纤维组织增生,脾窦内可见微血栓形成,脾小梁增粗,脾被膜增厚,脾静脉内有血栓形成。
Ⅲ组大网膜与脾脏RFA病灶表面粘连较严重,脾毁损病灶剖面外观与CT影像学一致,包括砖黄色的干燥坏死区和血栓性梗死区。镜下观察,除射频针穿刺点有脾内出血外,未见明显的脾内出血。射频热能引起脾脏局部凝固坏死,脾内血管闭塞、广泛微血栓导致血栓性梗死形成。
3 讨论
脾亢是由某些病因引起的脾脏病理性功能增强,循环血液中的有形成分不同程度减少的一组症候群;分为原发性脾亢和继发性脾亢,而继发性脾亢最常见于肝硬化门脉高压症;其发病机制至今仍不清楚,主要有4种学说:脾内阻留学说、体液抑制学说、自身免疫学说、稀释学说[1-2]。其中被广为接受的是脾内阻留学说,其机制为长时间的被动淤血导动物脾脏和各期脾脏组织学改变致窦壁纤维组织和窦内皮细胞增生,脾窦壁总面积和长度均增加,血细胞在脾内过度阻留而被脾内功能高度活跃的单核-巨噬细胞所吞噬,导致外周血中血细胞明显减少。此外,慢性肝病引起的血小板生成素减少、肝炎病毒对骨髓造血前体细胞抑制、慢性失血以及血液稀释等因素都不同程度地参与脾亢的发生[3]。
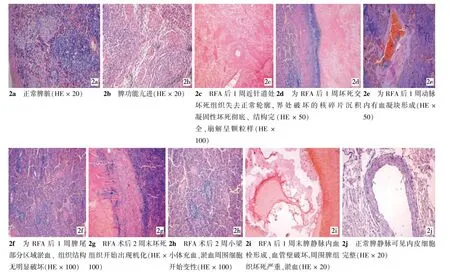
图2 正常
随着近年来深入研究,人们对脾脏功能有了新的认识,脾脏具有强大的抗感染、抗肿瘤功能,在机体免疫反应中发挥重要作用;尽可能的保留部分脾功能,已成为共识[4-5]。采用微创方法减少脾脏体积,控制脾亢,改善血象,成为目前研究热点[6]。
为对脾亢进行深入研究,建立脾亢的动物模型有重要意义,但临床上脾亢是一个漫长而且复杂的过程,要建立与人类相似的脾亢动物模型极其困难,尤其对于可进行微创研究的大型动物;目前实验动物有鼠、兔、犬及猪,方法采用药物或手术操作[7]。
脾静脉主干栓塞后,近脾门脾静脉压力增高,从而形成一个继发性门静脉高压。我们研究发现脾静脉主干栓塞后1周末,外周血RBC、PLT即下降,与对照组相比差异有统计学意义;3周后RBC、PLT明显减少,脾肿大可持续6周以上;说明本研究脾亢模型建立成功,可以作为脾亢外科或介入治疗的理想模型。与2003年刘全达等[4]介绍的在外科结扎脾静脉主干基础上快速建立的继发性脾亢犬动物模型及2007年程水兵等[5]通过外科手术缩窄脾静脉主干制备的家兔继发性脾亢模型结果基本一致,但方法更简单,结果更确切。本研究中WBC的改变不明显,其原因有待进一步研究,这与先前研究相似[4]。用脾静脉介入栓塞制作脾亢模型,具有微创、成功率高的优点,是脾亢模型制作的一种有效新方法。但脾切除术及部分性脾动脉栓塞(partial splenic embolization,PSE)是治疗脾亢常用方法,仍存在很多问题尚待解决。高能聚焦超声(high intensity focused ultrasound ablation,HIFU)、微波及经皮脾内注射无水乙醇等微创方法在脾功能亢进的研究亦才起步,仍有许多问题需要进一步的研究[8]。
RFA已经广泛应用于治疗实质脏器肿瘤,并取得良好的临床效果。RFA是利用RFA仪,在影像系统导向下直接穿刺到脾脏,射频电极发出中高频射频波,激发组织细胞进行等离子振荡产生较高热量,这不仅可使脾脏组织发生凝固性坏死,直接破坏靶区组织和血管,导致周围更弥散的多叶段性脾血栓性梗死形成。射频热还可导致脾内微血栓形成以及血管闭塞,血栓性梗死区逐渐被吸收,而残余外观“正常”脾组织结构变致密,血管闭塞、大量胶原纤维沉积,这是脾脏RFA缩小的重要病理基础。
理论上,RFA适用于门静脉高压性脾亢的治疗:①脾脏是实质脏器,热毁损可使局部组织凝固坏死;②射频热能保持一定时间高温,使局部血管和脾窦内皮细胞变性坏死、血栓形成、血管和脾窦闭塞;③脾脏穿刺安全,而且射频的热能有止血功效;④RFA使脾脏坏死后局部发生炎性反应和新生毛细血管形成,建立广泛的门-腔静脉间侧支循环,毁损后脾脏血液回流减少,降低门静脉压力。
我们在脾亢动物模型上进行RFA治疗,并进行了6周血样跟踪检测和3周RFA样品切片制备及分析,确认RFA术对于脾亢的治疗有明显的作用,可明显改善脾亢所致的PLT、RBC减少,使其回升至栓塞术前水平,病理可见脾脏局部凝固坏死,脾内血管闭塞、广泛微血栓形成。本实验动物对脾脏RFA耐受性好,无死亡以及胃肠穿孔、腹腔内出血、脾脏破裂等严重并发症发生,说明B型超声导向下经皮穿刺猪的脾脏实施射频局部定量消融是安全、可行的,为进一步的临床研究提供了必要的资料。但是操作中必须注意:①穿刺点避开脾门和脾脏大血管;②穿刺后保持电极针固定,可减少出血;③为防止膈肌无菌性炎性反应引起肺部并发症和脾脏牵涉痛,选择脾脏中下极作为RFA穿刺的首选部位。
综上所述,脾静脉栓塞术制作脾亢模型,微创、成功率高,是脾亢模型制作的一种有效新方法,RFA治疗门静脉高压性脾大脾亢安全可行,近期疗效显著,是一种安全、可行的微创方法。然而由于本研究样本量小,随访时间短,还需进一步加大样本量,延长随访时间进行观察。
[1]Mousa A,Armbruster J,Adongay J,et al.Splenic artery embolization as a treatment option for chronic pancytopenia secondary to hypersplenism:a case report and review of literature[J].Vasc Endovascular Surg,2012,46:501-503.
[2]Shi B,Zhu H,Liu YJ,et al.Experimental studies and clinical experiences on treatment of secondary hypersplenism with extracorporeal high-intensity focused ultrasound[J].Ultrasound Med Biol,2012,38:1911-1917.
[3]刘全达,马宽生,何振平,等.射频消融治疗继发性脾肿大、脾功能亢进可行性和安全性的实验研究[J].中华外科杂志,2003,40:62-65.
[4]刘全达,马宽生,何振平,等.快速建立继发性脾功能亢进的犬动物模型[J].第三军医大学学报,2003,25:301-304.
[5]程水兵,张启瑜,杨文军.脾静脉主干缩窄法制备家兔继发性脾功能亢进模型[J].肝胆胰外科杂志,2007,19:79-81.
[6]Kawanaka H,Akahoshi T,Kinjo N,etal.Impactof antithrombinⅢconcentrates on portal vein thrombosis after splenectomy in patients with liver cirrhosis and hypersplenism[J].Ann Surg,2010,251:76-83.
[7]Alzen G,Basedow J,Luedemann M,et al.Partial splenic embolization as an alternative to splenectomy in hypersplenism—single center experience in 16 years[J].Klin Padiatr,2010,222:368-373.
[8]李赵鹏,赵卫.脾脏射频消融治疗门脉高压性脾功能亢进的研究进展[J].介入放射学杂志,2009,18:953-956.
The establishment of anim almodels w ith secondary hypersp lenism by using percutaneous embolism of sp lenic vein technique and the study on radiofrequency ablation
WANG Su,ZHAOWei,HU Ji-hong, YIGen-fa,WANG Tao.Intervention Section,Department of Medical Imaging,the First Affiliated Hospital of Kunming Medical University,Kunming,Yunnan Province 650032,China
HUJi-hong,E-mail:867404586@qq.com
ObjectiveTo introduce a method for fast establishment of pig models with secondary hypersplenism,and using this model to study the effect of radiofrequency ablation(RFA).MethodsCongestive splenomegaly was created by CT-guided percutaneous embolization of splenic vein and its collateral branches in pigs.Then radiofrequency ablation was employed in themodels to observe the changes of peripheral blood as well as the spleen changes in itsmorphology and histopathology.The blood cell count for peripheral venous blood was determined once a week,and the spleen size wasmeasured by CT scanning. Results One week after splenic vein embolization,the counts of peripheral erythrocytes and platelets showed a reduction,which became more obvious in three weeks(P<0.05).Erythropenia,thrombocytopenia and sp lenomegaly could last for over six weeks.At the second week after the procedure,pathologically the spleen assumed passive congestion appearance.The thermal energy produced by radiofrequency ablation could cause local splenic coagulation necrosis,splenic vessels occlusion and splenic thrombotic infarction due to diffuse micro-vascular thrombosis.ConclusionTo establish an animal model with secondary hypersplenism,the method of CT-guided percutaneous embolism of sp lenic vein is simple and reliable.The animalmodels can be used for surgical or interventional researches.Radiofrequency ablation is an effective intervention means.(J Intervent Radiol,2014,23:792-796)
secondary hypersplenism;splenic vein embolization;radiofrequency ablation;animal model;pig
R551.1
B
1008-794X(2014)-09-0792-05
2014-02-09)
(本文编辑:侯虹鲁)
10.3969/j.issn.1008-794X.2014.09.013
650031昆明昆明医科大学第一附属医院医学影像科介入室
胡继红E-mail:867404586@qq.com
