肝门部胆管癌介入术后支架再狭窄36例的原因分析及处理
2014-06-09夏兴阳邵海波徐克
夏兴阳,邵海波,徐克
·非血管介入Non-vascular intervention·
肝门部胆管癌介入术后支架再狭窄36例的原因分析及处理
夏兴阳,邵海波,徐克
目的探讨由肝门部胆管癌(HACC)引起的恶性梗阻性黄疸(MOJ)行介入支架术后再梗阻的原因及处理方法。方法选择我院2010年6月—2013年9月收治36例因BismuthⅡ~Ⅳ型肝门部胆管癌所致的胆道高位梗阻表现MOJ而行胆道支架植入术(PTCS),术后出现再梗阻而行胆道外引流术(PTCD)的有完整资料的病例。记录2次手术当天及术后第5天的血清总胆红素、直接胆红素、γ-谷氨酰转肽酶、碱性磷酸酶数值行统计学分析,了解PTCS及PTCD对缓解MOJ的短期疗效,并通过2次入院时的CT和(或)MRI、术中胆道造影图像的比较及引流物实验室检查结果,分析再梗阻原因。结果本组再梗阻时间为31~468 d,平均132.8 d,PTCS、PTCD解除梗阻有效率分别为77.8%、75.0%,再梗阻原因有胆泥、胆沙形成、急性胆管炎、肿瘤生长等。结论HACC引起的MOJ行PTCS起到解除梗阻作用,但术后再梗阻发生率较高,肿瘤生长是其主要原因,再次行PTCD可以改善肝功能、控制胆系感染、迅速解除硬阻、缓解病情。
肝门部胆管癌;恶性梗阻性黄疸;再梗阻;介入方法
恶性梗阻性黄疸(malignant obstructive jaundice,MOJ)多由恶性肿瘤直接或间接压迫肝内外胆道系统所致。临床上造成MOJ的肿瘤包括,引起低位胆道梗阻的胰头癌、胆总管末端癌及壶腹癌等,部分起源于壶腹附近的十二指肠癌及淋巴瘤等,还有主要引起高位梗阻的肝门部胆管癌。
肝门部胆管癌(hilar cholangiocarcinoma,HACC)是主要侵犯肝总管及其分叉部以上左、右肝管的胆管癌,又称KIatskin瘤,是胆道系统常见的恶性肿瘤之一。HACC可分为4型:Ⅰ型,肿瘤位于肝总管,未侵犯汇合部;Ⅱ型,肿瘤侵犯肝总管及左右肝管汇合部;Ⅱ型,肿瘤侵犯肝总管,左右肝管汇合部并已侵犯右肝管(Ⅱa)或左肝管(Ⅱb);Ⅳ型,肿瘤侵犯肝总管,左右肝管汇合部并同时侵犯左右肝管。HACC解剖位置特殊、恶性程度高、起病隐匿,早期诊断困难,确诊时往往已到中晚期,患者多因胆道高位梗阻引起重度黄疽,胆系感染,导致肝、肾功能严重损伤甚至死亡。
本文回顾性分析我院2010年6月—2013年9月36例患者,分析再梗阻原因和胆道支架植入(PTCS)、胆道外引流术(PTCD)对缓解MOJ的短期疗效,现报道如下。
1 材料与方法
1.1 临床资料
本组36例患者中男22例,女14例。年龄36~85岁,平均65岁。均满足:①经CT和(或)MRI检查及血清肿瘤标志物CA19-9、CEA阳性,诊断为BismuthⅡ~Ⅳ型肝门部胆管癌;②出现肝功能异常(以胆红素升高为主)、组织和体液黄染、皮肤瘙痒、胆系扩张等黄疸表现;③因年龄较大、伴其他严重合并症而不能耐受外科手术,或因已有多发脏器转移不适合外科手术,而行PTCS;④再次出现梗阻性黄疸表现而行PTCD;⑤2次手术间期未行系统化疗或放疗等其他治疗方式;⑥有完整的前后2次临床及随访资料。参考影像检查,结合Bismuth分型标准,其中BismuthⅡ型16例,BismuthⅡa型9例,BismuthⅡb型6例,BismuthⅣ型5例。PTCS术前当天血清总胆红素(TBIL)120.2~664.5μmol/L,平均275.9μmol/L;直接胆红素(DBIL)82.5~608.1μmol/ L,平均241.1μmol/L;γ-谷氨酰转肽酶(γ-GT)48~1 735 u/L,平均650.9 u/L;碱性磷酸酶(ALP)144~1 411 u/L,平均637.5 u/L。再梗阻患者PTCD术前当天血清TBIL 103~394.3μmol/L,平均216μmol/ L;DBIL 89.5~362μmol/L,平均189.2μmol/L;γ-GT 132~1 867 u/L,平均676.8 u/L;ALP 144~1 947 u/L,平均604.6 u/L。2次术前分别有7、13例患者伴不同程度胆系感染,体温超过38益,白细胞和(或)中性粒细胞比例明显高于正常值。
1.2 方法
1.2.1 操作方法患者仰卧于DSA床上,常规消毒铺无菌孔巾,选择右腋中线第7~9肋间或剑突下为穿刺点,以1%利多卡因10 ml行局部麻醉,嘱患者闭气,应用微穿刺针穿刺肝内胆道,造影证实穿刺针位于胆管内,引入微导丝,置入外鞘管,行造影,明确梗阻位置、范围及肝内外胆管扩张程度,引入超滑导丝开通梗阻段胆管后进入十二指肠,退出外鞘管,沿导丝送入合适的球囊扩张,再置入支架,复查造影,见对比剂顺利通过支架进入肠管(PTCS)。随后,再次造影显示肝内外胆管明显扩张,支架近端、内部见充盈缺损影或阻塞,引入超滑导丝退出外鞘管,同时送入外引流管,远端成袢,近端连接引流袋,抽取引流物送检,包扎,术毕(PTCD)。金属支架均为国产镍钛合金支架,直径为8~10 mm,长度据病变而定;PTCD引流管均为COOK公司生产的外引流,规格为8.5 F。
1.2.2 术后处理及观察术后常规行止血、保肝治疗,酌情应用抗菌药物,根据血液生化检查结果予以静脉补液,维持水、电解质平衡。术后卧床休息24 h,禁食水6 h,监测血压、脉搏、呼吸,密切观察腹部体征以及引流液量、性状,必要时造影复查。以血清TBIL下降>50%为明显好转;下降25%~50%为改善;达不到上述标准者视为疗效不显著或无效。
1.3 统计学分析
采用SPSS13.0统计软件,对患者2次介入治疗前及术后5 d的血清TBIL、DBIL、γ-GT、ALP进行配对t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 介入治疗短期疗效
36例患者2次介入术后,组织和体液黄染、皮肤瘙痒等症状于短期内逐渐消失,支架植入术后TBIL指标符合明显好转23例,改善5例,8例疗效不显著或无效,有效率为77.8%。术后5 d血清TBIL 26.9~287μmol/L,平均130.9μmol/L;DBIL 19~206.1μmol/L,平均108.6μmol/L;γ-GT 44~932 u/L,平均396 u/L;ALP 125~966 u/L,平均424 u/L,均较术前下降。PTCD术后TBIL指标符合明显好转15例,改善12例,9例治疗效果不显著或无效,有效率为75.0%,术后5 d血清TBIL 26.7~267.8μmol/L,平均129.5μmol/L;DBIL 18~247.5μmol/L,平均113μmol/L;γ-GT 73~1 127 u/ L,平均388 u/L;ALP 79~1 500 u/L,平均414 u/L,均较术前指标下降(表1~2)。
2.2 随访
36例患者均获随访,时间2~23个月,随访期内15例死亡,21例仍生存。36例患者2次手术成功率均为100%,术中均取得胆道造影图像(图1),共放置支架36枚、外引流管52支。

表1 支架植入前后实验室指标比较

表2 外引流术前后实验室指标比较
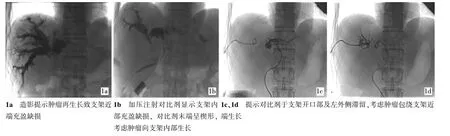
图1 肝门部胆管癌术后再狭窄图像
2.3 再梗阻原因
本组患者发生再梗阻时间为31~468 d,平均132.8 d。再梗阻发生于1.5个月内、1.5~3个月、3~6个月、半年后分别有4、10、14、8例。综合2次入院时的CT和(或)MRI比较肿瘤累及范围、术中胆道造影所示支架堵塞或内部充盈缺损影的影像学比较及引流物的化验结果,再梗阻发生于1.5个月内的4例中,2例引流物为含有大量细小颗粒状的黏稠物,考虑为胆泥胆沙,经引流管反复抽吸及冲洗,支架内对比剂流过量增大;2例引流物培养结果报告为大肠埃希菌生长,同时患者高热,白细胞及中性粒细胞比例增高,考虑为急性胆管炎所致的良性梗阻。再梗阻发生于3个月内的10例中,6例对比2次CT和(或)MRI的肿瘤累及范围、胆道造影图像,考虑系肿瘤生长致支架严重变窄或堵塞,2例为胆泥、胆沙所致,2例为急性胆管炎所致,引流物培养结果1例大肠埃希菌生长、1例铜绿假单胞菌生长;再梗阻发生于6个月内的14例中,11例为肿瘤生长所致,3例为急性胆管炎所致,引流物培养结果2例大肠埃希菌生长、1例铜绿假单胞菌生长;梗阻发生于半年后的8例,均为肿瘤生长所致。即原因为肿瘤向支架两端及支架内部生长25例、胆泥胆沙形成4例、急性胆管炎7例。
2.4 不良反应和并发症
PTCS、PTCD 2次介入术后发生胆系感染分别为9例、11例,应用抗生素和及时经引流管胆道冲洗后感染缓解;发生急性胰腺炎分别为2例、1例,予以禁食、抗炎、补液、维持电解质平衡及生长抑素治疗后病情缓解;发生肝动脉出血各1例,行肝动脉造影提示对比剂外溢,并行栓塞治疗,同时给予止血药物,术后血压下降、上腹疼痛等症状消失。全部病例术中术后均未发生胆心反射、肝肾功能衰竭等较严重并发症。
3 讨论
因肝门部胆管癌导致的高位胆道梗阻,外科手术切除是彻底根治的传统方法。但因起病隐匿,一旦出现梗阻性黄疸表现而就医者只有少数患者可行手术治疗,其根治性切除率仅为10%~27%[1],而且术后病死率较高。复发及并发症的发生导致3、5年生存率仅为18%~52%、5%~31%[2-4]。本组患者介入治疗后随访时间为2~23个月,21例患者仍存活。介入治疗可获得与外科手术治疗相近的较为满意的疗效[5-6]。
如今PTCS、PTCD早已成为介入姑息性治疗MOJ的首选方法。PTCS起到“内引流”效果,尽可能保留了胆汁的原有代谢渠道及生理功能,而且无需体外留置引流装置。PTCD虽然带来了术后引流管护理的困难、胆汁外流致水电解质失衡的可能性,但其操作快捷、费用较低、解除梗阻效果迅速明显,对重度黄疸的患者可先行PTCD,待肝功能有所恢复及患者状态稳定后再行PTCS。有学者认为肝门区梗阻病变PTCD及PTCS的手术操作相对较难,术后并发症出现概率较高[7-8]。本组36例患者,手术成功率为100%,术后出现胆系感染、急性胰腺炎、肝动脉出血等并发症,对症处理后症状减轻或消失。对不能手术切除的肝门部胆管癌,如果不进行有效治疗,患者平均生存时间仅3个月[9]。有文献报道,2枚及以上支架植入治疗肝门部高位梗阻,再梗阻率要高于单支架植入[10]。本组对比2次术前术后血清TBIL、DBIL、γ-GT、ALP有不同程度下降,短期效果较好。再梗阻后再次介入处理行PTCD,不仅快捷地缓解黄疸症状,而且对胆汁淤积后的肝功能也有所帮助,患者一般状态得到改善。
PTCS术后支架再梗阻是MOJ介入治疗常见的并发症之一。Iriving等[11]曾发现狭窄的支架表面覆盖着上皮样的组织,但Hausegger等[12]在针对该类患者并未发现胆管内膜的增生引起支架狭窄,甚至很多植入的支架处根本没有发现黏膜增生。所以对于支架植入后是否必然引起黏膜增生尚无定论。该类患者分泌及合成胆汁酸能力下降,使胆汁中总胆汁酸浓度减少,不能有效地溶解游离胆红素及胆固醇形成的微胶粒,使之过饱和而析出形成胆泥胆沙;同时胆汁酸成分的改变,可促进胆泥胆沙的形成。患者同时伴有肠上皮屏障功能障碍,导致来自门静脉血流中的和肠道经括约肌直接反流的细菌易位。而光滑的金属表面又易于细菌黏附,这样肉芽组织就在细菌的作用下加速增生,形成急性胆管炎细菌团堵塞支架。本组再梗阻病例中有7例为急性胆管炎、4例为胆泥胆沙所致,因此建议常规补充水电解质等营养物质、应用保肝减黄药物改善肝功能平衡胆汁代谢、必要时抗炎治疗,有助于减少急性胆管炎、胆泥胆沙致支架再梗阻的概率。
本组有25例因为肿瘤向支架近端、内部生长,甚至包绕生长压迫支架而至再狭窄,总占患者数的69.4%(25/36)。为延缓肿瘤的生长,系统化疗或定期体外放疗已被广泛应用,近年来出现的磁化胆道支架[13],125I放射性胆道内照射支架[14]等新兴支架,将扩张狭窄胆道及延缓肿瘤生长功能合为一体,适时使用该类支架,联合介入方法一次性置入,将有效减少因肿瘤生长所致支架再狭窄的概率。
[1]Reed DN Jr,Vitale GC,Martin R,et al.Bile duct carcinoma:trends in the nineties[J].Am Surg,2000,66:711-715.
[2]KhanSA,Thomas HC,Davidson BR,Taylor-Robinson SD. Cholangiocarcinoma[J].Lancet 2005,366:1303-1314.
[3]Petrowsky H,Hong JC.Current surgicalmanagementof hilar and intrahepatic cholangiocarcinoma:the role of resection and orthotopic liver transplantation[J].Transplant Proc 2009,41:4023-4035.
[4]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2009[J]. CA Cancer JClin 2009,59:225-249.
[5]卢再鸣,刘兆玉,郭启勇,等.晚期肝门部胆管癌手术治疗和介入治疗疗效观察[J].陕西医学杂志,2010,7:824-826.
[6]于平,戴定可,钱晓军,等.胆管引流或支架置入术后感染的临床分析与处理[J].介入放射学杂志,2007,16:693-695.
[7]Born P,Rosch T,Bruhl K,etal.Long-term outcome in patients whit advanced hilar bile duct tumors undergoing palliative endoscopic or percutaneous drainage[J].ZGastroenterol,2000,38:483-489.
[8]Inal M,Akgul E,AKsungur E,et al.Percutaneous selfexpandad le uncovered metallic stents in malignant biliary obstruction.Complications,follow-up and reintervention in 154 patients[J].Acta Radiol,2003,44:139-146.
[9]Rerknimitr R,Kladcharoen N,Mahachai V,et al.Result of endoscopic biliary drainage in hilar cholangoicarcinoma[J].J Clin Gastroenterol,2004,38:518-523.
[10]Kucukay F,Okten RS,Yurdakul M,et al.Triple metallic stenting in malignant biliary obstructions[J].Diagn Interv Radiol,2011,17:277-282.
[11]Hausegger KA,Mischinger HJ,Karaic R,et al.Percutaneous cholangioscopy in obstructed biliary metal stents[J].Cardiovasc Intrvent Radiol.1997,20:191-196.
[12]Hausegger KA,Kleinert R,Lammer J,et al.Maligant biliary obstruction:histologic findings after treatment with selfexpandable stents[J].Radilolgy.1992,185:461-464.
[13]郑建伟,唐滔,肖宝来,等.磁化胆道支架联合磁性纳米药物靶向治疗胆管癌.中华实验外科杂志,2007,24:936-938.
[14]郭金和,朱光宇,朱海东,等.胆管内照射支架的研制及临床应用的初步结果[J].中华医学杂志,2011,91:2310-2313.
Biliary restenosis after interventional treatment for hilar cholangiocarcinom a:analysis of causes of 36 cases and its management
XIA Xing-yang,SHAO Hai-bo,XU Ke.Department of Radiology,the Affiliated First Hospital of China Medical University,Shenyang,Liaoning Province 110001,China
XU Ke,E-mail:cmuxuke@163.com
ObjectiveTo explore the reasons of biliary restenosis after interventional treatment for malignant obstructive jaundice caused by hepatic hilar cholangiocarcinoma and to discuss its management. M ethods During the period from June 2010 to Sep.2013 at authors’hospital,a total of 36 patients with high biliary obstruction caused by BismuthⅡ-Ⅳtype of hepatic hilar cholangiocarcinoma
percutaneous transhepatic cholangial stenting(PTCS),and as the patients developed biliary restenosis after PTCS percutaneous transhepatic cholangial drainage(PTCD)had to be carried out.All the patients had complete data.Serum total bilirubin,direct bilirubin,glutamyltranspetidase and alkaline phosphatase levels were determined on the operation day and at five days after PTCS and PTCD.The short-term remission of malignant obstructive jaundice produced by PTCS and PTCD were assessed.The causes of biliary restenosis were analyzed by comparing the CT and/or MRI images as well as the cholangiography and drainage test resultswhich were performed at the first and second admission to hospital.ResultsThe interval time from operation to restenosis was 31-468 days,with an average of 132.8 days.The effective rates of PTCS and PTCD for relieving jaundice were 77.8%and 75.0%respectively.Themain causes of restenosis included the formation of biliary sludge,acute cholangitis and tumor growth.ConclusionPTCS is an effective means to relieve the malignant obstructive jaundice caused by hepatic hilar cholangiocarcinoma,however,the incidence of biliary restenosis after PTCS is higher,which may be mainly due to the tumor growth. Nevertheless,subsequent PTCD can effectively improve the liver function,control biliary infection,remit biliary obstruction and relieve the clinical symptoms.(J Intervent Radiol,2014,23:597-600)
hepatic hilar cholangiocarcinoma;malignant obstructive jaundice;re-obstruction;interventional method
R735.7
A
1008-794X(2014)-07-0597-04
2013-11-15)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2014.07.011
110001沈阳中国医科大学附属第一医院放射科
徐克E-mail:cmuxuke@163.com
