鸡传染性支气管炎强毒分离株遗传进化分析和免疫保护试验
2014-06-08胡北侠黄庆华杨少华许传田王莉莉黄艳艳张秀美
胡北侠,黄庆华,杨少华,许传田 ,张 伟,张 琳,王莉莉,黄艳艳,张秀美
(1.山东省农业科学院畜牧兽医研究所 山东省畜禽疫病防治与繁育重点实验室,济南250100;2.山东省微山畜牧局,微山277600)
鸡传染性支气管炎(infectious bronchitious,IB)是由鸡传染性支气管炎病毒(Infectious bronchitious virus,IBV)引起的一种急性、高度接触性传染性疾病。IBV基因组为单股正链RNA,长约27.6 kb,编码4种结构蛋白:即纤突蛋白(spike protein,S)、基质蛋白(membrane protein,M)、核衣壳蛋白(nucleocapsid protein,N)和膜蛋白(envelope,E)[1,2]。S蛋白位于IBV粒子的表面,由S1和S2两个亚单位组成,S1蛋白是血清中和抗体的主要诱导者,并与病毒的组织嗜性和免疫保护密切相关[2,3]。
疫苗免疫是鸡传染性支气管炎的主要防控措施之一,但由于IBV很容易通过基因突变、插入、缺失和重组发生变异,给此病的免疫预防不断带来新的挑战。近年来,IBV对山东养鸡业(特别是商品肉鸡)的危害日益严重。虽然H120、MA5和491等多种IB弱毒活疫苗用于该病的免疫预防,临床上仍然经常发生IBV的感染,造成巨大经济损失。本实验室2012年从山东省发病鸡群分离鉴定了1个IBV强毒株SDIB821/2012,为了明确该流行株的分子特征,对其S1基因进行了测序和遗传进化分析。此外,选择3个常用IB弱毒活疫苗进行了免疫保护试验,为明确鸡群不断发生IB免疫失败的原因和有效防控本病提供科学的理论依据。
1 材料和方法
1.1 病毒、SPF鸡胚和SPF鸡 IBV分离株SDIB821/2012从山东省某商品肉鸡群分离,该鸡群于7日龄用IB活疫苗H120滴鼻、点眼免疫,10日龄左右鸡群开始发病,主要病理变化为气管出血、肾脏肿大和心脏等内脏器官表面大量尿酸盐沉积,累计死淘率60%左右。动物回归试验结果显示,SDIB821/2012(以105.0EID50滴鼻)对14日龄SPF鸡致死率60%,病死鸡病理变化与临床发病鸡群基本一致。
9~11日龄SPF鸡胚、3日龄SPF鸡购自山东省农业科学院家禽研究所SPF鸡研究中心。SPF鸡于隔离器内饲养,饲料和饮水均经无菌处理。
1.2 鸡传染性支气管炎疫苗 鸡传染性支气管炎弱毒活疫苗491和MA5均为Nobillis公司生产;H120 为国内某生物制品厂生产。
1.3 引物、菌种、质粒和试剂 S1基因引物序列参考文献[4],由上海生物工程有限公司合成;pEASY-T1载体购自北京全式金公司;PrimeScriptTMOne Step RT-PCR Kit、Trizol和Gel Extraction Kit均购自大连宝生物工程有限公司;DH5α菌种为本实验室保存;IBV抗体ELISA检测试剂盒为IDEXX公司生产;其他试剂均为国产或进口分析纯。
1.4 IBV分离株S1基因的扩增、克隆与测序 按TRIzol试剂(Invitrogen)说明书提取病毒基因组RNA。应用RT-PCR 方法,扩增病毒S1基因。将回收后的PCR 产物与pMD18-T 载体进行连接反应后,转化大肠杆菌DH5α感受态细胞。经菌液PCR 鉴定后,委托北京六和华大基因科技股份有限公司测序。
1.5 IBV分离株S1基因核苷酸序列的比较分析 利用lasergene7.0和MEGA 4.1生物软件,将SDIB821/2012的S1基因分别与本实验室分离的IBV流行株和GenBank中国内外IBV参考株进行同源性比较和系统进化分析。
1.6 IB弱毒活疫苗对SDIB821/2012的免疫保护试验
1.6.1 试验鸡分组与免疫 3日龄SPF鸡60只,随机分成4组(A、B、C、D),每组15只。A、B和C组为免疫组,于3日龄通过滴鼻、点眼途径免疫IB弱毒活疫苗(1羽份/只),D组为对照组,以相同剂量无菌0.01 mol/L PBS缓冲液(pH7.2)滴鼻、点眼。
1.6.2 试验鸡攻毒 免疫后14 d,免疫组和对照组试验鸡分别用IBV分离株SDIB821/2012攻毒,攻毒剂量为105EID50/只,攻毒方式为滴鼻。攻毒前各组试验鸡分别随机取3只扑杀,采集气管组织和泄殖腔棉拭进行疫苗株排毒检测,同时采集血清分别检测ELISA抗体和针对SDIB821/2012的中和抗体。
1.6.3 试验鸡临床症状及发病死亡情况 攻毒后共观察14 d,每天观察试验鸡食欲、精神、是否有呼吸道等临床症状,病死鸡剖检观察主要病理变化。记录各组试验鸡发病死亡情况。
1.6.4 试验鸡攻毒后排毒检测 分别于攻毒后3、5、7 d对各组试验鸡采集喉头和泄殖腔棉拭,接种SPF鸡胚,进行病毒分离,每组每次采3只。对病死鸡取气管、肺脏和肾脏组织进行病毒分离,每组累计取3只(若无试验鸡死亡,于d7扑杀3只取样)。
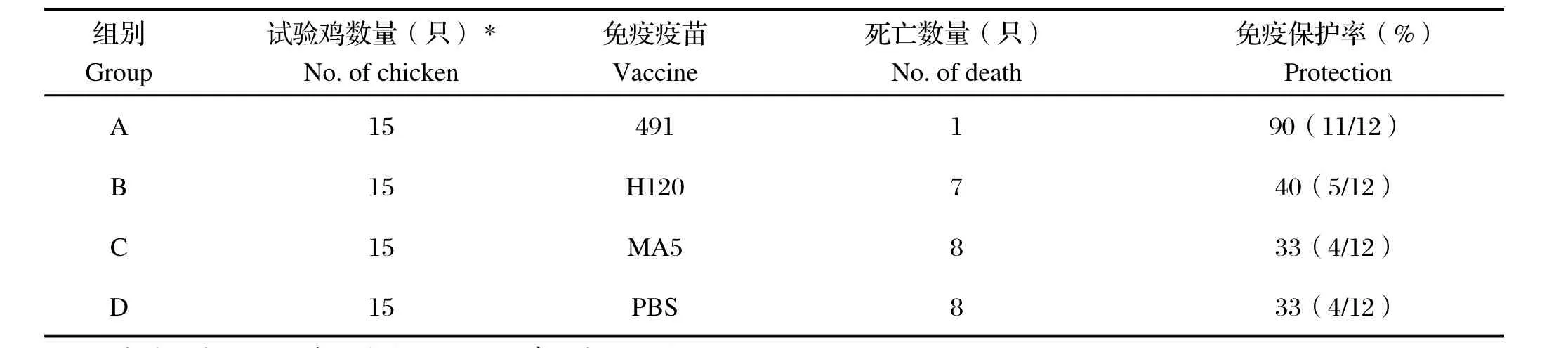
表1 试验鸡分组和攻毒后发病死亡情况Table 1 Experiment design and results of vaccination-challenge test
2 结果
2.1 分离株SDIB821/2012S1基因遗传进化分析和同源性比较 SDIB821/2012毒株S1基因长度为1620 bp,编码540个氨基酸(含裂解位点)。遗传进化分析发现,包括SDIB821/2012在内的 13个山东IBV流行株(黑色三角形标注)与国内外参考株和疫苗株形成4个进化分支(图1),SDIB821/2012与12个山东分离株均属于以参考株QXIBV为代表的基因Ⅰ型(QX-like)。基因Ⅱ型包括491疫苗株和3个参考株,基因Ⅲ型包括疫苗株H120、2886、MA5和M41。基因Ⅳ型包括4个国内分离株,其中YN株是一个IBV强毒株,对30日龄SPF鸡致死率为65%[5]。S1基因序列比较结果显示SDIB821/2012与同属于基因Ⅰ型的参考株核苷酸和氨基酸同源性分别为93.4%~99.3%和91.6%~98.5%,与疫苗株H120和MA5同源性均为76.9%和74.8%,与491同源性为78.4%和77.6%,与强毒株YN同源性为80.7%和80.4%。
2.2 试验鸡免疫后14 d抗体滴度与气管、泄殖腔疫苗株病毒检测情况 各免疫组试验鸡于攻毒之前每组取3只,扑杀后取气管组织、泄殖腔棉拭和血清样品进行病毒和抗体检测。结果显示各组试验鸡免疫后14 d,气管组织和泄殖腔棉拭存在不同程度排毒,说明IB疫苗免疫后14 d仍然在鸡群中存在。抗体检测结果显示各组试验鸡免疫后14 d ELISA抗体和针对SDIB821/2012的中和抗体均为阴性。对照组(D组)气管和泄殖腔病毒检测阴性,ELISA和中和抗体阴性(表2)。
2.3 试验鸡攻毒后临床症状及发病死亡情况 试验鸡攻毒后d2个别鸡出现精神沉郁,d3开始出现死亡,d4~6达死亡高峰,病死鸡表现气管出血、粘液,肾脏花斑肾,肝脏、肺脏充血、部分病死鸡心脏表面有白色尿酸盐(图略),与临床发病鸡群病理变化基本相同。d7存活鸡精神基本恢复。各组试验鸡发病死亡情况见表1。
2.4 试验鸡攻毒后喉头和泄殖腔棉拭以及内脏组织病毒分离结果 对免疫组、对照组d3、5、7试验鸡喉头和泄殖腔棉拭样品以及病死鸡气管、肾脏和肺脏组织样品进行病毒分离。检测结果显示,491、MA5和H120免疫组和对照组喉头、泄殖腔棉拭和内脏组织病毒均可检测到病毒(表3)。

图1 IBV分离株SDIB821/2012与参考株 S1基因(1611 bp)遗传进化分析Fig. 1 Phylogenetic analysis of SDIB821/2012 and reference strains based on S1 gene sequences using neighbor-joining method ( Mega 4.1)

表2 试验鸡免疫后14 d疫苗株气管、泄殖腔排毒和抗体检测结果Table 2 Shedding of IBV and antibody detection in trachea and cloacal of chicdens at 14 days post vaccination
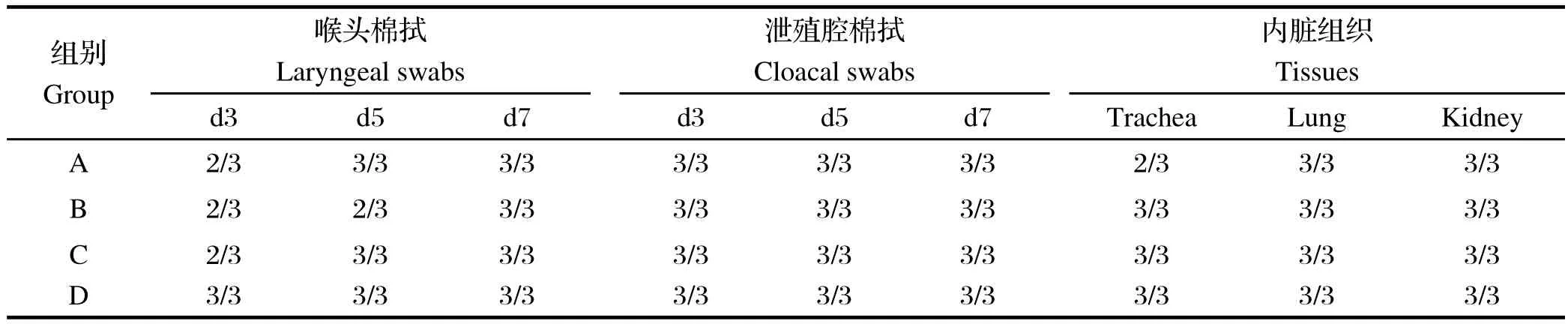
表3 试验鸡攻毒后喉头、泄殖腔棉拭和内脏器官排毒检测结果Table 3 The result of IBV shedding in laryngeal, cloacal and some internal organs of chickens challenged with SDIB821/2012
3 讨论
近年来,IBV对山东省商品肉鸡的危害越来越严重。SDIB821/2012是本实验室2012年从山东省某发病的商品肉鸡分离的毒株。免疫保护试验中对照组17日龄SPF鸡用SDIB821/2012攻毒后2 d开始出现精神沉郁,3~6 d死亡率约为67%(8/12),且病死鸡临床症状和病理变化与临床发病鸡群基本一致,表明SDIB821/2012致病性较强。
遗传进化分析结果显示,SDIB821/2012属于以QXIBV为代表的基因Ⅰ型。此类IBV于1997年首次在我国青岛市发病鸡群中分离,现在是国内IBV流行株的主要基因型[6,7],而且亚洲和欧洲多个国家均有此类毒株的流行[8-10],表明此类IBV毒株具有广泛的传播能力,应引起足够的关注。YN毒株也是一个IBV强毒株,2005年从云南省某发病鸡群中分离,研究发现YN对30日龄SPF鸡的致死率为65%[5]。遗传进化分析显示YN属于基因Ⅳ型,与SDIB821/2012遗传距离较远,S1基因核苷酸同源性为80.7%,表明二者具有不同的进化来源。
IB疫苗对SDIB821/2012免疫保护试验结果显示,根据攻毒后各组试验鸡发病死亡情况,491对流行株SDIB821/2012免疫保护率最高(90%),MA5和H120对SDIB821/2012保护率仅为33%和40%。国内外相关研究也证明H120活疫苗对QX基因型流行株免疫效果不理想[11,12],与本研究结果相符。各免疫组试验鸡攻毒后喉头、泄殖腔棉拭以及气管、肾脏和肺脏组织均可检测到病毒。而国外学者Terregino等[3]研究发现,SPF鸡用IB活疫苗491和MA5分别于1日龄和14日龄免疫后能够抵抗QX基因型IBV流行株的攻击,免疫鸡群攻毒后没有明显的临床症状,气管和肾脏组织也检测不到病毒。造成本研究结果与之差异的原因可能在于免疫程序、攻毒毒株和剂量不同,有必要通过相关试验进一步验证。
抗体检测结果显示,SPF鸡用3种IB弱毒活疫苗免疫后14 d,ELISA抗体和针对SDIB821/2012的中和抗体均为阴性,而491免疫组攻毒后具有90%的临床保护率,表明对于IBV弱毒活苗而言,细胞免疫和局部的粘膜免疫在抗病毒感染中起主要作用。
[1]Saif Y M. 禽病学[M]. 11版. 苏敬良, 高福, 索勋, 译. 北京: 中国农业出版社, 2005: 108-130.
[2]韦平, 秦爱建. 重要动物病毒分子生物学[M]. 北京: 科学出版社, 2008: 178-199.
[3]Ignjatovic J, Galli L. The S1 glycoprotein but not the N or M protein of avian infectious bronchitis virus induces protection in vaccinated chickens[J]. Arch Virol, 1994,138(1-2): 117-34.
[4]Luo H, Qin J, Chen F,et al. Phylogenetic analysis of the S1 glycoprotein gene of infectious bronchitis viruses isolated in China during 2009-2010[J]. Virus Genes,2012, 44 (1): 19-23.
[5]Feng J, Hu Y, Yu Q,et al. Virulent Avian infectious Bronchitis virus, People’s Republic of China[J]. Emerg Infect Dis, 2012, 18(12): 1994-2001.
[6]Han Z, Sun C, Yan B,et al. A 15-year analysis of molecular epidemiology of avian infectious bronchitis coronavirus in China[J]. Infet Genet Evol, 2011, 11(1):190-200.
[7]Li M, Wang X Y, Wei P,et al. Serotype and genotype diversity of infectious bronchitis viruses isolated during 1985-2008 in Guangxi, China[J]. Arch Virol, 2012,157(3): 457-474.
[8]Jang J H, Sung H W, Song C S, et al. Sequnence analysis of the S1 glycoprotein gene of infectious bronchitis virus:identification of a novel phylogenetic group in Korea[J]. J Vet Sci, 2007, 8(4): 401-407.
[9]Bayry J, Goudar M S, Nighot P K, et al. Emergence of a nephropathogenic avian Infectious Bronchitis virus with a novel genotype in India [J]. J Clin Microbiol, 2005, 43(2):916-918.
[10]Abro S H, Renström L H, Ullman K, et al. Emergence of novel strains of avian infectious bronchitis virus in Sweden [J]. Vet Microbiol, 2012, 155(2-4): 237-246.
[11]Sun C, Han Z, Ma H, et al. Phylogenetic analysis of infectious bronchitis coronaviruses newly isolated in China, and pathogenicity and evaluation of protection induced by Massachusetts serotype H120 vaccine against QX-like strains[J]. Avian Pathol, 2011, 40(1): 43-54.
[12]Lim T H, Kim M S, Jang J H, et al. Live attenuated nephropathogenic infectious bronchitis virus vaccine provides broad cross protection against new variant strains[J]. Poult Sci, 2012, 91(1): 89-94.
[13]Terregino C, Toffan A, Beato M S, et al. Pathogenicity of a QX strain of infectious bronchitis virus in specific pathogen free and commercial broiler chickens, and evaluation of protection induced by a vaccination programme based on the Ma5 and 4/91 serotypes [J].Avian Pathol, 2008, 37 (5): 487-493.
