帕金森病患者脑脊液中miR-9a的表达及其临床意义
2014-06-07宏朱政峰李
张 宏朱政峰李 辉
(1 兰州军区空军机关医院神经内科,甘肃 兰州 730000;2 兰州军区空军机关医院医务处,甘肃 兰州 730000)
帕金森病患者脑脊液中miR-9a的表达及其临床意义
张 宏1朱政峰2李 辉1
(1 兰州军区空军机关医院神经内科,甘肃 兰州 730000;2 兰州军区空军机关医院医务处,甘肃 兰州 730000)
目的研究miR-9a在帕金森病(PD)患者脑脊液中的表达,为帕金森病的早期诊断提供临床检测指标。方法采用实时荧光定量PCR检测42例PD患者、24例普通头痛患者和24例健康人脑脊液中miR-9a表达水平情况。分析脑脊液中miR-9a表达水平与PD相关临床指标的关系。结果PD组患者脑脊液中miR-9a表达水平明显高于头痛组和健康对照组(P<0.05),且PD患者脑脊液中miR-9a表达与帕金森综合评分量表(UPDRS)分级呈正相关(r=0.70,P<0.05)。ROC曲线确诊PD患者的脑脊液miR-9a临界值为0.667,其诊断敏感度为85.7%,特异度为77.9%。结论脑脊液miR-9a的检测不仅有助于PD的诊断,也可能作为判断PD病情的指标之一。
帕金森病;脑脊液;miR-9a;生物标志物
帕金森病(Parkinson disease,PD)是以黑质纹状体系统多巴胺能神经元进行性变性缺失和Lewy小体出现为特异性改变,好发于中老年人,其病因和发病机制至今尚未完全明确[1]。流行病学调查显示,我国50 岁以上人群中 PD 的患病率约为1%。由于PD患者可出现严重的运动功能障碍,如震颤、强直及动作迟缓,严重者生活不能自理,给社会和家庭带来沉重的负担[2]。目前临床上对于PD的诊断只能依靠患者临床症状,而当患者出现明显的临床症状时,神经元损害往往已经达到了不可代偿的阶段。因此,寻找一种可靠的、能早期诊断并跟踪疾病进展的生物标志物,已成为目前研究PD的热点。最近的研究表明,人的体液中存在稳定表达的miRNAs。且PD患者脑脊液中miRNAs的表达与正常人存在比较明显的差异[3]。有报道脑组织中miR-9a的表达与神经系统发育和神经系统相关疾病密切相关。但脑脊液miR-9a能否作为PD诊断及病情评估的标志物尚不清楚。本研究通过检测PD患者脑脊液中的表达水平,探讨miR-9a在PD的临床诊断中的应用价值。
1 对象与方法
1.1 研究对象:选取2009年10月至2013年10月在我院神经内科住院的42例原发性PD患者为PD组。所有PD 患者的诊断均符合全国锥体外系疾病讨论会制定的PD诊断标准,并且排除其他脑变性疾病。UPDRS分级Ⅰ~Ⅲ。其中男性26例,女性16例;年龄57~77岁,平均(64.6 ±7.8)岁;病程2~6年。头痛组为24例主诉头痛患者,均排除脑血管疾病、神经系统感染和肿瘤等器质性病变。其中男性9例,女性15例,平均年龄(55.4±7.2)岁。健康对照组为24例健康人,其中男性12例,女性12例,平均年龄(50.7±6.4)岁。所有受试者及其家属均被明确告知且签署知情同意书。
1.2 主要设备和试剂:Trizol 试剂(Invitrogen公司);TaqMan MicroRNA Assay和mirVana™ miRNA Isolation Kit(Ambion公司);ABI PRISM 7900 实时荧光定量PCR仪(ABI公司);NanoDrop® ND-3300微量分光光度仪(ThermoFisher公司);miR-9a及U6引物序列购于北京天根生物工程有限公司。
1.3 脑脊液采集:所有受试者均采取腰椎穿刺的方式收集脑脊液。患者取侧卧位,在局麻下行腰椎穿刺,经检测颅内压无升高或降低,椎管无阻塞后。取无色清亮脑脊液约5~6 μL,室温下1500 rpm/min离心10 min,取上清保存于-80 ℃冰箱待测。
1.4 RT-PCR:①Trizol法提取脑脊液RNA,NanoDrop® ND-1000全波长紫外/可见光扫描分光光度计测定RNA浓度,变性琼脂糖凝胶电泳检测总RNA质量。mirVana™ miRNA Isolation Kit总RNA中分离出miRNA。②cDNA合成:按RT-PCR反应试剂盒操作步骤制备10 μLRT反应体系:mirVana5×RT Buffer 2 μL,1×mirVanaRT Primer 1 μL,Arrayseript Enzme Mix 0.4 μL,25 ng RNA,加无RNA酶水至总体积10 μL。在GeneAmp PCR System 9700进行逆转录反应:16 ℃ 30 min, 42 ℃ 30 min,83 ℃ 5 min。反应结束后,冰浴冷却,-80 ℃保存。③Realtime PCR反应:采用TaqMan MicroRNA Assays,以U6为内参基因,建立20 μL反应体系:Product from RT reaction 1.33 μL,Taqman MicroRNA Assay(20×)1 μL,Taqman 2×Universal PCR Master Mix 10 μL,Nuclease-free water 7.67 μL。反应条件:95 ℃ 10 min,(95 ℃ 15 s,60 ℃ 60 s)共40个PCR循环。采用2-ΔΔCT法分析miR-9a表达相对水平情况。
1.5 统计学处理:应用SPSS 13.0统计学软件包对数据进行统计分析。采用采用独立样本t检验,Sperman等级相关分析评估脑脊液miR-9a表达水平与UPDRS分级之间的相关性,以P<0.05为差异具有统计学意义。
2 结 果
2.1 三组脑脊液miR-9a表达水平比较:健康人脑脊液中miR-9a表达水平较低(0.25±0.04);头痛组脑脊液中miR-9a表达水平为(0.26± 0.07),与健康组相比无明显差异(P>0.05)。PD组患者脑脊液中miR-9a表达水平相对值为(1.38±0.37),明显高于健康对照组和头痛组(P<0.05)(图1)。
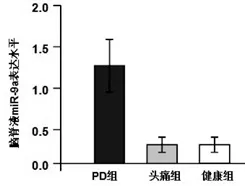
图 1 不同组脑脊液miR-9a表达水平
2.2 脑脊液miR-9a表达情况在诊断PD上的效能评价:以脑脊液中miR-9a表达水平相对值为检测变量,以分组为状态变量,建立ROC曲线。结果显示,脑脊液miR-9a诊断PD的ROC曲线下面积AUC为0.815。通过计算确定miR-9a诊断PD的最佳临界值为0.667,在此临界值下的诊断敏感度为85.7%,特异度为77.9%(图 2)。
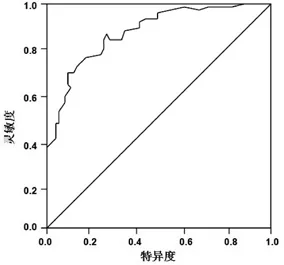
图 2 ROC曲线
2.3 脑脊液miR-9a与PD组各因素之间的相关性分析:由表1可见,Sperman相关性分析显示PD患者脑脊液miR-9a水平与年龄、病程无相关性(P>0.05),而与UPDR分级呈正相关(P<0.05)。
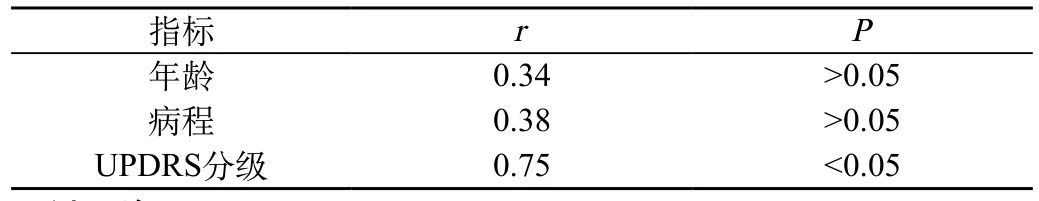
表1 miR-9a与PD组各因素相关性分析
3 讨 论
PD的发病机制十分复杂,目前尚不十分清楚,可能主要由于黑质-纹状体多巴胺能神经通路变性和Lewy小体的形成导致DA能神经元减少。由于PD发病隐匿,早期脑组织无明显影像学改变,待神经功能障碍症状时病变损害已不可逆转。因此,早期诊断对于PD的治疗具有非常熏要的临床意义。
目前的研究证实,脑脊液的生化改变能够反映大脑病理改变,因而在诊断神经变性疾病方面较血清学更具敏感性和特异性。且由于受脑组织取材的限制,因此通过检测脑脊液中PD相关生物学标志物是早期诊断PD的最佳途径[4]。近年来,脑脊液中PD相关生物学标志物的研究已取得较大的进展。如黄嘌呤、尿酸、β2苯乙胺、α-Synuclein蛋白、超氧化物歧化酶等脑脊液分子生物学指标都被证实与PD的发生有关,且有成为PD生物标志物的潜能[5]。但是,以上标志物在诊断PD的敏感度和特异度上尚存在不足。
miR-9a是近年来发现的在哺乳动物脑组织中高度表达的miRNA,且其核苷酸100%保守。研究发现miR-9a在果蝇感觉器官前体细胞(SOP)中表达极其低下而在其临近上皮细胞中呈高表达。提示miR-9a可能对感觉神经元发育成熟和功能加以调控。且miR-9a可以通过调控SOP向感觉神经元分化过程中必需的转录因子,进而使SOP细胞向感觉神经细胞分化[6]。最近Lukiw研究发现阿尔茨海默病(AD)患者海马内miR-9表达水平明显上调[7]。以上研究提示miR-9a与神经系统地发育和疾病的发生密切相关。因此,miR-9a在脑脊液的研究可能有利于为我们阐明PD的具体发病机制,也为早期诊断PD提供了一个潜在的标志物。
本次研究我们采用RT-PCR检测PD患者、头痛患者和健康人脑脊液中miR-9a表达水平,发现PD患者脑脊液中miR-9a表达水平明显高于头痛组和健康对照组(P<0.05)。同时,我们利用ROC曲线确定了脑脊液中miR-9a在诊断PD上的效能,发现脑脊液miR-9a诊断PD的ROC曲线下面积AUC为0.815。通过计算确定miR-9a诊断PD的最佳临界值为0.667,且在此临界值下的诊断敏感度为85.7%,特异度为77.9%。提示脑脊液中miR-9a的高表达可以作为PD的诊断指标,且具有较高敏感度和特异度。此外,通过Sperman等级相关分析,PD患者脑脊液中miR-9a表达水平与患者年龄、病程无相关性(P>0.05),而与UPDR分级呈正相关(P<0.05)。提示可以通过检测PD患者脑脊液中miR-9a表达水平来推测PD损伤程度。
综上,本次研究结果提示脑脊液miR-9a可能成为新的PD诊断及判断病情的标志物,其具有较高敏感度和特异度。随着对miRNA在神经疾病领域内的研究,miRNA将会成为PD疾病一个新的诊断和治疗靶点。
[1] Dexter DT,Jenner P.Parkinson disease: from pathology to molecular disease mechanisms[J].Free Radic Biol Med,2013,62(1):132-144.
[2] 帕金森病诊疗指南[J].中国临床医生,2010,38(2):77-79.
[3] Machida A,Ohkubo T,Yokota T.Circulating microRNAs in the cerebrospinal fluid of patients with brain diseases[J].Methods Mol Biol,2013,1024(1):203-209.
[4] Shi M,Bradner J,Hancock A M,et al.Cerebrospinal fluid biomarkers for Parkinson disease diagnosis and progression[J].Ann Neurol, 2011,69(3):570-580.
[5] Ascherio A,Lewitt P A,Xu K,et al.Urate as a predictor of the rate of clinical decline in Parkinson disease[J].Arch Neurol,2009,66 (12):1460-1468.
[6] Li Y,Wang F,Lee J A,et al.MicroRNA-9a ensures the precise specification of sensory organ precursors in Drosophila[J].Genes Dev, 2006,20(20):2793-2805.
[7] Lukiw W J.Micro-RNA speciation in fetal,adult and Alzheimer's disease hippocampus[J].Neuroreport,2007,18(3):297-300.
R744
B
1671-8194(2014)36-0166-02
