模拟训练(五)
2014-06-04

1. 下列物质沾在试管内壁上,用盐酸不能洗去的是( )。
A. 氢气还原氧化铜实验残留的红色固体
B. 氢氧化钠溶液与硫酸铜溶液反应后留下的蓝色固体
C. 碱式碳酸铜受热分解后残留的黑色粉末
D. 铁钉锈蚀形成的锈斑
2. 有一包铜屑和炭粉组成的固体混合物,在一定条件下与氧气充分反应,生成氧化铜(固体)和二氧化碳(气体),并测得反应前后固体质量不变,则原固体混合物中碳的质量分数是( )。
A. 15% B. 20%
C. 32% D. 无法确定
3. 大气污染物中的SO2形成酸雨时,与氧气作用有稀硫酸生成,则它腐蚀铝制品表面氧化铝的化学反应方程式为_____________,反应类型为_____;当酸雨腐蚀到金属铝的时候,其化学反应方程式为_____________,反应类型为_______。
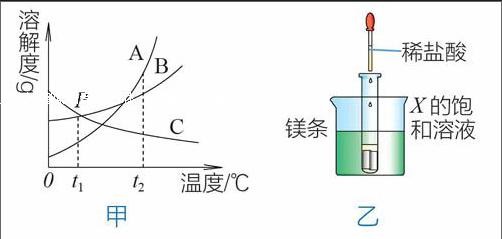
4. 下图甲是A、B、C三种固体物质的溶解度曲线图。
甲 乙
(1)甲图中,在t2 时,A、B、C 三种物质中,溶解度最大的是_______,P点所表示的含义为____________________。
(2)t1 时,将B 物质的不饱和溶液转变成饱和溶液可采取的方法有____________。
(3)如乙图所示,20℃时,把试管放入盛有 X 的饱和溶液的烧杯中,在试管中加入几小段镁条,再加入5mL稀盐酸,立即产生大量的气泡,同时烧杯中出现浑浊,则 X 可能为A、B、C 三种固体物质中的哪一种?
5. 已知Na2O2是一种淡黄色粉末,易与水反应,生成氢氧化钠和一种能使带火星的木条复燃的气体。现有Na2O与Na2O2的混合物1.09g和足量水反应后得到300g溶液,其中含溶质1.2g。
(1)写出Na2O2与水反应的化学反应方程式。
(2)在上述溶液中加入质量分数为3.65%的盐酸,若充分反应后,溶液呈中性,加入盐酸的质量是多少?
(3)计算出原混合物中Na2O与Na2O2的质量。
6. 为了对某一大桶氯化钠溶液进行浓度分析,一位分析师分别做了甲、乙、丙、丁4组检测实验,其实验数据如下表,请仔细观察分析,回答下列问题。
(1)两溶液恰好完全反应的是____(填“甲”“乙”“丙”或“丁”)的实验。
(2)请计算出该桶氯化钠溶液中氯化钠的质量分数。 (适合初中学生)
7. 已知铱的一种同位素是 Ir,则其核内的中子数是( )。
A. 77 B. 114 C. 191 D. 268
8. 某pH=3的酸溶液和pH=11的碱溶液等体积混合后的溶液呈酸性,其原因可能是
( )。
A. 生成了一种强酸弱碱盐
B. 弱酸溶液和强碱溶液反应
C. 强酸溶液和弱碱溶液反应
D. 一元强酸溶液和一元强碱溶液反应
9. 用浓度为24.5%的H2SO4溶液(ρ = 1.20 g/cm3)配制100mL 0.20mol/L的H2SO4溶液时,要用到的玻璃仪器有:容量瓶、酸式滴定管、烧杯、量筒、玻璃棒和______。使用容量瓶时应先检查其是否____;用____量取____mL 24.5%的硫酸溶液进行配制。
10. 中学化学实验中有个木炭还原氧化铜的实验(见右图),该实验成功率很低,实验效果不明显。木炭还原氧化铜实验是固体试剂与固体试剂的反应,请你凭经验估计一下,要使木炭还原氧化铜这个固—固相反应的实验效果获提升(反应快,能清楚看到产物铜),应该注意改善哪些反应条件?
11. 在1L 2mol/L的稀硝酸溶液中加入一定量的铜粉,充分反应后,溶液的质量增加了13.2g,该反应的化学方程式为:3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑+ 4H2O。
(1)上述实验加入的铜粉是多少g?
(2)理论上可产生NO气体多少L(标准状况下)?
提示:硝酸是过量的,不能用硝酸的量来求解。铜跟硝酸反应后溶液增重,原因是生成了硝酸铜,可利用这个差量变化进行求解。
(适合高中学生)
2014年 第 4 期答案
1. C 2. A 3. C
4.(1)2H2O2 = 2H2O + O2↑ (2)密封、避免光照(或用棕色瓶装)
5. 相同,氧
6.(1)酸,< (2)酸溶液显酸性;但酸性溶液不一定是酸溶液,有些盐溶液也呈酸性
7.(1)稀硫酸中溶质的质量分数为19.6% (2)排水,500
8. B 9. C
10. 钠离子、亚铁离子、硫酸根离子等,用洁净的铂丝蘸取最后一次洗涤液少许,放在酒精灯火焰上灼烧,如果观察到火焰呈黄色,说明产品没有洗涤干净;用试管取最后一次洗涤液少许,先加入少量KSCN溶液,无明显现象,再加入少量氯水,如果溶液变成血红色,说明产品已经洗涤干净;用试管取最后一次洗涤液少许,向其中加入少量氯化钡溶液,若无白色沉淀生成,说明产品已经洗涤干净
11. KNO3被还原的产物NO,所以硝酸钾和氯化亚铁完全反应的化学方程式为:KNO3 + 3FeCl2 + 4HCl = 3FeCl3 + KCl + NO + 2H2O
