长江口可培养耐(嗜)盐细菌群落结构研究
2014-05-30孟凡旭吴月红金文静王春生许学伟
孟凡旭,吴月红,金文静,王春生,许学伟
(1.国家海洋局 海洋生态系统与生物地球化学重点实验室,浙江 杭州 310012;2.国家海洋局 第二海洋研究所,浙江 杭州 310012;3.浙江海洋学院 萧山校区基础部,浙江 杭州 311231)
0 引言
自然环境中的细菌群落结构研究在微生物生态学中具有重要意义[1]。群落结构反映了微生物所处生境的特征,通过群落结构研究,可分析微生物在生态系统中的功能及其在生物地球化学循环中的作用。
长江口由于受长江径流影响,盐度变化较大。长江口及冲淡水区是不同水团的交汇区,南部台湾暖流携带的高盐水沿海洋底部深谷自东南楔入该交汇区,北部低盐的黄海水团沿苏北沿岸到达该区,长江冲淡水则向东北方向扩展[2]。此外,被长江径流携带进入海洋的大量陆源溶解营养盐可直接影响河口的初级生产力,间接影响细菌的生长和分布[3-4]。盐度和营养盐的复杂变化,必然对长江口海洋微生物群落结构产生深刻的影响。
对盐环境中的微生物而言,盐份是影响其生长繁殖的非生物主导因子。以微生物的NaCl耐受实验数据为依据,KUSHNER[5]和 VENTOSA et al[6]把盐环境中生存的微生物划分为不同的生理类型:可在0%(w/v)盐含量下生长的细菌属于耐盐菌,不能在0%wv盐含量下生长但能在0.5%wv 盐含量下生长的细菌属于中度嗜盐菌。
我国对长江口海洋微生物群落结构研究较少,该海域浮游耐盐细菌群落结构多样性的数据尤为缺乏[7-9]。本文针对长江口10个站位样品,分离培养耐盐细菌并开展系统发育学研究,分析了长江口耐盐细菌群落结构及多样性,并对这些海洋优势耐盐细菌类群在海洋环境中的作用进行了初步探讨。
1 材料和方法
1.1 样品采集
2007年在中国东海(30~32°N,121~127°E)采集了10个站位的表层和底层水(或多管上覆水)共26个样品(采样站位见图1),装无菌采样瓶后运抵实验室4℃保存。
1.2 细菌分离培养
采用高盐度HM培养基和低盐度ZMCA培养基分离纯化海洋微生物[10]。HM培养基配方:氯化钠100.0g,氯化钾2.0g,硫酸镁(七水)1.0g,氯化钙(二水)0.36g,溴化钠0.23g,碳酸氢钠0.06g,氯化铁微量,葡萄糖1.0g,peptone(Difco)5g,yeast extract(Difco)10g,PH 7.5。ZMCA培养基配方:氯化钠19.45g,氯化镁8.8g,硫酸钠3.24g,氯化钙1.8g,氯化钾0.55g,碳酸氢钠0.16g,柠檬酸铁(五水)0.1g,溴化钾0.08g,氯化铯34mg,硼酸22mg,硅酸钠4.0mg,氟化钠2.4mg,硝酸铵1.6mg,磷酸钠8.0mg,peptone(Difco)0.5g,yeast extract(Difco)0.1g,pH 7.2。
水样混匀,取80μL涂布于HM 1/10营养(即HM培养基中peptone、yeast extract和葡萄糖取1/10量,其它不变)和ZMCA平板,倒置于培养箱中,28℃光照培养3~5d。每个样品挑取5个以上(M5-1和M5-4站位每个样品挑取3个以上)不同形态特征的菌落,接种于HM液体试管,28℃光照条件下,150r/min摇床震荡培养至菌液变浑浊,利用三线法平板划线纯化。纯化菌株用HM斜面4℃和甘油管-80℃保藏。
1.3 菌株形态特征观察
采用活体观察和透射电镜观察2种方式。
活体观察:取对数生长期菌液涂于载玻片上,通过光学显微镜(Olympus BX40)观察细胞运动性及形态特征。
透射电镜观察:取对数生长期的划线斜面,刮取菌体悬浮于无菌水中制成菌悬液。将菌悬液滴于铜网上并用滤纸吸去多余液体,然后用醋酸双氧铀染色。制作细胞超薄切片时,以2.5%vv戊二醛固定细胞,并通过锇酸固定、乙醇脱水、包埋、切片和醋酸双氧铀染色等步骤制备切片样品。在透射电镜(JEM-1230)下观察细胞的形态、大小、分裂方式、芽孢产生、细胞壁结构、内涵体和鞭毛数量及形态等情况。
1.4 耐盐性实验
菌液以1%(v/v)接种量接入3mL 0%(w/v)NaCl HM液体试管和0.5% (w/v)NaCl HM 液体试管,置于恒温摇床28℃震荡培养,每天观察生长情况,连续观察记录一周。
1.5 硝酸盐、亚硝酸盐还原实验
菌液以10% (v/v)接种量(300μL)接入0.2%(w/v)KNO3和0.05%(w/v)NaNO2HM 液体试管,培养3~7d,待菌液生长浑浊后进行Griess检验。
在比色瓷盘小窝中倒入少许培养液,分别加1滴Griess A液及B液,在不接种对照中也同样加入A液和B液各一滴。若无色再加入1到2滴二苯胺试剂,溶液变为粉红色、玫瑰红色、橙色、棕色等表明亚硝酸盐存在。加入二苯胺试剂后,不呈蓝色反应,表明硝酸盐和形成的亚硝酸盐都已还原成其他物质;加入二苯胺试剂后,呈蓝色反应,表明培养液中仍有硝酸盐。
Griess试剂A液配方为0.5g对氨基苯磺酸和150mL 10%(v/v)稀醋酸。Griess试剂B液配方为0.1gα-萘胺,20mL蒸馏水和150mL 10%(v/v)稀醋酸。二苯胺试剂配方为0.5g二苯胺溶于100mL浓硫酸中,用20mL蒸馏水稀释。
1.6 分离纯化菌株的分子鉴定
采用菌液PCR法扩增纯培养物16SrDNA序列,PCR扩增引物为27bf(5'-AGA GTT TGA TCC TGG CTC AG-3')和 1 492br(5'-ACG GHT ACC TTG TTA CGA CTT-3')。
50μL反应体系为:5μL 10×PCR Buffer,0.5μL dNTP Mixtures(10mmol/L),1μL Primer 27bf和Primer 1 492br(4μmol/L),41μL H2O,1μL模板DNA,0.5 μL Taq酶(Takara)。PCR反应条件为:50μL反应体系加入50ng DNA模板,33个循环:变性94℃,45s;退火55℃,45s;延伸72℃,90s。
PCR扩增产物送北京诺赛基因公司进行纯化并进行DNA序列测定,测序引物为27bf,测定的序列长度大于500bp。测定序列采用Blastn进行比对。相似性低于97%的序列,采用27bf和1 492br重新进行测定。重新测定后的序列长度大于1 300bp,为16SrDNA序列长度的90%以上。
1.7 长江口细菌多样性分析
根据EzTaxon-e比对和系统发育分析结果,将获得的16SrDNA序列进行归类,定义相似性小于97%的序列作为不同分类单元,采用物种多样性、丰富度、均匀度和优势度指数进行多样性分析。
细菌序列与从数据库(EzTaxon-e)中获得的相近序列,应用Mega 5.05进行多序列匹配比对,采用邻接法构建系统进化树,并通过自展分析进行置信度检测,自展数据集为1 000次。
2 结果与讨论
2.1 环境特征
长江口、杭州湾及冲淡水区是一个不同水团的交汇区,由近岸向外海,由湾顶向湾口,盐度逐渐增高,全水域变幅为0.03~34.5。长江口、杭州湾及其口门附近海域为盐度最低区域,M5-1、N6-2和 M4-1三个站位处于该区域,盐度小于20(图1a)。硝酸盐浓度在湾顶最高,达到125.88μmol/L(图1b)。

图1 采样站位盐度(a)和硝酸盐含量(b)Fig.1 Salinity(a)and nitrate concentration(b)of sampling stations

图2 菌株L039细胞形态图Fig.2 Cell morphology of strain L039
2.2 长江口细菌的分离及分子鉴定
根据菌落大小、形态和颜色等特征,挑取分离平板上的单菌落进行四分划线纯化,分别通过HM培养基和ZMCA培养基从长江口水样中分离得到136株菌和20株菌。以L039菌株为例,菌落无色,圆形,略微凸起,直径为1~2mm,显微镜观察发现细菌具有单极鞭毛(图2)。
采用细菌通用引物,扩增获取了156株菌株的16S rDNA序列。分子鉴定结果表明,以HM培养基分离的136株菌株可划分至33个不同的分类单元(OTU),这些菌株分别属于α-变形菌纲(Alphaproteobacteria,7株, 5.15%γ-变形菌纲(Gammaproteobacteria86株,63.2%)和厚壁菌门中的芽孢杆菌纲(Bacilli,43株,31.6%)3个类群(表1和图3)。α-变形菌纲分属于海栖菌属(Oceanicola)、箭头菌属(Sagittula)、橙色单胞菌属(Aurantimonas)和斯塔普氏菌属(Stappia);γ-变形菌纲分属于交替单胞菌属(Alteromonas)、海杆菌属(Marinobacter)和假交替单胞菌属(Pseudoalteromonas);芽孢杆菌纲分属于芽孢杆菌属(Bacillus)、薄壁芽孢杆菌属(Gracilibacillus)、海洋芽胞杆菌属(Oceanobacillus)、盐芽孢杆菌属(Halobacillus)和深海芽孢杆菌属(Thalassobacillus)。以ZMCA培养基分离获得的20株菌株分属α-变形菌纲(Alphaproteobacteria,16株,80%)和放线菌纲(Actinobacteria4株,20% 两个类群,可划分为10个不同的分类单元。

图3 HM培养基分离细菌在各站位类群分布Fig.3 Distribution of bacteria isolated from medium HM within different stations
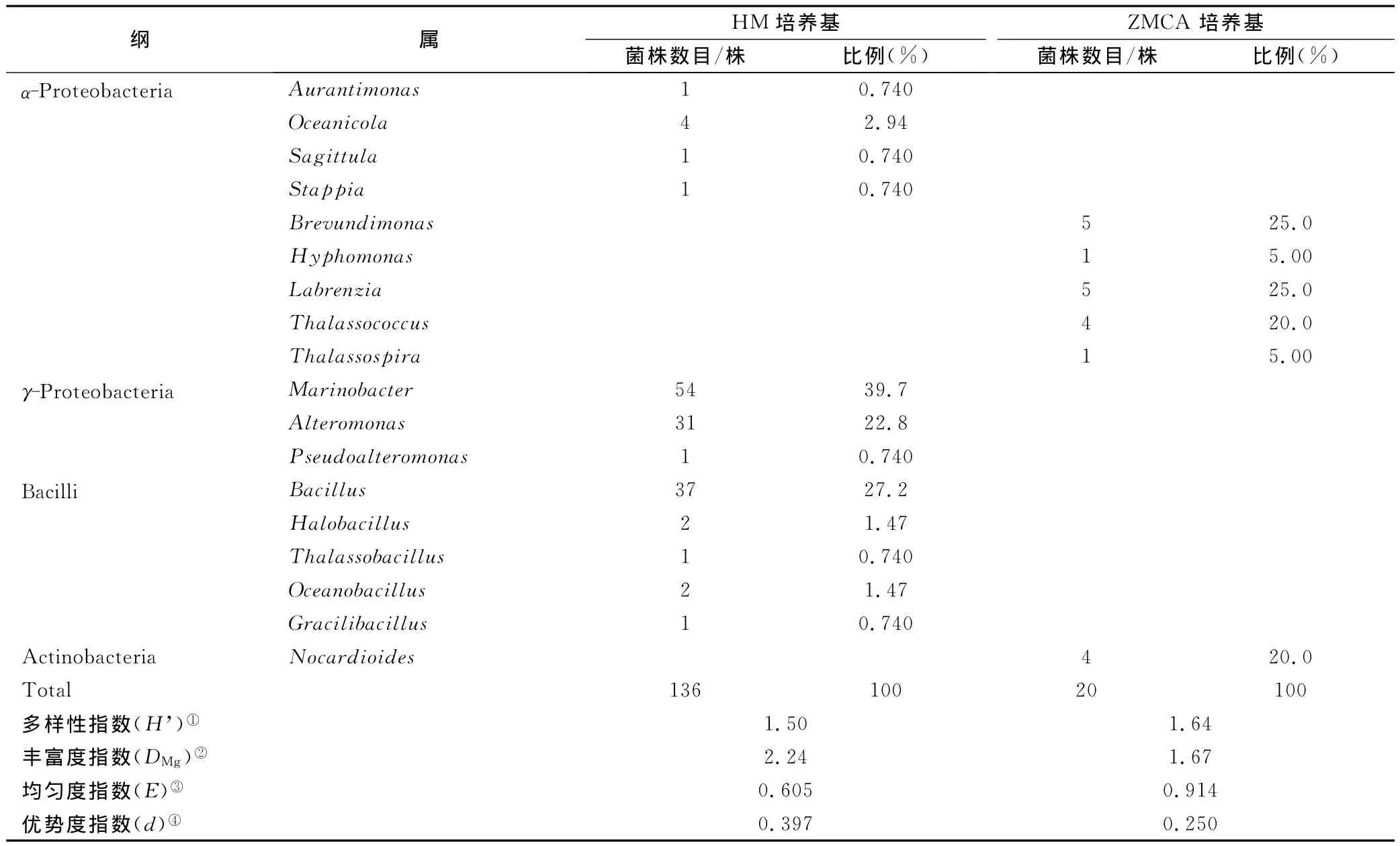
表1 长江口细菌类群数量及多样性指数Tab.1 Number of cultured marine bacteria and diversity indices in the Changjiang River Estuary
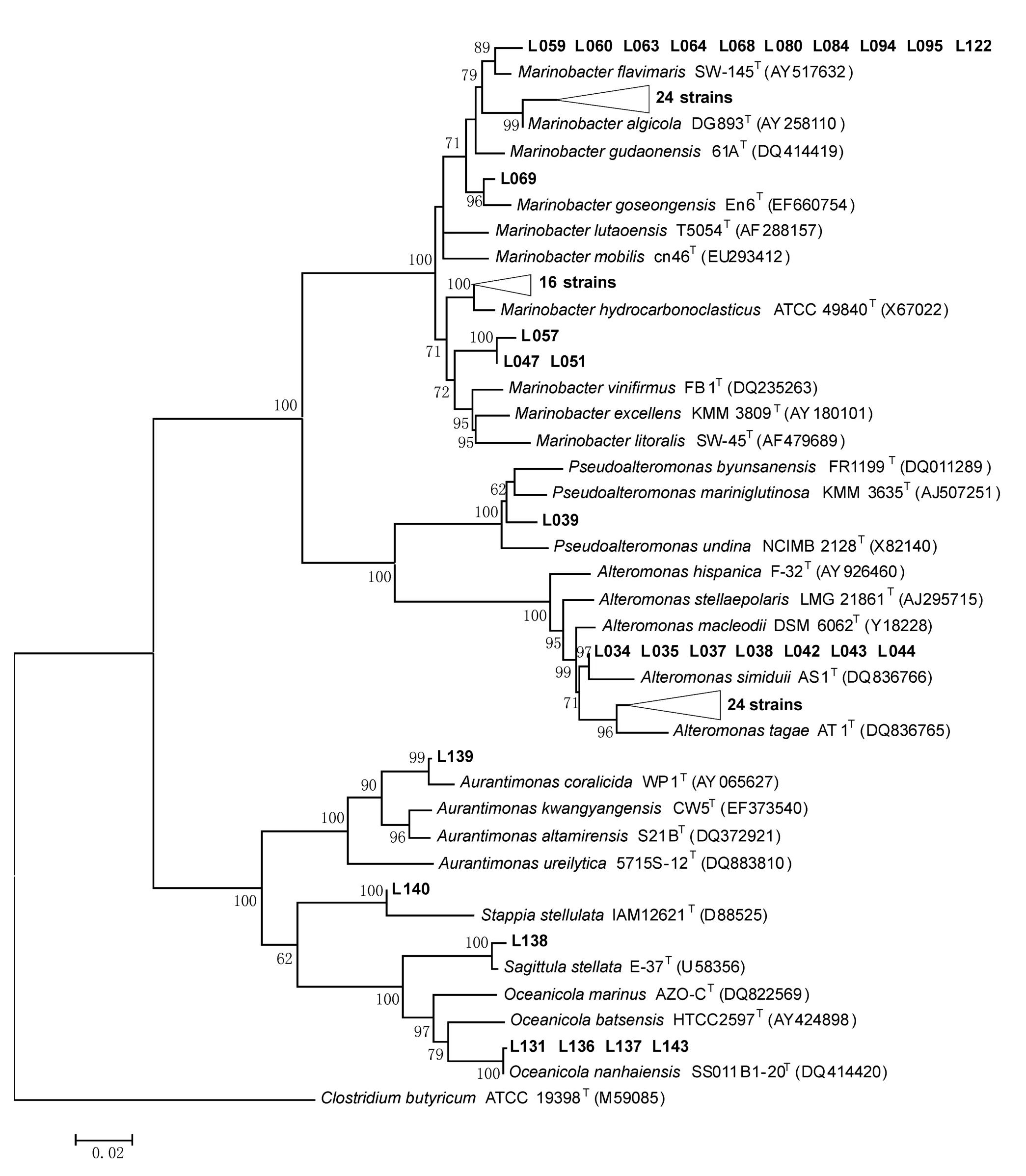
图4 长江口可培养耐盐变形菌门细菌16SrDNA系统发育树Fig.4 Phylogenetic tree of 16SrDNA sequences of Proteobacteria strains from the seawater in the Changjiang River Estuary
α-变形菌纲细菌对环境依赖程度较大,多数为严格好养微生物,一旦面临恶劣环境容易发生不可逆损伤而不能增殖。在高盐条件下分离获得的α-变形菌纲细菌数量少,隶属于4个属。γ-变形菌纲的细菌适应性较强,能利用多种碳源物质进行生长[11],它们在不同环境的生态系统中都有广泛的分布[12]。其中,交替单胞菌属广泛分布于海水中,且在开放海域及海岸均有分布,该类群好氧、化能异养,能利用短链脂肪酸和一些烷烃作为唯一碳源;海杆菌属多数为兼性好养菌,其生存范围较为宽广[13],是海水中可培养的优势细菌;假交替单胞菌属据报道具有杀藻的能力[14-15]。厚壁菌门细菌生存范围较为宽广,具有很好的环境适应性。从靠近海岸的站点(M5-1、N6-2和M4-1)分离得到的细菌均为厚壁菌门(Firmicutes)微生物,而远离海岸的站点细菌均属于变形菌门(图3),可见靠近海岸的站点和远离海岸的站点细菌群落结构差异明显,这与 M5-1,N6-2和 M4-1三个站位受到长江口和杭州湾淡水的影响盐度变化较大,同时受长江口外长期缺氧及陆源污染物的影响有关,也表明厚壁菌门细菌对这种特殊的环境具有更好的适应性。

图5 长江口可培养耐盐厚壁菌门细菌16SrDNA系统发育树Fig.5 Phylogenetic tree of 16SrDNA sequences of Firmicutes strains from the seawater in the Changjiang River Estuary
分离所得变形菌门和厚壁菌门微生物及其相邻菌株系统发育树如图4和图5所示,图中标尺为每个核苷酸置换率为0.02,置信度小于60的未标出数值。分离所得大多数菌株与已报道的分离自海洋或其他环境的微生物相似性很高(>97%),但研究也发现一些菌株与已报道标准菌株间的相似度较低。如L039与Pseudoalteromonasbyunsanensis的相似性为97%,可能代表了新的分类单元。
2.3 长江口细菌多样性分析
物种多样性是把物种的数目和个体数目分配状况(丰度和均匀度)结合起来考虑的一个统计量,它反映了生物群落和生态系统的特征,例如结构类型、发展阶段、稳定程度和生境差异等等。Shannon多样性指数和Margalef丰富度指数是对稀有物种敏感的指数;与之相反,Shannon均匀度指数和Berger-Parker优势度指数属于对富集种相对敏感的指数。
从分离结果来看,长江口细菌具有较好的物种多样性(表1),且其中一些菌株与已报道菌株16SrDNA序列间差异较大,说明我国长江口水域有许多未被发现的微生物资源。由于培养基对微生物的选择性及培养条件的局限性,分离的菌株集中于变形菌门等少数门类,大量难培养微生物的分离尚有待于探索。HM培养基为模拟海产品腌制的高盐度培养基,ZMCA培养基为模拟海洋环境的低盐度培养基,以这2种培养基分离的菌株多样性指数略有差异但不明显(表1)。HM培养基分离得到的细菌多样性较ZMCA培养基差,与HM培养基盐度较高,对微生物筛选作用较强有关;ZMCA培养基是一种寡营养培养基,相比其他普通培养基,该培养基降低了营养成分浓度,可在很大程度上避免少数菌株生长过快导致多样性偏低的现象。
2.4 长江口细菌耐盐性、硝酸盐还原性和亚硝酸盐还原性分析
通过HM培养基分离培养获得的136株菌株中,有70.5%的菌株可在0%(w/v)NaCl条件下生长,属于耐盐菌;25.9%菌株不能在0%(w/v)NaCl条件下生长但能在0.5%(w/v)NaCl条件下生长,属于中度嗜盐菌;另外3.59%菌株不能在小于0.5%(w/v)NaCl条件下生长,生长的下限未知,能耐受10%(w/v)的NaCl,也属于中度嗜盐菌。通过ZMCA培养基分离获得的菌株均可在0%(w/v)NaCl条件下生长,属于耐盐菌。
通过分离结果可以发现与陆地不同距离的站位其微生物类群有很大不同。长江口受淡水流入影响,盐度变化较大,该系统中的微生物部分来自海洋,另一部分则来自陆地并适应了海洋环境,盐浓度适应也是其表现之一。
对分离自HM培养基的136株细菌的硝酸盐和亚硝酸盐还原性分析表明,30.3%的细菌能还原硝酸盐,而只有9.90%的细菌能还原亚硝酸盐,其数量仅为硝酸盐还原细菌的1/3左右。
3 结论
本研究采用HM培养基和ZMCA培养基,分离培养得到长江口10个站位样品的耐(嗜)盐菌156株,分析分离得到的菌株可知:
(1)以HM培养基分离获得136株菌株,可划分为33个分类单元,分属于α-变形菌纲、γ-变形菌纲和厚壁菌门中的芽孢杆菌纲3个类群,其中γ-变形菌纲为优势耐(嗜)盐细菌。与陆地不同距离的站位其微生物类群有很大不同:靠近海岸的站点 M5-1,N6-2和 M4-1耐(嗜)盐细菌均属于厚壁菌门,而远离海岸的站点耐(嗜)盐细菌均属于变形菌门。由HM培养基分离获得的菌株中,耐盐菌占70.5%,中度嗜盐菌占29.5%。
(2)以ZMCA培养基分离获得的20株菌株分属α-变形菌纲(80%)和放线菌纲(20%),可划分为10个分类单元。由ZMCA培养基分离获得的菌株均为耐盐菌。
(3)HM培养基分离得到的136株细菌的硝酸盐和亚硝酸盐还原性分析表明,亚硝酸盐还原菌数量仅为硝酸盐还原菌的1/3左右。这表明在海产品腌制过程中,亚硝酸盐的产生速度可能远远高于其转化为N2或N2O的速度,由于亚硝酸盐具有毒性,在腌制海产品这种高盐的闭合环境中,亚硝酸盐的积累过程和转化效率是关系到食品安全的重要问题,应引起足够的重视。
(References):
[1]LU Jing-rang,DOMINGO J W S,LAMENDELLA R,et a1.Phylogenetic diversity and molecular detection of bacteria in gull feces[J].Applied and Environmental Microbiology,2008,74(13):3 969-3 976.
[2]NING Xiu-ren,KUTI C.The relationship between Chl a,bacteria,ATP,POC and oxygen uptake rates of microorganism in Changjiang River Estuary and diluted water area[J].Acta Oceanologica Sinica,1991,13(6):831-837.
宁修仁,C.库蒂.长江口及冲淡水区叶绿素a、细菌、ATP、POC及微生物呼吸作用速率之间的关系[J].海洋学报,1991,13(6):831-837.
[3]BACELAR-NICOLAU P,NICOLAU L B,MARQUES J C,et a1.Bacterioplankton dynamics in the Mondego estuary(Portugal)[J].Acta Oecologica,2003,24(S1):67-75.
[4]LI Yun,LI Dao-ji.Correlation between the distribution of bacterioplankton and the environmental factors in the Yangtze River Estuary and its adjacent seas[J].Marine Science Bulletin,2007,26(6):9-18.
李云,李道季.长江口邻近海域浮游细菌分布与环境因子的关系[J].海洋通报,2007,26(6):9-18.
[5]KUSHNER D J.Growth and nutrition of halophilic bacteria[M]//VREELAND R H,HOCHSTEIN L I.The biology of halophilic bacteria.Boca Raton,FL:CRC Press,1993:87-103.
[6]VENTOSA A,NIETO J J,OREN A.Biology of moderately halophilic aerobic bacteria[J].Microbiology and Molecular Biology Reviews,1998,62(2):504-544.
[7]SONG Zhi-gang,XU Qiang-zhi,LU Xin-an,et al.A primary study on population biodiversity of marine microorganisms from East China Sea[J].Microbiology China,2006,33(1):63-67.
宋志刚,许强芝,鲁心安,等,中国东海海洋微生物多样性初步研究[J].微生物学通报,2006,33(1):63-67.
[8]LI He-yang,CHEN Ming-xia,JIAO Nian-zhi.The community composition of bacterioplankton at typical station in the Changjiang Estuary[J].Acta Oceanologica Sinica,2012,34(1):183-187.
李和阳,陈明霞,焦念志.长江口典型站位浮游细菌类群的组成特征研究[J].海洋学报,2012,34(1):183-187.
[9]SEKIGUCHI H,KOSHIKAWA H,HIROKI M,et a1.Bacterial distribution and phylogenetic diversity in the Changjiang estuary before the construction[J].Microbial Ecology,2002,43(1):82-91.
[10]ZOBELL C E.Studies on marine bacteria.I:The cultural requirements of heterotrophic aerobes[J].Journal of Marine Research,1941,4:42-75.
[11]UPHOFF H U,FELSKE A,FEHR W,et al.The microbial di-versity in picoplankton enrichment cultures:A molecular screening of marine isolates[J].FEMS Microbiology Ecology,2001,35(3):249-258.
[12]RAVENSCHLAG K,SAHM K,PERNTHALER J,et a1.High bacterial diversity in permanently cold marine sediments[J].Applied and Environmental Microbiology,1999,65(9):3 982-3 989.
[13]XU Xue-wei,WU Yue-hong,WANG Chun-sheng,et al.Marinobacter pelagius sp.nov.,a moderately halophilic bacterium[J].International Journal of Systematic and Evolutionary,2008,58(3):637-640.
[14]CAI Wen-wei,WANG Hui,TIAN Yun,et al.Influence of a bacteriophage on the population dynamics of toxic dinoflagellates by lysis of algicidal bacteria[J].Applied and Environmental Microbiology,2011,77(21):7 837-7 840.
[15]ZHENG Tian-ling,YANG Xiao-ru,SU Jian-qiang,et al.Compound with high algae removal activity and preparation method thereof:China,CN101935320A[P].2011-01-05.
郑天凌,杨小茹,苏建强,等.一种强杀藻活性化合物及其制备方法:中国,CN101935320A[P].2011-01-05.
