四氯化碳联合高脂饮食对肝硬化家兔动脉粥样硬化的影响*
2014-05-25魏国华蔡晓波徐正婕范建高
魏国华,蔡晓波,徐正婕,范建高
·肝硬化·
四氯化碳联合高脂饮食对肝硬化家兔动脉粥样硬化的影响*
魏国华,蔡晓波,徐正婕,范建高
目的在动物实验观察肝硬化对高脂饮食诱导的动脉硬化的影响。方法40只雄性新西兰大白兔被分为对照组(n=6)、高脂组(n=8)、四氯化碳(CCl4)组(n=12)和高脂联合CCl4组(n=14),采用CCl4诱导肝硬化,观察高脂饮食诱导脂肪性肝损伤及动脉硬化,在10周末处死动物,比较血清转氨酶、血脂、空腹血糖以及肝脏和升主动脉形态学变化。结果高脂饮食组和复合模型组动物均成功复制出动脉硬化和脂肪性肝损伤模型;CCl4组动物血清ALT(87.42±57.92)IU/L和AST(137.33±114.54)IU/L均显著高于对照组[(21.33±17.76)U/L和(63.67±29.06)IU/L,P<0.05],伴明显的肝脏脂肪变、炎症及纤维化,而动脉内膜/中膜(I/M)比值及内-中膜厚度(IMT)无显著改变;与对照组比,高脂组和复合模型组动物血清转氨酶、血脂和血糖水平均显著升高(P<0.05),肝脏脂肪变、炎症及纤维化程度明显,并且I/M比值及IMT显著升高;与高脂组比,复合模型组血清ALT[(169.63±88.08)IU/L 对(51.00±46.23)IU/L,P<0.05)]和肝纤维化半定量计分[(8.80±4.87)对(5.71±3.15),P<0.05)]升高,而I/M比值则显著降低[(0.52±0.23)对(1.13±0.32),P<0.01],但IMT仅略有下降[(226.01±51.38)μm 对(256.60±54.27)μm,P>0.05]。结论CCl4与高脂饮食联合作用将加重家兔肝脏炎症损伤程度,但动脉硬化程度较单纯高脂饮食干预反而有所减轻。
非酒精性脂肪性肝炎;肝硬化;动脉粥样硬化;四氯化碳
1 材料与方法
1.1 动物模型的建立雄性新西兰大白兔40只,体质量(2.0±0.1)千克,购自上海斯莱克实验动物有限责任公司。实验动物自由饮水和进食,单只分笼饲养于标准级动物房内。适应性饲养1 w后,随机分为正常对照组(n=6)、高脂饮食组(n=8)、CCl4组(n=12)和复合模型组(n=14)。正常对照组和CCl4组动物以标准饲料喂养;高脂饮食组和复合模型组以含2%胆固醇(国药集团化学试剂有限公司)、6%猪油和92%标准饲料的高脂饲料喂养。CCl4组和复合模型组在高脂饮食的基础上,给予腹腔注射CCl4溶液(玉米油配制)0.1ml.kg-1,1次/w。在前5周,CCl4溶液的质量浓度(体积比)为5%,后5周为10%。所有动物于实验10 w末禁食不禁水,常规称量体质量,以3%戊巴比妥钠30 mg.kg-1经耳缘静脉注射麻醉,腹主动脉取血,室温下静置30 min,4℃,3000 r/m 离心15 min,取血清,于-20℃冰箱保存待测;完整摘除肝脏并称质量,取升主动脉至主动脉弓分支开口处血管。取一小块肝脏及约0.5 cm长的升主动脉,置10%福尔马林溶液中固定,常规脱水包埋,切片。脂肪肝的诊断参照中华医学会2010年修订的非酒精性脂肪性肝病诊疗指南[8]。采用Masson三色法染色,肝纤维化评分采用中华医学会肝病分会肝纤维化学组2002年制定的《肝纤维化诊断及疗效评估共识》[9]。应用HPIAS-1000P病理学彩色高清图文报告分析系统,在血管全长的每个五等分点处测量新生内膜(内皮到内弹力板)与中膜(内外弹力板之间)的厚度,计算内膜/中膜比值。
1.2 检测采用速率法检测血清ALT和AST水平(上海申能-德赛诊断技术有限公司);采用酶比色法检测总胆固醇(TC);采用甘油磷酸氧化酶法检测甘油三酯(TG);采用终点比色法检测高密度脂蛋白(HDL)和低密度脂蛋白(LDL,上海罗氏公司);采用葡萄糖氧化酶法检测空腹血糖(FBG,上海科东-东菱诊断用品有限公司),以上检测均在全自动生化分析仪上完成。计算肝指数[肝指数=(肝脏湿质量/体质量)×100]。1.3 统计学处理计量资料以(±s)表示,组间比较采用t检验,等级资料采用秩和检验,应用SPSS12.0软件包完成。P<0.05为差异具有统计学意义。
2 结果
2.1 一般情况在实验过程中,新西兰大白兔生长良好,高脂饮食动物进食较少,每日给以少量白菜叶以保证其存活。6只复合模型组动物死亡,8只CCl4注射组动物出现不同程度的腹水、胸水和心包积液。与正常对照组比,复合模型组动物肝脏湿质量显著升高;复合模型组与高脂饮食组比,体质量、肝脏湿质量和肝指数均无显著性差异;复合模型组与CCl4组比,肝脏湿质量和肝指数均显著升高;CCl4组与高脂饮食组动物之间肝脏湿质量和肝指数差异显著(表1)。
表1 各组兔体质量、肝脏湿质量和肝指数(±s)的比较
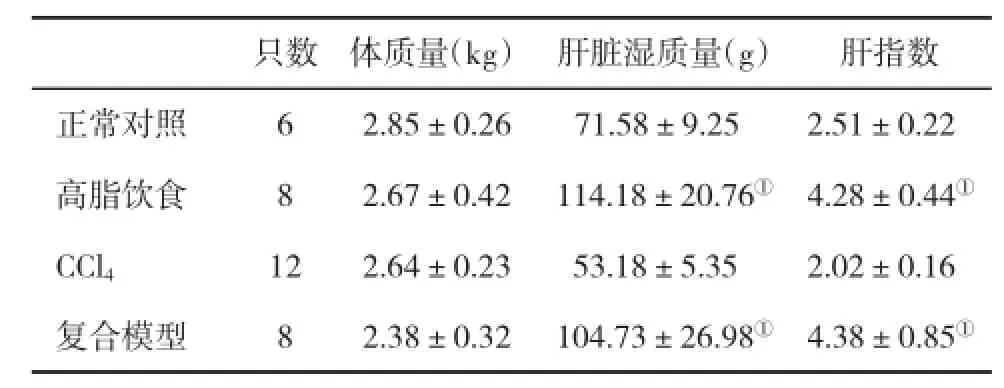
表1 各组兔体质量、肝脏湿质量和肝指数(±s)的比较
与正常对照组和CCl4组比,①P<0.05
只数体质量(kg)肝脏湿质量(g)肝指数正常对照62.85±0.2671.58±9.252.51±0.22高脂饮食82.67±0.42114.18±20.76①4.28±0.44①CCl4122.64±0.2353.18±5.352.02±0.16复合模型82.38±0.32104.73±26.98①4.38±0.85①
2.2 血生化指标的变化高脂饮食动物血清呈乳白色浑浊状。与正常对照组比,高脂饮食组和复合模型组动物血脂、血糖、转氨酶水平均显著升高;CCl4组血脂和转氨酶水平显著升高;复合模型组与高脂饮食组动物之间仅血清ALT水平有明显差异;高脂饮食组与CCl4组动物之间血清TC、TG、HDL、FBG水平有显著性差异(表2)。
表2 各组兔血脂、转氨酶和血糖水平(±s)的比较
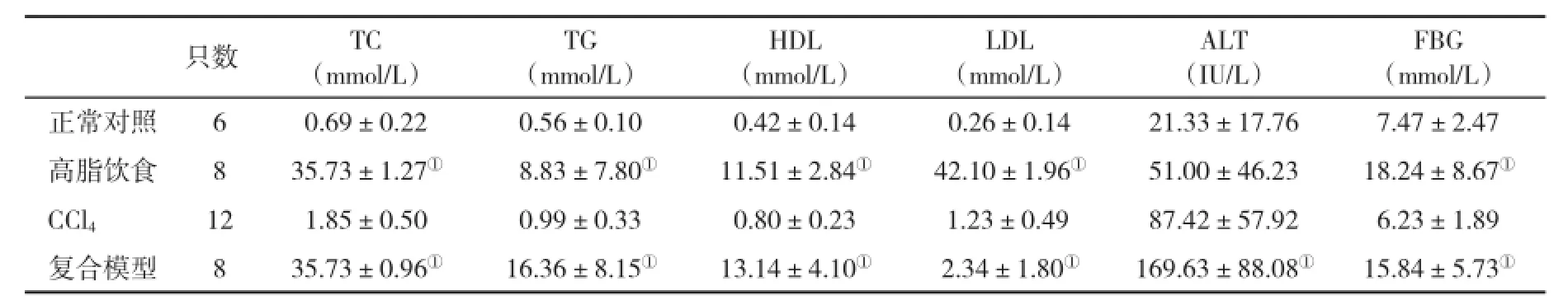
表2 各组兔血脂、转氨酶和血糖水平(±s)的比较
与正常对照组和CCl4组比,①P<0.05
FBG(mmol/L)正常对照60.69±0.220.56±0.100.42±0.140.26±0.1421.33±17.767.47±2.47高脂饮食835.73±1.27①8.83±7.80①11.51±2.84①42.10±1.96①51.00±46.2318.24±8.67①CCl4121.85±0.500.99±0.330.80±0.231.23±0.4987.42±57.926.23±1.89复合模型835.73±0.96①16.36±8.15①13.14±4.10①2.34±1.80①169.63±88.08①15.84±5.73①只数TC(mmol/L)TG(mmol/L)HDL(mmol/L)LDL(mmol/L)ALT(IU/L)
2.3 肝组织病理学变化高脂饮食组和复合模型组动物肝脏体积增大,边缘圆钝,整个肝脏呈奶黄色,并见局灶性黄白色变性灶,切面油腻;CCl4组肝脏呈灰白色,无光泽,被膜肿胀,质地稍硬。在光镜下,高脂饮食组和复合模型组均出现弥漫性泡沫状肝细胞脂肪变,肝窦狭窄;CCl4组肝细胞胞浆疏松,脂肪变明显呈大泡性改变;复合模型组和高脂饮食组肝细胞脂肪变程度显著重于正常对照组和CCl4组(表3);各个造模组动物肝脏均可见小叶内及汇管区炎症,炎症细胞浸润以单核细胞和淋巴细胞为主。CCl4组、高脂饮食组和复合模型组肝脏炎症程度均显著加重,肝组织炎症活动度计分(histological activity index,HAI)显著升高(图1)。复合模型组除有弥漫性肝纤维化外,肝组织出现假小叶。CCl4组、高脂饮食组、复合模型组肝脏纤维化评分显著高于正常对照组(图2,表4)。
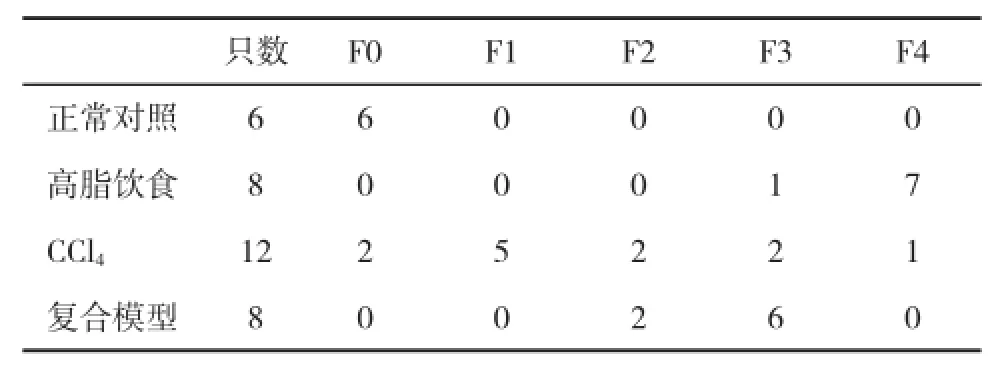
表3 各组兔肝脏脂肪变性程度比较
表4 兔肝组织HAI和纤维化半定量计分(±s)的比较
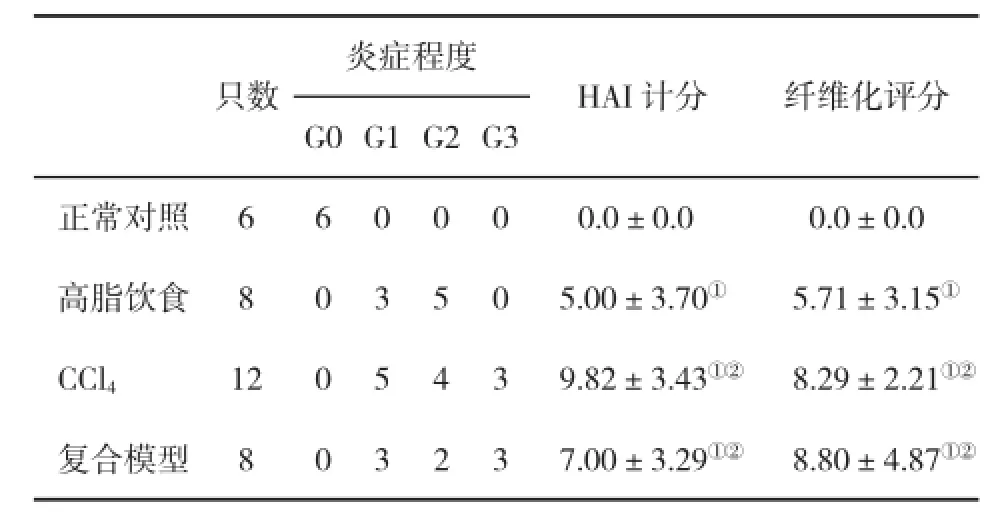
表4 兔肝组织HAI和纤维化半定量计分(±s)的比较
与正常对照组比,①P<0.05;与高脂饮食组比,②P<0.05
炎症程度HAI计分纤维化评分G0 G1 G2 G3正常对照660000.0±0.00.0±0.0高脂饮食803505.00±3.70①5.71±3.15①CCl41205439.82±3.43①②8.29±2.21①②复合模型803237.00±3.29①②8.80±4.87①②只数
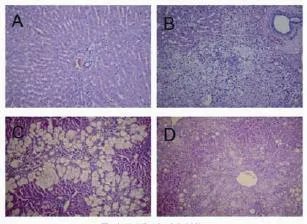
图1 兔肝组织脂肪变及炎症反应情况(HE)A:为正常对照组(200×);B:高脂饮食组(200×);C:CCl4组(100×);D:复合模型组(100×)
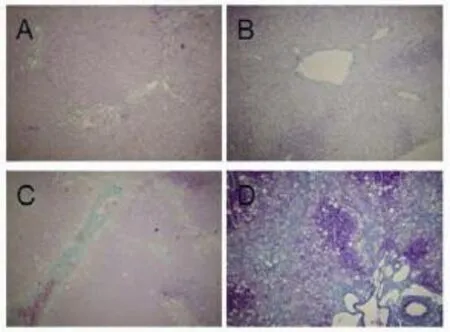
图2 兔肝组织纤维化表现(Masson,100×)A:正常对照组;B:高脂饮食组;C:CCl4组;D:复合模型组
2.4 动脉病理学变化高脂饮食组和复合模型组动物动脉内膜明显增厚,新生内膜内细胞核呈小而圆形,处于增殖状态,且有大量的泡沫细胞形成(图3);高脂组和复合模型组动物内膜/中膜比值显著高于正常对照组,内-中膜厚度(IMT)也明显增厚(表5)。
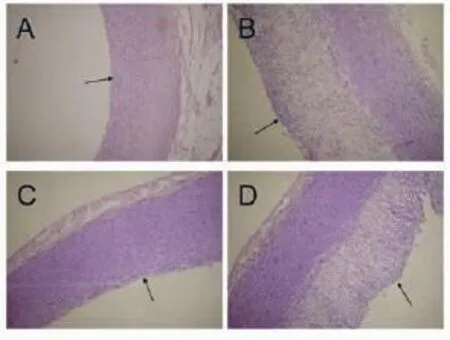
图3 兔升主动脉粥样硬化表现(HE,100×)A:正常对照组;B:高脂饮食组;C:CCl4组;D:复合模型组箭头所指为内膜。高脂组和复合模型组动物血管内膜明显增厚
表5 各组兔升主动脉指标(±s)的比较
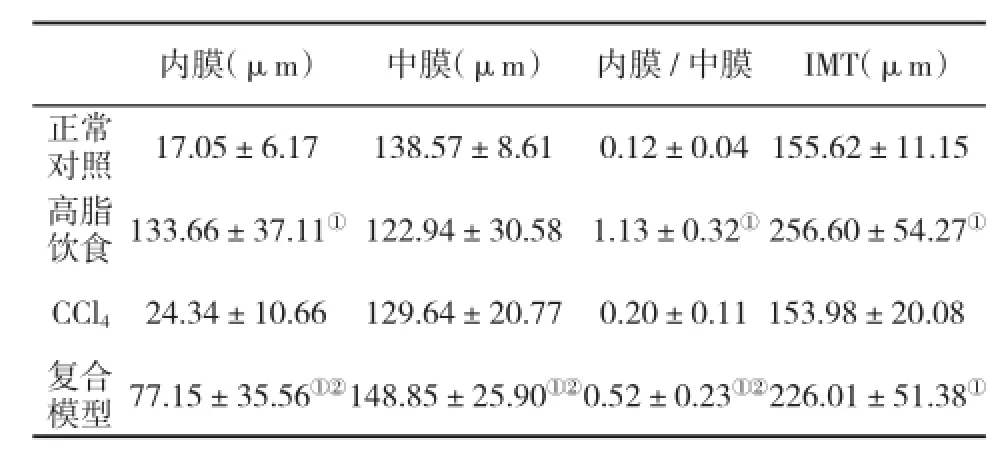
表5 各组兔升主动脉指标(±s)的比较
与正常对照组和CCl4组比,①P<0.05;与高脂饮食组比,②P<0.05
内膜(μm)中膜(μm)内膜/中膜IMT(μm)正常对照17.05±6.17138.57±8.610.12±0.04 155.62±11.15高脂饮食133.66±37.11①122.94±30.581.13±0.32①256.60±54.27①CCl424.34±10.66129.64±20.770.20±0.11 153.98±20.08复合模型77.15±35.56①②148.85±25.90①②0.52±0.23①②226.01±51.38①
3 讨论
在西方国家,NAFLD是最常见的肝脏疾病,其发病率为20%~33%。在中国发达地区,大规模调查研究显示,NAFLD患病率为15%~30%。随着肥胖、2型糖尿病、代谢综合征(Metabolic syndrome,MS)发病率的不断升高,NAFLD患病率也呈显著上升趋势[3,10]。近年来,关于NAFLD患者心血管疾病(cardiovascular disease,CVD)发病率的报道有所增多,发现NAFLD与亚临床As的相关性独立于肥胖和MS等传统的危险因素[10~12]。NAFLD被视为MS累及肝脏的病理学表现,与CVD发生的高风险相关。
当NAFLD发展至肝硬化阶段时,其CVD发生率较低。在临床上,肝硬化患者脂质紊乱以及糖耐量降低(impaired glucose tolerance,IGT)和肝源性糖尿病的发生率虽较高[13],而高血压及缺血性心脏病的发生率却较低[14,15],可能部分与营养不良、内脏脂肪组织含量减少以及血小板数量减少等因素有关。尽管动脉硬化和肝硬化的发病同样与年龄或病程密切相关,老年肝硬化患者糖代谢异常发生率很高(60%~80%伴有糖耐量异常,10%~15%伴有糖尿病)[15],然而其高血压病、缺血性心脏病以及动脉硬化性脑血管疾病的发生率却很低[14~16]。更重要的是,尸体解剖病理学检查发现肝硬化患者大血管和冠状动脉硬化改变的程度较无肝硬化患者程度明显减轻[17]。此外,伴有肝硬化的糖尿病患者微血管病也较少见[15]。Tamura et al[18]研究也显示糖尿病患者如合并乙型或丙型肝炎肝硬化,则可抑制其As的发生和发展,血小板及纤维蛋白原水平降低与此现象可能亦有一定的关系。目前,对于NAFLD与As的研究多见于临床,因为组织学标本难以获得,有关其发病机制的探讨无法深入,动物实验则可克服此缺点,有关这方面的动物实验研究仍鲜有报道。
我们的实验通过单纯高脂饮食同时复制As和脂肪性肝病模型。加用CCl4的目的是观察在肝脏损伤加重时,As的程度是否有变化。实验结果显示脂肪性肝硬化动物As程度反而改善,这说明肝脏损伤加重对As可能有保护作用,也与营养状况变差有关。另外,尽管CCl4组和复合模型组动物血脂水平较正常对照组显著升高,CCl4组动脉IMT与正常对照组相比并无显著性差异;复合模型组动脉IMT较高脂饮食组略有下降,内/中膜厚度比值显著下降,说明当脂肪肝发展到肝硬化阶段时,尽管存在As发展的危险因素,但因并存营养不良等因素致使As程度有所减轻。
此外,本实验显示在14只复合模型组动物中,6只在造模过程中死亡,在剩下的8只中有6只出现不同程度的多浆膜腔积液,提示当发生肝硬化时,其肝病相关并发症发生率升高,肝脏相关死亡为其主要结局,而此时动脉粥样硬化及其相关并发症可能并不重要。
我们认为肝硬化时尽管存在As发展的重要危险因素,如高脂饮食和脂肪性肝炎,但因为并存抑制动脉硬化的相关因素以及促进动脉硬化的因素作用减弱,其净效应为As的发生和发展受阻。非酒精性脂肪肝与动脉粥样硬化的关系取决于多种因素,在不同的疾病状态下可呈现出不同的结局。
[1]Targher G,Byrne CD.Diagnosis and management of nonalcoholicfattyliverdiseaseanditshemostatic/thrombotic and vascular complications.Semin Thromb Hemost,2013,39(2):214-228.
[2]Targher G,Day CP,Bonora E.Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease.N Engl J Med,2010,363(14):1341-1350.
[3]Fan JG.Epidemiology of alcoholic and nonalcoholic fatty liver disease in China.J Gastroenterol Hepatol,2013,28(Suppl 1):11-17.
[4]Hyogo H,Chayama K,Yamagishi SI.Nonalcoholic fatty liver disease and cardiovascular disease.Curr Pharm Des,2013 Jun 20.[Epub ahead of print]
[5]Lonardo A,Sookoian S,Chonchol M,et al.Cardiovascular and systemicriskinnonalcoholicfattyliverdiseaseatherosclerosis as a major player in the natural course of NAFLD.Curr Pharm Des,2013,19(29):5177-5192.
[6]胡晓峰,刘斌,张敏,等.家兔肝纤维化模型的建立及肝功能指标与肝纤维化的相关性.实用肝脏病杂志,2007,10(3): 152-154.
[7]Penteado FC,Ferreira HH,Calafatti SC,et al.Neutrophil migrationduringlivercirrhosisinrabbits.ClinExp Pharmacol Physiol,2002,29(4):285-290.
[8]王晓颖,王立峰.非酒精性脂肪性肝炎的病理学诊断.实用肝脏病杂志,2013,16(6):486-489.
[9]中华肝脏病学会肝纤维化学组.肝纤维化诊断及疗效评估共识.中华肝脏病杂志,2002,10(5):327-328.
[10]王军,魏艳玲,范丽玲,等.非酒精性脂肪性肝病与心血管疾病的相关性分析.实用肝脏病杂志,2013,16(6): 499-501.
[11]Oni ET,Agatston AS,Blaha MJ,et al.A systematic review: Burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver;Should we care?Atherosclerosis,2013,230(2):258-267.
[12]Kim KS,Oh HJ,Kim DJ,et al.The association between non-alcoholic fatty liver disease and carotid atherosclerosis insubjectswithwithin-referencerangealanine aminotransferaselevels.EndocrJ,2013Sep18.[Epub ahead of print].
[13]Petrides AS,DeFronzo RA.Glucose and insulin metabolism in cirrhosis.J Hepatol,1989,8(1):107-114.
[14]Loyke HF.The relationship of cirrhosis of the liver to hypertension:a study of 504 cases of cirrhosis of the liver. Am J Med Sci,1955,230(6):627-632.
[15]Marchesini G,Ronchi M,Forlani G,et al.Cardiovascular disease in cirrhosis-a point-prevalence study in relation to glucose tolerance.Am J Gastroenterol,1999,94(3):655-662.
[16]Holstein A,Hinze S,Thiessen E,et al.Clinical implications of hepatogenous diabetes in liver cirrhosis.J Gastroenterol Hepatol,2002,17(6):677-681.
[17]Creed DL,Baird WF,Fisher ER.The severity of aortic arteriosclerosis in certain diseases:a necropsy study.Am J Med Sci,1955,230(4):385-391.
[18]TamuraM,KiharaY,OtsukiM.Carotidintima-media thickness in patients with liver cirrhosis associated with diabetesmellitus.DiabetesResClinPract,2007,78(2): 176-181.
(收稿:2014-01-22)
(校对:陈从新)
Impact of carbon tetrachloride induced cirrhosis on high-fat diet related atherosclerosis in rabbits
Wei Guohua,Cai Xiaobo,Xu Zhenjie,et al.Department of Gastroenterology,People’s Hospital,Putuo District,Shanghai 200060,China
Objective To investigate the effect of cirrhosis on the development of atherosclerosis in vivo. Methods Normal male New Zealand white rabbits(n=40)were randomly divided into four groups,e.g. control(n=12),high-fat (n=8),carbon tetrachloride (CCl4)(n=12)and combined treatment group (n=14);Liver cirrhosis was induced by CCl4 injection and atherosclerosis by high fat diet(92% normal rabbit chow with 2% cholesterol and 6% lard)intake;Rabbits were sacrificed at the end of week 10 and serum aminotransferase,lipid,and fasting plasma glucose were examined and morphology changes in ascending aortas and livers were observed. Results Atherosclerosis was successfully induced by high-fat diet intake both in high-fat group and in combinational treatment group,while steatohepatitis-related cirrhosis was induced by CCl4administration and high fat diet intake in both groups;As compared with in control group,serum ALT and AST in CCl4group were increased significantly [(87.42±57.92)IU/L and (137.33±114.54)IU/L vs. (21.33±17.76)U/L and (63.67±29.06)IU/L,P<0.05],and significant liver steatosis,inflammation and fibrosis were also observed in CCl4-treated rabbits,but atherosclerosis were not found in ascending aortas;Serum aminotransferase,lipid and fasting plasma glucose in animals of high lipid diet were significantly higher than those in the controls(P<0.05),in addition,significant liver steatosis,inflammation and fibrosis,and typical atherosclerosis plaques in ascending aortas were also observed in animals with high-fat diet intake;There were significant differences in serum alanine aminotransferase and intima-to-media (I/M)ratio of ascending aortas,but not in intima-media thickness(IMT)between the high fat group and the combinational treatment group. Conclusions A combination of high fat diet and CCl4aggravates liver inflammation but attenuates atherosclerosis induced by high fat diet in rabbits.
Nonalcoholic steatohepatitis;Cirrhosis;Atherosclerosis;Carbon tetrachloride随着人们生活水平的提高以及生活方式的西化,与糖脂代谢紊乱密切相关的非酒精性脂肪性肝病(nonalcholic fatty liver disease,NAFLD)患病率不断上升[1~3]。NAFLD的发展过程可出现肝纤维化,最终可发展为肝硬化。临床上,动脉粥样硬化(atherosclerosis,As)及其相关的心脑血管事件对NAFLD长期预后的影响远远超过肝硬化[4,5]。然而,当NAFLD发展至肝硬化阶段时,其心脑血管事件的发生率却较低。NAFLD与As之间的确切关系及其机制尚未完全阐明。为此,本文参考相关文献[6,7],用高脂饮食和四氯化碳(carbon tetrachloride,CCl4)注射建立脂肪性肝硬化合并As模型,旨在探讨肝硬化对As发生和发展的影响。
10.3969/j.issn.1672-5069.2014.03.013
国家重点基础研究发展计划973项目(2012CB517501);国家自然科学基金项目(81070322/81270491);上海市科学技术委员会科研基金项目(09140903500/10411956300);上海市卫生局新百人计划项目(XBR2011007)
200060 上海市普陀区人民医院消化内科(魏国华);上海交通大学附属第一人民医院消化内科(蔡晓波);上海交通大学医学院附属新华医院消化内科(徐正婕,范建高)
魏国华,女,33岁,医学硕士,主治医师。研究方向为脂肪肝与动脉硬化。E-mail:weiweidark@hotmail.com
范建高,E-mail:fanjiangao@gmail.com
