妊娠晚期应用替比夫定阻断乙型肝炎病毒宫内感染疗效和安全性的系统评价*
2014-05-25陈君孙晓风邓泽润张跃新周莹丽刘浩
陈君,孙晓风,邓泽润,张跃新,周莹丽,刘浩
妊娠晚期应用替比夫定阻断乙型肝炎病毒宫内感染疗效和安全性的系统评价*
陈君,孙晓风,邓泽润,张跃新,周莹丽,刘浩
目的探讨在妊娠晚期应用替比夫定阻断乙型肝炎病毒母婴传播的临床疗效和安全性。方法应用计算机检索中国生物医学文献数据库、万方医学数据库、中文科技期刊数据库、中国知网、PubMed、ISI web of knowledge、EMbase、Cochrane Library、BIOSIS Previews等数据库,截止日期为2013年9月。参照纳入和排除标准进行文献筛选,采用RevMan5.1软件进行Meta分析。结果纳入文献11篇,共1241例孕妇,其中应用替比夫定602例,对照组639例;Meta分析结果显示,随访6~12月龄婴儿,替比夫定组HBsAg和HBV DNA阳性率均低于对照组,差异有统计学意义[RR=0.15,95%CI(0.08,0.28),P<0.00001;RR=0.12,95%CI(0.05,0.32),P<0.0001];替比夫定组孕妇分娩前HBV DNA水平低于对照组,差异有统计学意义[MD=-3.86,95%CI(-4.55,-3.16),P<0.00001];替比夫定组肌酸激酶升高率高于对照组,差异有统计学意义[MD=-3.86,95%CI(-4.55,-3.16),P<0.00001],应用替比夫定孕妇所产新生儿无畸形等并发症发生。结论替比夫定能阻断HBV宫内感染,其应用安全、有效。
乙型肝炎;替比夫定;宫内感染;孕妇;Meta分析
慢性乙型肝炎(Chronic hepatitis B,CHB)是由乙型肝炎病毒(Hepatitis B virus,HBV)引起的慢性肝炎,我国为高发区[1]。约40%~50%HBV感染者由母婴传播引起,所以阻断HBV母婴传播是预防HBV传播的关键[2,3]。尽管采用乙型肝炎免疫球蛋白(Hepatitis B immune globulin,HBIG)和乙肝疫苗(Hepatitis B vacine,HBVac)
联合免疫方法可阻断HBV母婴传播,但失败率仍达10 %~15 %[4]。失败的主要原因是宫内感染。研究发现血清HBV DNA水平是宫内感染的独立危险因素,宫内感染率与孕妇HBV DNA水平呈正相关[5]。因此,降低孕期HBV DNA水平可有效降低母婴传播率。欧洲肝病学会指南肯定了替比夫定等核苷(酸)类药物在妊娠期应用的安全性,我国指南亦有此共识[6,7]。替比夫定是美国食品和药品管理局(FDA)批准上市的妊娠安全分类达到B级的用于治疗成人慢性乙型肝炎的核苷类似物。目前对于替比夫定阻断孕妇HBV垂直传播疗效及安全性的循证医学证据较少。本研究旨在系统评价目前已发表的随机和非随机对照研究,评估替比夫定阻断HBV母婴传播的效果和对母亲及新生儿的安全性,为进一步降低HBV母婴传播的方法提供循证医学证据。
1 资料与方法
1.1 检索策略检索中国生物医学文献数据库、万方医学数据库、中国知网、中文科技期刊数据库、PubMed、ISI web of knowledge、EMbase、Cochrane Library和BIOSIS Previews等数据库。由于已发表的文献有限,我们扩大了搜索,将非随机对照研究也包含在内。检索词包括乙型肝炎病毒、替比夫定、宫内感染、垂直传播、Hepatitis B virus、HBV、Telbivudine、beta-L-2'-deoxythymidine、Tyzeka、vertical transmission、perinatal transmission、intrauterine infection等,并对检索到的文献作进一步的参考文献追溯。最后检索日期为2013年9月。纳入标准:(1)研究类型为随机或非随机对照试验;(2)研究对象为HBV携带者或CHB孕妇及其所产婴儿;(3)干预措施:在孕20~32周给予替比夫定600 mg/d抗病毒治疗,对照组未接受任何抗病毒治疗。所有新生儿进行HBIG和HBVac主、被动联合免疫;(4)未使用其他的抗病毒药物、免疫抑制剂、细胞毒性药物及皮质激素类药物。排除标准:(1)描述性研究;(2)研究样本量<20例;(3)重复报道、无对照组的病例报告;(4)孕期应用HBIG或其他抗病毒药物的研究;(5)孕期合并甲、丙、丁型肝炎、HIV、梅毒、弓形虫、风疹病毒、巨细胞病毒、单纯疱疹病毒等感染;(6)使用抗病毒药物前B超检查提示胎儿发育畸形。疗效判定指标:(1)主要指标为两组新生儿和随访6~12个月龄婴儿HBV感染率;(2)次要指标包括两组孕妇治疗前及分娩前血清HBV DNA水平的比较。母亲和婴儿不良反应发生率:有无血清肌酸激酶(Creatine kinase,CK)和丙氨酸氨基转移酶(Aminotransferase,ALT)升高、产后大出血等妊娠和分娩期间的并发症以及新生儿发育指标如体质量、身高和1分钟Apgar 评分、有无畸形、血液生化异常等。
1.2 纳入研究的质量评价采用Jadad质量评分法评价纳入研究的文献质量(1~2分为低质量研究,3~5分为高质量研究),评价内容包括随机分组情况、分配隐藏、盲法、退出或失访人数及原因分析等。
1.3 资料提取和分析提取的数据包括受试者临床特征,研究的设计方法,纳入和排除标准,用药时间和剂量,主要和次要指标、并发症、不良反应。由两名不同专业的研究者按照上述文献纳入和排除标准独立进行文献筛选。当遇分歧时,通过讨论解决。对原始文献记录数据的收集也由不同专业的两名评阅人独立收集数据资料。
1.4 统计学方法采用Cochrane Library专用软件RevMan 5.1版进行Meta分析。对全部入选的文献数据采用x2检验和Ι2检验评价各研究间异质性。当P>0.1和I2≤50%时为研究间无统计学异质性,使用固定效应模型对各研究进行合并分析;反之,则提示存在异质性(P<0.1,或Ι2≥50%),则采用随机效应模型进行合并分析。对研究间存在明显的临床异质性,则采用描述性分析。计数资料采用危险度(RR)表示,对连续变量采用均数差(MD)表示,两者均以95%可信区间(CI)表示。采用亚组分析对随机对照研究和非随机对照研究的影响进行比较。采用漏斗形图(Funnel plot)分析发表偏倚。对因纳入研究的方法学不一致而导致的明显统计学异质性时,则去除低质量研究进行敏感性分析。由于我们收录的是已发表的数据,本研究并未经特别的伦理委员会批准。
2 结果
2.1 纳入文献的基本情况共检索到176篇文献,其中160篇文献因为回顾性研究、描述性研究、无对照组、两组受试对象的基线水平无可比性、对同一数据资料重复发表、研究目的不明而被排除。5篇文献由于样本量太少或孕期同时应用HBIG而被排除。最终11篇文献符合入选条件而被纳人本研究,其中中文文献10篇,英文文献1篇,研究地均在中国。4项研究[8~11]为随机对照试验,7项研究[12~18]为非随机对照试验。所有研究均未实施盲法,4项随机对照研究虽提到随机但未描述具体方法及隐藏方案。4篇文献[8~11]Jadad评分为2分,其余纳入文献质量均为1分。所有纳入研究的文献均为应用替比夫定(600 mg/d)与对照组的比较。其中,替比夫定组妇女602例,对照组639例。所有新生儿出生后均接受主/被动联合免疫。Han et al[16]的研究是从孕20~32周开始应用替比夫定;张丽菊等[8]报道1例孕妇因肝功能异常于孕12周开始接受替比夫定(600 mg/d)治疗,其余文献报道均从孕28~32周开始给予替比夫定抗病毒治疗。Han et al[16]报道了失访人数,其余研究均无失访。
2.2 不同随访时间婴儿HBsAg阳性率比较有9篇文献报道了新生儿HBsAg阳性率情况。各组内差异无统计学异质性,采用固定效应模型进行分析,结果显示,替比夫定组HBsAg阳性率显著低于对照组[RR=0.49,95%CI(0.37,0.63),P<0.00001,表1]。有9篇文献报道了随访婴儿6~12月HBsAg阳性率情况,各组内差异无统计学异质性,采用固定效应模型进行分析(图1A),结果显示,替比夫定组HBsAg阳性率显著低于对照组[RR=0.15,95%CI(0.08,0.28),P<0.00001]。其漏斗图基本呈对称分布,提示纳入的文献无明显的发表偏倚(图1B)。
2.3 不同随访时间婴儿HBV DNA阳性率比较有6篇文献报道了新生儿HBV DNA阳性率情况,各组内差异无统计学异质性,采用固定效应模型进行合并分析,结果显示,对照组新生儿HBV DNA阳性率显著高于替比夫定组[RR=0.25,95%CI(0.15,0.43),P<0.00001]。由于纳入的6篇文献中仅1篇为随机对照研究,故对另5篇非随机对照研究进行合并分析(表1),结果显示,替比夫定组HBV DNA阳性率显著低于对照组[RR=0.21,95%CI(0.11,0.39),P<0.00001]。有5篇文献报道了随访婴儿6~12月HBV DNA阳性率情况,各组间差异无统计学异质性,采用固定效应模型分析(图2),结果显示,替比夫定组HBV DNA阳性率显著低于对照组[RR=0.12,95%CI(0.05,0.32),P<0.0001]。
2.4 孕妇HBV DNA水平变化有8篇文献报道了替比夫定治疗前和分娩前孕妇HBV DNA水平变化(表2)。治疗前各组孕妇HBV DNA水平差异无统计学异质性,采用固定效应模型分析,结果显示,替比夫定组和对照组HBV DNA水平差异有统计学意义[MD=0.12,95%CI(0.05,0.19),P=0.0008]。分娩前各组孕妇HBV DNA水平差异有统计学异质性,采用随机效应模型进行合并分析,结果表明替比夫定组和对照组HBV DNA水平差异有统计学意义[MD=-3.86,95%CI(-4.55,-3.16),P<0.00001,表1]。
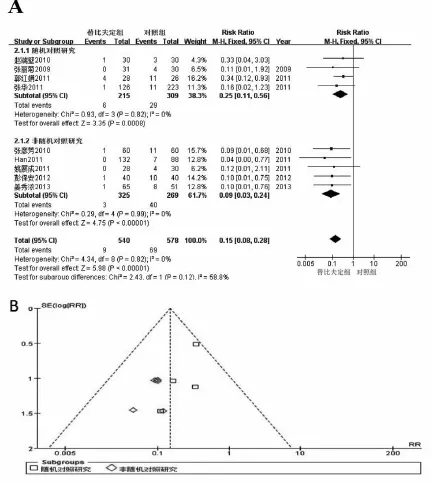
图1 两组HBsAg阳性率的比较A:替比夫定组和对照组6~12月龄婴儿HBsAg阳性率比较的森林图,提示替比夫定组HBsAg阳性率显著低于对照组;B: 纳入文献的漏斗图,提示纳入文献无明显的发表偏倚
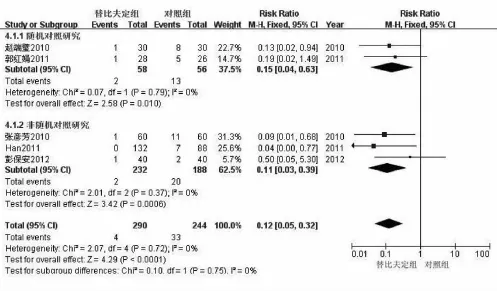
图2 两组6~12月龄婴儿HBV DNA阳性率比较的森林图,提示替比夫定组HBV DNA阳性率显著低于对照组
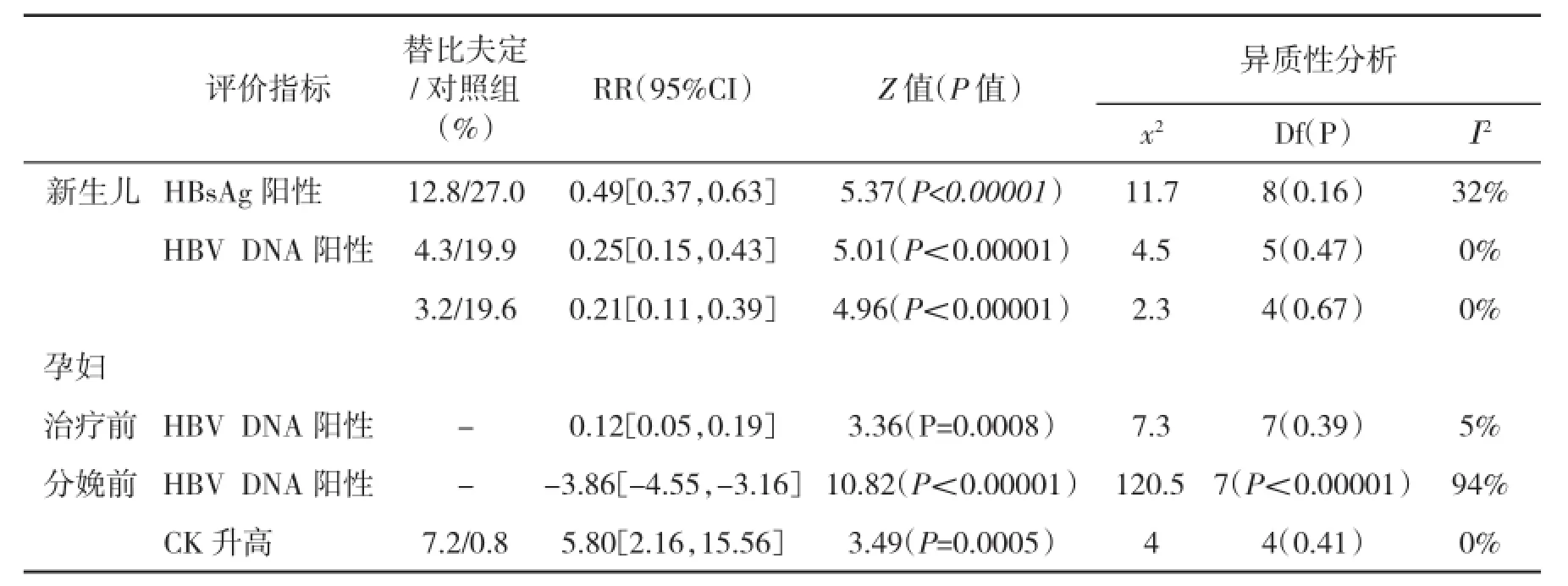
表1 两组新生儿和孕妇HBsAg阳性、HBV DNA水平及孕妇CK升高率的荟萃分析
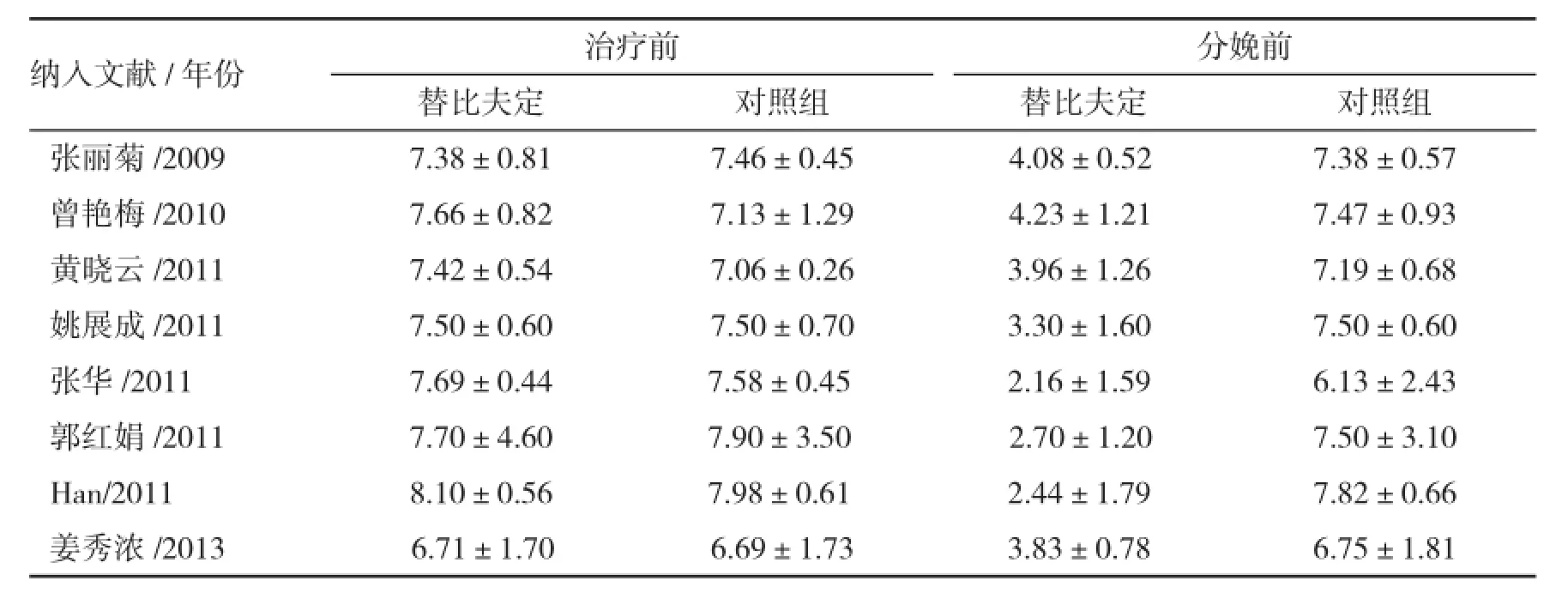
表2 替比夫定治疗前后孕妇HBV DNA水平((lg copies/ml))变化
2.5 安全性评价有5篇文献报道了孕妇血清CK升高率,各组间差异无统计学异质性,采用固定效应模型进行合并分析,结果显示替比夫定组血清CK升高率显著高于对照组[RR=5.8,95%CI(2.16,15.56),P=0.0005,表1]。仅有一篇文献[8]报道了新生儿血清CK升高率,替比夫定组为25.8%(8/31),对照组为30.0%(9/30)。Han et al[16]研究显示随访7个月时两组婴儿发生肺炎、巨细胞病毒感染和血管瘤等不良反应发生与口服替比夫定无明显的相关性。替比夫定组无胎儿窘迫、极低体重儿、死胎、新生儿畸形、产后出血等并发症发生。亦未报道肝肾功能衰竭和耐药发生。
3 讨论
新生儿感染HBV后大部分会发展为慢性肝炎,故阻断HBV母婴传播是防治我国慢性肝炎高发的当务之急[2]。HBV母婴垂直传播途径主要有以下三个方面,即宫内感染、产时感染、产后感染。其中最主要的感染途径为宫内感染。宫内感染发生的主要途径有血源性和细胞源性感染[19,20]。虽然采用HBIG和HBVac联合免疫方法非常有效地阻断了HBV母婴传播,但主要针对产时感染和产后感染,对已发生的宫内感染无阻断作用,特别是高HBV DNA水平的孕妇所生新生儿HBV感染率较低水平HBV DNA孕妇所生新生儿HBV感染率有显著差别,宫内感染率与孕妇HBV DNA水平呈正相关,因此降低孕妇分娩前HBV DNA水平可有效阻断HBV宫内传播[21,22]。当孕妇血清HBV DNA>1×108copies/ml时,即使采取联合免疫方法,宫内感染率仍可高达43%;而当孕妇血清病毒载量降至1×106copies /ml以下时,宫内感染将减少30%[23]。Xu et al研究发现最早可于孕19周左右发生宫内感染[19]。由于妊娠早期是器官成熟的重要时期,在孕早期应避免使用核苷类似物,建议在怀孕最后三个月开始口服核苷类似物以阻断宫内传播[24,25]。
目前有五种药物获得FDA批准用于治疗HBV感染患者,即干扰素、拉米夫定、阿德福韦、恩替卡韦和替比夫定。针对怀孕期间使用药物,一般可分为5个类别,即A、B、C、D、X。目前仍无经过FDA批准的A类可用于孕期抗HBV药物。拉米夫定属于C类药物,多项研究表明拉米夫定可有效阻断母婴传播,且对母亲及新生儿无明显的毒副作用[26,27]。随着安全性数据不断增加,美国国立卫生研究院(NIH)已将拉米夫定升为妊娠B级药物,但研究表明,与替比夫定比,拉米夫定易出现早期耐药突变[28],且拉米夫定对孕妇、胎儿以及婴儿的安全性问题仍缺乏长期、大样本的观察。妊娠药物安全分类为B级的替比夫定是新型左旋核苷酸类药物,可高度特异性抑制HBV复制,避免正常细胞损害,这种高水平的特异性识别使替比夫定具有良好的安全性[29]。毒理学研究表明替比夫定无致癌性、致畸性、致突变性及无线粒体毒性[30]。因为替比夫定可经乳汁排泄,有专家建议用药期间不提倡母乳喂养[31,32],但乳汁中HBV DNA含量较少,我国发布的指南建议经正规主被动联合免疫预防后,不管孕妇HBeAg阳性与否、乳汁中有无HBV DNA,其新生儿均可接受母乳喂养[33]。
目前对宫内感染的诊断标准尚未统一。本研究采用检测6~12月龄婴儿血清HBsAg或HBV DNA作为宫内感染的评价标准。由于本研究纳入文献中含非随机对照研究,采用亚组分析后新生儿及随访6~12月婴儿,结果提示替比夫定预防组HBsAg和HBV DNA阳性率均显著低于对照组,故替比夫定可有效阻断HBV母婴传播的发生。分娩前孕妇HBV DNA水平低于对照组。因此,替比夫定可有效降低孕妇HBV DNA水平,减少宫内感染的发生。
在本研究中,有4篇文献[11,15,16,18]报道了孕妇治疗前、分娩前血清ALT水平变化。有研究指出HBV感染孕期肝功能异常并不增加HBV母婴传播的风险[5,34]。分娩后多数孕妇肝功能恢复正常。纳入文献中仅一篇文献[18]报道了分娩后7个月母亲血清ALT水平,但未具体说明替比夫定组孕妇的停药时间,其余研究均未对停药后母亲血清ALT水平进行随访监测。替比夫定组血清CK升高率高于对照组,考虑与纳入文献样本量偏小有关,所纳入文献中无因血清CK升高或肌肉酸痛等发生减药或停药等情况发生,且有研究表明,替比夫定在孕早期使用也是安全有效的[35]。
本研究存在一定的局限性,纳入的文献语种仅限于中文和英文,研究地点均在中国,所纳入的文献质量普遍不高。本研究纳入了非随机对照研究,且大部分研究的样本量较小。孕妇分娩、停药后及婴儿1年以上的随访结果报告较少,可能影响了对母亲及婴儿安全性的评价。本研究通过检索多个数据库并追溯相关文献,以扩大搜索范围,减少偏倚。通过漏斗图和亚组分析等评价发表偏倚及分析的稳定性,所以结果较为客观可靠。
本系统评价证明了替比夫定结合新生儿主被动联合免疫可有效降低宫内感染的发生率,除血清CK升高外,尚无明显的不良反应。目前对孕晚期注射HBIG是否能降低HBV载量,减少母婴传播,仍存在争议[29,36,37]。替比夫定应用于临床的时间较短,且研究数据不多,缺乏不同孕期干预的研究,无法得出哪个孕期开始干预的疗效最优,孕妇及婴儿1年以上的随访报道较少,在妊娠早期应用替比夫定能否提高HBV宫内感染的阻断率等方面有待于进一步深入研究。因此,需进行大样本、多中心、随机对照的临床研究。
[1]World Health Organization(2008).Hepatitis B fact sheet No204.http://www.who.int/mediacentre/factsheets/fs204/en/,accessed February 9,2012.
[2]Swat S,Manoj k.Pregnancy and chronic hepatitis B virusinfection.Hepatol Res,2010,40(1):31-48.
[3]孙奎霞,李杰,庄辉.抗病毒治疗阻断乙型肝炎病毒母婴传播现状与挑战.中国病毒病杂志,2012,2(2):81-86.
[4]Buchanan C,Tran TT.Management of chronic hepatitis B in pregnancy.Clin Liver Dis,2010,14(3):495-504.
[5]Zou H,Chen Y,Duan Z,et a1.Virologic factors associated with failure to passive-active immunoprophylaxis in infants born to HBsAg-positive mothers.J Viral Hepat,2012,19(2): el8-e25.
[6]European Association for the Study of the Liver.EASL Clinical Practice Guidelines:management of chronic hepatitis B.J Hepatol,2009,50(2):227-242.
[7]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版).实用肝脏病杂志,2011,14(2):81-89.
[8]张丽菊,王玲.替比夫定对妊娠后期乙型肝炎病毒宫内感染的阻断作用.中华肝脏病杂志,2009,17(8):561-563.
[9]赵端壁,廖绪强,彭桂娟,等.替比夫定联合乙肝疫苗和乙肝免疫球蛋白阻断乙肝病毒母婴传播60例疗效分析.中国现代药物应用,2010,4(17):37-38.
[10]张华,庞秋梅,田瑞华,等.高病毒载量乙肝孕妇孕期使用核苷类似物抗病毒治疗干预阻断母婴传播的临床前瞻性对照研究.011北京地区肝病·感染学术年会论文集,2011: 86-91.
[11]郭红娟,张芸.替比夫定阻断HBV高载量孕妇母婴传播的作用观察.长治医学院学报,2011,25(5):368-370.
[12]曾艳梅,张思泉,娄国强,等.替比夫定阻断乙肝病毒宫内感染的临床研究.中国临床药理学与治疗学,2010,15(4): 443-445.
[13]张彦芳,胡玉红.替比夫定阻断乙型肝炎病毒母婴传播的疗效和安全性.药物不良反应杂志,2010,12(3):157-159.
[14]黄晓云,王金兰,陶刚.替比夫定阻断乙型肝炎病毒母婴传播的疗效研究.中国民族民间医药,2011,20(22):16-22.
[15]姚展成,陈明纯,廖文燕,等.替比夫定阻断乙型肝炎病毒宫内感染效果和安全性研究.实用肝脏病杂志,2011,14(4): 259-261.
[16]Han GR,Cao MK,Zhao W,et al.A prospective and open-label study for the efficacy and safety of telbivudine in pregnancy for the prevention of perinatal transmission of hepatitis B virus infection.J Hepatol,2011,55(6):1215-1221.
[17]彭保安,赵轶,杨小福,等.替比夫定阻断乙肝病毒母婴传播的疗效和安全性研究.中国药学杂志,2012,47(11):855-857. [18]姜秀浓,范玲燕,李德周,等.替比夫定治疗妊娠晚期慢性乙型肝炎孕妇的临床观察.临床肝胆病杂志,2013,29(2): 101-103.
[19]Xu DZ,Yan YP,Zou S,et a1.Role of placental tissues in the intrauterine transmission of hepatitis B virus.Am J Obstet Gynecol,2001,185(4):981-987.
[20]Bai GQ,Li SH,Yue YF,et a1.The study on role of peripheral blood mononuclear cell in HBV intrauterine infection. Arch Gynecol Obstet,20ll,283(2):317-321.
[21]Pan CQ,Han GR,Jiang HX,et al.Telbivudine prevents vertical transmission from HBeAg-positive women with chronic hepatitis B.Clin Gastroenterol Hepatol,2012,10(5):520-526.
[22]Singh AE,Plitt SS,Osiowy C,et a1.Factors associated with vaccine failure and vertical transmission of hepatitis B among a cohort of Canadian mothers and infants.J Viral Hepat,2011,18(7):468-473.
[23]ChoeBH,LeeJH,JangYC,etal.Long-termtherapeutic efficacy of lamivudine compared with interferon-[alpha]in children with chronic hepatitis B:the younger the better.J Pediatr Gasteroenterol Nutr,2007,44(1):92-98.
[24]Ma SW,Huang X,Li YY,et al.High serum IL-21 levels after 12 weeks of antiviral therapy predict HBeAg seroconversioninchronichepatitisB.JHepatol,2012,56(4): 775-781.
[25]Dusheiko G.Interruption of mother-to-infant transmission of hepatitis B:time to include selective antiviral prophylaxis. Lancet,2012,379(9830):2019-2021.
[26]Yi W,Liu M,Cai HD.Safety of lamivudine treatment for chronic hepatitis B in early pregnancy.World J Gastroenterol,2012,18(45):6645-6650.
[27]Yi W,Liu MH,Cai HD,et a1.Efficacy and safety of lamivudine treatment in late pregnancy with high HBV DNA:A perspectiveformotherandinfants.JInfectDevCtries,2011,5(4):303-306.
[28]Jiang Q,Yu M.A retrospective study of the comparisons between telbivudine and lamivudine on the efficacy and safety in antiviral treatment of hepatitis B virus during pregnancy. J Hepatol,2012,56(2):205-206.
[29]Stroffolini T,Spadaro A,Di Marco V,et a1.Current practice of chronic hepatitis B treatment in Southern Italy.Eur J Intern Med,2012,23(5):124-127.
[30]Bridges EG,Selden JR,Luo S.Nonclinical safety profile of telbivudine,a novel potent antiviral agent for treatment of hepatitis B.Antimicrob Agents Chemother,2008,52(7):2521-2528.
[31]陈宝敏,刘军.乙型肝炎母婴阻断措施的研究进展.中华临床医师杂志,2012,20(6):6199-6202.
[32]Petersen J.HBV treatment and pregnancy.J Hepatol,2011,55:1171-1173.
[33]中华医学会妇产科学分会产科学组.乙型肝炎病毒母婴传播预防临床指南.中华妇产科杂志,2013,48(2):151-154.
[34]Chen HL,Lin LH,Hu FC,et al.Effects of maternal screening and universal immunization to preventmother-to-intant transmission of HBV.Gastroenterology,2012,142(4):773-781. [35]Liu M,Cai H,Yi W.Safety of telbivudine treatment for chronic hepatitis B for the entire pregnancy.J Viral Hepat,2013,20(1):65-70.
[36]Shi Z,Li X,Ma L,et al.Hepatitis B immunoglobulin injection in pregnancy to interrupt hepatitis B virus mother-tochild transmission-a meta-analysis.Int J Infect Dis,2010,14: e622-e634.
[37]王志群,张姝,刘启兰,等.常规应用免疫预防对阻断乙型肝炎病毒母婴传播效果的评价.中华围产医学杂志,2011,14(6):338-342.
(收稿:2013-12-25)(校对:陈从新)
Efficacy and safety of telbivudine in preventing intrauterine transmission of hepatitis B virus in the third trimester of pregnancy:a systematic review
Chen Jun,Sun Xiangfeng,Deng Zerun,et al.Department of Infectious Disease,First Affiliated Hospital,Xinjiang Medical University,Urumqi 830000,China
Objective To systematically review the efficacy and safety of telbivudine in preventing mother-to-infant transmission of hepatitis B virus in the third trimester of pregnancy. Methods Chinese Biomedical Literature Database,WanFang Database Online,Chinese Scientific Journals Database,CNKI,PubMed,ISI web of knowledge,EMBASE,Cochrane Library and BIOSIS Previews were searched for related articles till September 2013. Two reviewers independently screened these articles according to inclusion and exclusion criterion. Meta-analysis was performed by using software Rvman 5.1. Results Eleven papers were included in this study,with a total of 1241 pregnant women,including 602 cases received telbivudine and 639 cases of control;Meta-analysis showed that,after a 6 to 12 month of follow-up,the seropositive rates for HBsAg and HBV DNA in babies of telbivudine-treated mothers were significantly lower than in babies of non-treated mothers[RR=0.15,95%CI(0.08,0.28),P<0.00001;RR=0.12,95%CI(0.05,0.32),P<0.0001,respectively];Maternal HBV DNA levels prior to delivery was significantly lower in telbivudine-treated women than in non-treated women[MD=-3.86,95%CI(-4.55,-3.16),P<0.00001];The rate of elevation in serum creatine kinase (CK)was significantly higher in telbivudine-treated mothers than in non-treated mothers[MD=-3.86,95%CI(-4.55,-3.16),P<0.00001];The neonates in telbivudine group were born without deformity and other complications. Conclusion Telbivudine is effective and safe in blocking HBV intrauterine infection.
Hepatitis B;Telbivudine;Intrauterine transmission;Pregnancy;Meta analysis
10.3969/j.issn.1672-5069.2014.03.008
新疆医科大学第一附属医院科研奖励基金
830054 乌鲁木齐市新疆医科大学第一附属医院感染病科
陈君,女,27岁,硕士研究生。主要从事感染性疾病与肝病研究。E-mail:chenj8510@126.com
孙晓风,E-mail:xjwlsxf@163.com
