shRNA重组慢病毒沉默SMAD3对大鼠肝纤维化的抑制作用*
2014-05-25张莹孔贺利张建军刘梅任锋刘霜陈煜段钟平郑素军
张莹,孔贺利,张建军,刘梅,任锋,刘霜,陈煜,段钟平,郑素军
shRNA重组慢病毒沉默SMAD3对大鼠肝纤维化的抑制作用*
张莹,孔贺利,张建军,刘梅,任锋,刘霜,陈煜,段钟平,郑素军
目的观察SMAD3 shRNA重组慢病毒对大鼠肝纤维化的影响。方法随机将Wistar大鼠60只分为生理盐水对照组(20只)、shRNA对照组(20只)和SMAD3 shRNA组(20只)。对shRNA对照组和SMAD3 shRNA组大鼠,通过脾脏注射法给予慢病毒1.0×108TU/只,生理盐水对照组则给予等体积500μl生理盐水,给药1w后开始制备大鼠四氯化碳肝纤维化模型。在造模4w和8w时,采用Real-Time PCR法检测肝组织SMAD3表达;采用ELISA 法检测血清I型和III型胶原水平。结果在造模4w和8w时,与生理盐水对照组和shRNA对照组比,SMAD3 shRNA组肝组织SMAD3 mRNA水平显著降低(4w:P=0.000,P=0.001;8w:P=0.001,P=0.009);肝组织学检查显示,在造模4w和8w时,SMAD3 shRNA组大鼠肝纤维化程度减轻;在造模4w时,SMAD3 shRNA组动物血清I型胶原[(3.33±1.60)ng/ml]和III型胶原[(1.32±0.56)ng/ml]明显低于生理盐水对照组[(69.4±13.67)ng/ml,(3.90±1.41)ng/ml],也低于shRNA对照组[(66.8±3.50)ng/ml和(3.80±0.93)ng/ml,均P<0.01];在8w时,各组间胶原水平比较无明显差异(P>0.05)。结论SMAD3 shRNA在大鼠体内能明显减轻肝纤维化程度。
肝纤维化;SMAD3;shRNA;慢病毒;大鼠
1 材料与方法
1.1 慢病毒包装和滴定我们先期工作中应用PLL3. 7-shRNA慢病毒4质粒系统已成功筛选和构建了靶向大鼠SMAD3基因的shRNA重组慢病毒[15~17]。SMAD3 shRNA靶向的序列为5’-UGGUGCGAGAAGGCGGUCAdTdT-3’(根据GenBank提供的SMAD3基因序列NM_013095,靶向SMAD3碱基位点289~308)。shRNA对照序列为5’-TTCTCCGAACGTGTCACGT-3’(上海吉玛公司提供,该序列已被证实与大鼠和人基因组缺乏序列同源性)。将构建好的载体质粒交给上海吉玛公司,委托其进行慢病毒大规模包装和滴定。
1.2 动物模型制备 取雄性Wistar大鼠(中国军事医学科学院实验动物中心提供)66只,体重150~200g。抽签法随机将其分为肝纤维化模型组(60只)和正常对照组(6只)。再将模型组大鼠随机分为生理盐水对照组(20只)、shRNA对照组(20只)和SMAD3 shRNA组(20只)。大鼠称体质量后,给予10%水合氯醛4mg.kg-1麻醉,碘酊消毒大鼠腹部脾区,用剪刀开一直径1.5~2.0厘米的小口,用棉签小心寻找并暴露脾脏,经脾脏注射给药。SMAD3 shRNA组、shRNA对照组慢病毒注射剂量均为1×108TU/只;生理盐水对照组应用等体积500μl生理盐水。给药1w后,选择CCl4矿物油溶液,每周2次腹腔注射制备肝纤维化模型。第1次,给予模型组大鼠20%CCl4矿物油溶液1ml.kg-1bw注射,第2次给予30%CCl4矿物油溶液1ml.kg-1bw注射,第3次和第4次给予30%CCl4矿物油溶液2ml.kg-1bw注射,第5次给予40%CCl4矿物油溶液2ml.kg-1bw腹腔注射,以后以同样剂量腹腔注射,每周2次。正常对照组为进行肝组织病理学观察而设,不注射慢病毒,但在同一时间点注射与模型组CCl4等量体积的矿物油。
1.3 标本收集在造模4w后,处死模型组大鼠18只(各组6只)及3只正常对照组大鼠,经下腔静脉取血10ml~15ml,分离血清,放置于-80℃冰箱中保存备检。取出完整肝脏,取1cm×1cm×1cm大小组织,放入10%福尔马林溶液中固定,石蜡包埋,制备4μm切片,行HE、Masson和Reticulin染色,在光镜下观察;其余肝组织经生理盐水冲洗后剪成200 mg左右大小的组织块,放入冻存管中,储存于-80 ℃冰箱备用。慢病毒组剩余大鼠经股静脉给予加强注射慢病毒(1×108TU/只,方法同前)。继续给予40%CCl4矿物油溶液腹腔注射造模,8w后将存活大鼠全部处死,收集标本。
1.4 评估肝硬化造模成功的标准肝组织纤维增生程度评定标准参照Ruwary MF[18]等的文献,将大鼠肝纤维化及肝硬化分为6级。
1.5 肝组织SMAD3 mRNA检测采用实时荧光定量PCR法,按照Trizol试剂说明提取肝组织总RNA,用TaKaRa逆转录酶进行逆转录合成cDNA,应用Primer5软件设计目的基因引物。SMAD3引物序列为,上游:5’-GACGCAGGCTCTCCAAACCT-3’,下游:5’-TTGGACAGCAGGCCCAGACA-3’,扩增位置为803~1029碱基位点。GAPDH引物序列为上游:5’-GCACCACCAACTGCTTAGC-3’,下游:5’-TCCACGATGCCAAAGTTGTCAT-3’,扩增位置为411~650碱基位点。反应体系20μl,设立2个复孔,按两步法扩增,预变性:95℃30s;PCR反应:95℃5s,60℃30s,循环40次。反应结束后确认扩增曲线和溶解曲线,以GAPDH为内参,计算目的基因SMAD3 mRNA的相对水平,计算公式如下:SMAD3 mRNA=2(CtGAPDH-CtSMAD3)。
1.6 血清I型胶原(Collagen I,COI I)和III型胶原(Collagen III,COI III)水平检测采用ELISA法。
1.7 统计学处理采用SPSS 16.0 for Windows 统计软件处理,计量数据以(±s)表示,采用单因素方差分析。对方差不齐资料,选用Kruskal-Wallis秩和检验。对方差分析或秩和检验有统计学意义的结果,进一步选择Bonferonni和LSD法进行两两比较。以P<0.05表示差异有统计学意义。
2 结果
2.1 肝组织SMAD3mRNA水平变化在造模4w时,SMAD3 shRNA组动物肝组织SMAD3mRNA水平显著低于生理盐水对照组和shRNA对照组(P=0.000;P=0.001,图1A);在造模8w时,SMAD3 shRNA组动物肝组织SMAD3mRNA水平同样显著低于生理盐水对照组和shRNA对照组(P=0.001;P=0.009,图1B)。
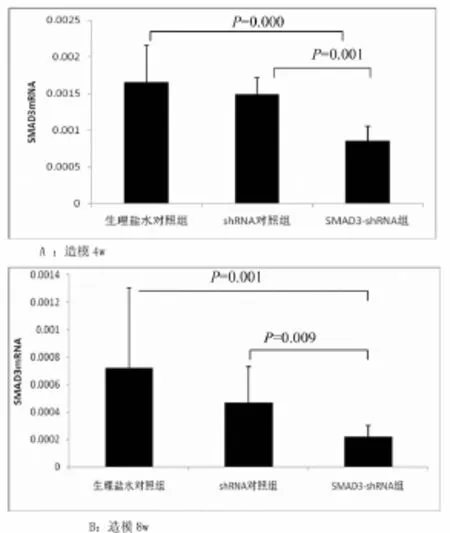
图1 肝纤维化大鼠肝组织SMAD3mRNA水平比较
2.2 大鼠肝组织病理学变化在造模8w时,正常生理盐水对照组和shRNA对照组肝组织有假小叶形成,肝纤维化达到Ⅳ~Ⅵ级,而SMAD3 shRNA组可见胶原纤维自汇管区或中央静脉延伸明显,包绕或未包绕整个肝小叶,肝纤维化分级为Ⅱ~Ⅲ级(图2)。
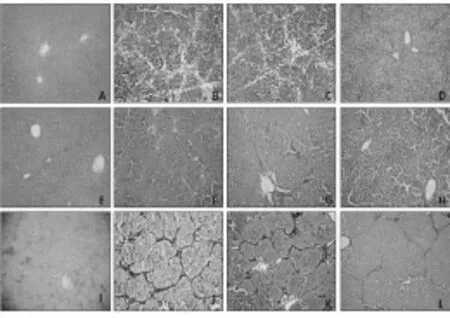
图2 各组肝组织病理学表现
A、E、I:正常对照组;B、F、J:生理盐水组;C、G、K:shRNA对照组;D、H、L:SMAD3 shRNA组(A、B、C、D为HE染色;E、F、G、H为Masson染色;I、J、K、L为网织染色,100×)
2.3 血清COI I和COI III水平的变化见表1。
表1 肝纤维化大鼠血清COI I和COI III水平(ng/ml,±s)比较
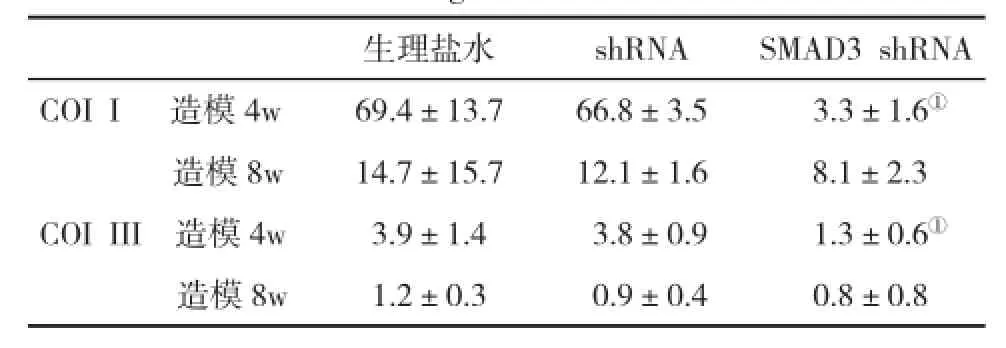
表1 肝纤维化大鼠血清COI I和COI III水平(ng/ml,±s)比较
与生理盐水组和shRNA组比,①P<0.05
生理盐水shRNASMAD3 shRNA COI I 造模4w69.4±13.766.8±3.53.3±1.6①造模8w14.7±15.712.1±1.68.1±2.3 COI III 造模4w3.9±1.43.8±0.91.3±0.6①造模8w1.2±0.30.9±0.40.8±0.8
3 讨论
TGF-β1作为最重要的细胞因子参与了肝纤维化的发生发展[20,21]。Sanderson N[23]et al将TGF-β1基因转染进入裸鼠肝脏,发现裸鼠肝脏等主要器官发生纤维化,提示TGF-β1具有致组织纤维化作用。正常肝脏TGF-β1表达极少。当肝脏受损时,肝脏Kupffer细胞和血小板释放TGF-β1显著增加,虽然不促进HSC增殖,但是能通过TGF-β/ SMAD3途径初始激活HSC,使HSC转化为肌成纤维样细胞(Myofihroblast like cell,MFLC),分泌大量细胞外基质(ECM),使单个细胞胶原合成增加60%~80%[22,23]。TGF-β1还能诱导肝细胞凋亡,抑制基质MMP合成并促进TIMP合成,同时抑制间质胶原酶的活性,减少ECM降解。TGF-β1是肝纤维化形成的关键因子。因此,抑制或阻断TGF-β1表达,将有可能抑制HSC的激活,减少ECM的形成和沉积,从而减轻肝脏纤维化程度或延缓肝纤维化的发生发展。但是,TGF-β1是一个具有多生物学功能的细胞因子,也是一种抗炎因子,过分地抑制会导致肝脏炎症加重,从而不利于受损肝脏的逆转。另外,在体和离体动物实验表明,Activin A通过自分泌和旁分泌方式作用于HSC,促进HSC增殖及分泌ECM,从而促进了肝纤维化的形成及发展[24]。
研究表明,作为TGF-β和Activin的下游共同通路的SMAD3蛋白,在调节MFBs激活、诱导结缔组织生长因子(connective tissue growth factor,CTGF)表达、参与I型、III型胶原和ECM的合成分泌等肝纤维化发生的多个环节起着重要作用。因此,选择特异性阻断SMAD3 蛋白表达,一方面解除TGF-β和Activin对HSC的激活和促增殖作用,可以减轻ECM的形成和沉积,从而达到抑制肝纤维化的目的[25];另一方面,也避免了直接阻断TGF-β1而带来的一系列副反应。我们的实验显示,SMAD3 shRNA处理大鼠肝细胞炎症坏死和纤维组织增生程度较生理盐水对照组和shRNA对照组明显减轻。
ECM包括胶原、糖蛋白及蛋白聚糖等成分[26],COL-I和COL-III是肝纤维化和肝硬化时ECM的主要成分。我们检测发现,与生理盐水对照组和shRNA对照组比,SMAD3 shRNA阻断SMAD3表达后,血清COL-I 和COL-III分泌减少,说明在纤维化早期阻断SMAD3能显著降低COL-I 和COL-III分泌。
[1]Dooley S,Ten DP.TGF-β in progression of liver disease. Cell Tissue Res,2012,347(1):245-256.
[2]郑素军,邢欣悦,韩源平,等.TGF-β1对大鼠HSC-T6细胞增殖、细胞周期和胶原分泌的影响.实用肝脏病杂志,2012,15(4):327-331.
[3]Kreidl E,Oztürk D,Metzner T,et al.Activins and follistatins:Emergingrolesinliverphysiologyandcancer. World J Hepatol,2009,1(1):17-27.
[4]Jones CP,Gregory LG,Causton B,et al.Activin A and TGF-β promote T(H)9 cell-mediated pulmonary allergic pathology.J Allergy Clin Immunol,2012,129(4):1000-1003.
[5]Moffatt MF,Gut IG,Demenais F,et al.A large-scale,consortium-based genomewide association study of asthma.N Engl J Med,2010,363(13):1211-1221.
[6]Lipardi C,Wei Q,Paterson B M.RNAi as random degradative PCR:siRNA primers convert mRNA into dsRNAs that are degraded to generate new siRNAs.Cell,2001,107(3): 297-307.
[7]郑素军,林汝仙,夏云,等.KDR为靶的反义寡核苷酸、siRNA活性比较.重庆医科大学学报,2005,30(3):340-344,382.
[8]Caplen NJ,Parrish S,Imani F,et al.Specific inhibition of gene expression by small double-stranded RNAs in invertebrate and vertebrate systems.Proc Natl Acad Sci U S A,2001,98(17):9742-9747.
[9]夏云,林汝仙,郑素军,等.靶向端粒酶逆转录酶(hTERT)RNAi载体的构建及活性评价.生物化学与生物物理进展,2004,31(12):1079-1084.
[10]郑素军,夏云,任红,等.端粒酶逆转录酶小干扰RNA对肝癌细胞的体外抑制作用.中华肝脏病杂志,2004,12(9):23-26.
[11]Zender L,Hutker S,Liedtke C,et al.Caspase 8 small interfering RNA prevents acute liver failure in mice.Proc Natl Acad Sci U S A,2003,100(13):7797-7802.
[12]Ying RS,Zhu C,Fan XG,et al.Hepatitis B virus is inhibited by RNA interference in cell culture and in mice.Antiviral Res,2007,73(1):24-30.
[13]George J,Tsutsumi M.siRNA-mediated knockdown of connectivetissuegrowthfactorpreventsN-nitrosodimethylamine-induced hepatic fibrosis in rats.Gene Ther,2007,14(10):790-803.
[14]Nishitsuji H,Kohara M,Kannagi M,et al.Effective suppression of human immunodeficiency virus type 1 through a combination of short-or long-hairpin RNAs targeting essential sequences for retroviral integration.J Virol,2006,80(15):7658-7666.
[15]陈鹏,郑素军,王世美,等.靶向大鼠Smad3基因的siRNA筛选及其shRNA重组慢病毒的构建.临床肝胆病杂志,2011,27(5):533-537.
[16]郑素军,邢欣悦,武聚山,等.Smad3 shRNA抑制TGFβ1对HSC-T6细胞活化的抗肝纤维化作用.临床肝胆病杂志,2012,28(4):289-295.
[17]王世美,郑素军,邢欣悦,等.TGF-β1对大鼠肝细胞系BRL-3A凋亡和细胞周期的影响.世界华人消化杂志,2011,19(16):1659-1665.
[18]Ruwart MJ,Rush BD,Snyder KF,et al.16,16-Dimethyl prostaglandin E2 delays collagen formation in nutritional injury in rat liver.Hepatology,1988,8(1):61-64.
[19]Bataller R,Brenner DA.Hepatic stellate cells as a target for the treatment of liver fibrosis.Semin Liver Dis,2001,21(3):437-451.
[20]Gressner AM,Weiskirchen R,Breitkopf K,et al.Roles of TGF-beta in hepatic fibrosis.Front Biosci,2002,7:d793-807. [21]MacLean JJ,Roughley PJ,Monsey RD,et al.In vivo intervertebral disc remodeling:kinetics of mRNA expression in response to a single loading event.J Orthop Res,2008,26(5):579-588.
[22]Sanderson N,Factor V,Nagy P,et al.Hepatic expression of mature transforming growth factor beta 1 in transgenic mice results in multiple tissue lesions.Proc Natl Acad Sci U S A,1995,92(7):2572-2576.
[23]Chen YW,Li DG,Wu JX,et al.Tetrandrine inhibits activation of rat hepatic stellate cells stimulated by transforming growth factor-beta in vitro via up-regulation of Smad 7.J Ethnopharmacol,2005,100(3):299-305.
[24]Kharbanda KK,Rogers DN,Wyatt TA,et al.Transforming growth factor-beta induces contraction of activated hepatic stellate cells.J Hepatol,2004,41(1):60-66.
[25]Date M,Matsuzaki K,Matsushita M,et al.Differential regulation of activin A for hepatocyte growth and fibronectin synthesis in rat liver injury.J Hepatol,2000,32(2):251-260.
[26]Miyazaki T,Karube M,Matsuzaki Y,et al.Taurine inhibits oxidative damage and prevents fibrosis in carbon tetrachloride-induced hepatic fibrosis.J Hepatol,2005,43(1):117-125.
(收稿:2012-12-03)
(校对:陈从新)
The effect of lentivirus expressing shRNA targeted to rat SMAD3 on liver fibrosis in rats
Zhang Ying,Kong Heli,Zhang Jianjun,et al.302nd Hospital,Beijing 100039,China First Co-author:Kong Heli,Youan Hospital,Capital Medical University,Beijing 100069,China
Zheng Sujun,E-mail:zhengsujun003@126.com
Objective To investigate the effects of lentivirus expressing shRNA targeted to rat SMAD3 on liver fibrosis in rats. Methods A total of 60 rats were randomly divided into three groups,i.e. SMAD3 shRNA group (n=20),shRNA control group (n=20)and normal saline group (n=20). The lentivirus were intrasplenicly injected at the dose of 1.0×108TU per rat in experimental group,and in normal saline groups,the rats were given the same volume of normal saline. The liver fibrosis in rat were established by intraperitoneal injection of carbon tetrachloride. The rats were sacrificed at week 4 and week 8 after CCL4injection,respectively. The SMAD3 mRNA levels in liver tissues was detected by using real-time PCR. The serum collagen I and collagen III were detected by ELISA. Results SMAD3 shRNA decreased the SMAD3 mRNA levels obviously at week 4 and 8 after CCL4injection(at week 4:P=0.000,P=0.001;at week 8:P=0.001,P=0.009),respectively,as compared with normal saline group and shRNA control group;the liver fibrosis in SMAD3 shRNA-treated rats improved at week 4 and 8;serum collagen I levels in SMAD3 shRNA-treated group decreased at week 4(3.33±1.60)ng/ml in SMAD3 shRNA,(69.4±13.67)ng/ml in normal saline and (66.8±3.50)ng/ml in shRNA control group(all P<0.01);serum collagen III in SMAD3 shRNA group decreased too at week 4,However,there were no significant differences among the 3 groups at week 8(P>0.05). Conclusions Blocking SMAD3 expression can significantly reduced the degree of liver fibrosis in rats.
Liver fibrosis;SMAD3;shRNA;Lentiviral vector;Rats;转化生长因子β(TGF-β)和激活素(Activin)是主要的促肝纤维化细胞因子[1~3],可激活肝星状细胞(HSC),而SMAD3是TGF-β和激活素信号转导通路中共同的关键信号蛋白[4,5]。特异性阻断SMAD3 蛋白表达,有可能同时解除TGF-β和激活素的作用,起到高效抗肝纤维化作用。小干扰RNA (small interfering RNA,siRNA)是基因功能研究和治疗的高效工具[6~10],目前已应用于体内进行抗肝炎病毒、肝纤维化及肝衰竭的治疗研究[11~13]。高效的siRNA导入手段是确保疗效的另一关键步骤。以HIV-1为基础构建的慢病毒载体系统具有可感染分裂细胞和非分裂细胞,及免疫反应小等优点,还可以通过将其携带的基因片段整合到宿主细胞基因组,实现目的基因的稳定表达,而且感染效率高,免疫原性低,是具有广阔应用前景的RNAi载体[14]。我们在前期研究中,以大鼠SMAD3为靶基因,成功筛选了siRNA作用靶点,并构建了SMAD3 shRNA慢病毒表达系统[15],在体外显示了显著的抗肝纤维化作用[16]。本研究采用四氯化碳诱导肝纤维化大鼠模型,探讨了上述SMAD3 shRNA在体内对肝纤维化的抑制作用。
10.3969/j.issn.1672-5069.2014.03.012
“艾滋病和病毒性肝炎等重大传染病防治”科技重大专项(No. 2013ZX10002002-006-001);国家自然科学基金( No. 30800979,81270532);北京市自然科学基金(No. 7102085);北京市科技新星基金(No. 2007B055); 四川省卫生厅科研项目(No. 080137);北京市卫生系统高层次卫生技术人才(No. 2011-3-083)
100039 北京市解放军第302医院重症监护中心(张莹);首都医科大学附属北京佑安医院(孔贺利, 刘梅,任锋,刘霜,陈煜,段钟平,郑素军);四川省广元市第一人民医院(张建军)
张莹,女,27岁,医学硕士。主要从事重型肝炎/肝衰竭的防治研究。E-mail:zhang999ying@yahoo.com.cn
共同第一作者:孔贺利,女,35岁,大学本科,主管技师。主要从事肝病病理学研究。E-mail: kongheli@sina.com
郑素军,E-mail:zhengsujun003@126.com
