Survivin基因融合蛋白的表达与纯化
2014-05-25蒋继志
李 丽,刘 晶,蒋继志
(河北大学生命科学学院,河北 保定 071000)
Survivin基因融合蛋白的表达与纯化
李 丽,刘 晶,蒋继志
(河北大学生命科学学院,河北 保定 071000)
目的 Survivin是凋亡抑制蛋白(IAP)中最强的凋亡抑制因子,纯化得到其功能结构域(BIR)的融合蛋白可为进一步研究Survivin基因与相关基因的相互作用提供依据。方法 利用PCR技术扩增Survivin基因中的BIR序列后连接到pGEX4T-2载体上,经大肠杆菌(DH5α)验证后,转化BL21大肠杆菌菌株并用IPTG进行诱导,以谷胱甘肽琼脂糖亲和层析技术纯化融合蛋白。结果 实验扩增得到的BIR片段约为276 bp,纯化得到的融合蛋白分子质量大小约为37 ku。结论 PCR结果与预期的片段大小一致,构建重组体后经IPTG在22℃下诱导2 h,菌体中融合蛋白的表达量显著增加,为下一步研究Survivin基因的功能和与其相互作用的蛋白奠定了基础。
Survivin; pGEX4T-2;IPTG诱导;纯化
Ambrosin等1997年应用效应细胞蛋白酶受体1(effector cell protease receptor-1)首次从人类基因组cDNA中分离获得的凋亡抑制基因Survivin(生存素)[1-2],它是凋亡抑制蛋白(Inhibitor of apoptosis protein,IAP)家族中最强的凋亡抑制因子。IAP家族一般含有2~3个串联的含有半胱氨酸/组氨酸共有序列在内的70个氨基酸组成的杆状病毒凋亡抑制蛋白重复系列(baculovirus IAP repeat, BIR)分子以及羧基末端环指结构,其中的BIR分子发挥抗凋亡作用[3-4]。而Survivin结构特殊,氨基酸N端仅含有一个单一的为细胞凋亡抑制所必需的较为保守的BIR功能区,羧基端不含有环指结构,代以交织螺旋结构(coiledcoil),其34位上的苏氨酸磷酸化,对维持蛋白的稳定性以及协同细胞周期蛋白依赖性激酶抑制蛋白即CDK1(Cyclin-depended kinases inhibitors, CDKIs)调节细胞周期正确过度起重要作用[5-8]。因此,对Survivin蛋白N端的BIR结构域的研究已有一些报道[9-10],但对BIR结构域与IAP家族其它成员之间在抗凋亡过程中的协同作用报道还很少[11-15]。本实验拟利用PCR扩增得到Survivin基因的BIR结构域,与原核表达载体pGEX4T-2重组并转化大肠杆菌菌株得到重组体的融合蛋白,为进一步探讨Survivin基因的BIR结构域与IAP家族其它成员(例如XIAP)之间的相互作用奠定基础。
1 材料和方法
1.1 材料
Survivin基因由厦门大学惠赠,DNA Marker蛋白质分子量标准(低)(Protein Molecular Weight Marker) (low),均购自Takara 公司,质粒小提试剂盒(TIANprep Mini Plasmid Kit)和普通琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)购于天根生化科技有限公司(北京);大肠埃希菌E.coli DH5α和E.coli.BL21(DE3)为本实验室保存。
1.2 引物设计
根据已经发表的DNA序列(NCBI)利用Primer5.0软件设计PCR扩增引物,其上游引物和下游引物分别附加了不同的酶切位点,以便插入载体。上游引物5'CGggatccGGTGCCCCGACGTT3'下游引物5'AAActcgagTCAATCCATGGCAG3'
1.3 重组体的构建
将Survivin基因进行PCR,并将其扩增的产物进行纯化回收,将回收的产物和pGEX4T-2 (GST)载体37℃进行双酶切,并将其连接在16℃过夜。然后将重组体转化到DH5α 中,挑取阳性克隆至加入相应抗性的LB培养基中,过夜培养,培养后取1 mL菌液送测序,剩下的菌液保种并提取重组体的质粒。
1.4 靶蛋白的诱导表达
按照文献[16]中所述方法进行诱导和裂解,将测序正确的重组体pGEX4T-Survivin转入至BL21菌株中,经37℃培养至OD值达到0.55~1.0,在22℃下以0.1 mmol/L IPTG诱导2 h,收集菌体,取少量的菌体制成SDS-PAGE样品。将收集的菌体用PBS将菌株悬浮起来,加PMSF和DTT,然后加溶菌酶30 min,期间要随时调pH至8.0,最后加完Triton离心,去沉淀,取少量上清制成SDS-PAGE样品,剩下的上清结合已经处理好的柱子,然后将融合蛋白洗脱下来,取少量制成SDS-PAGE样品,进行SDSPAGE分析。
2 结果与分析
2.1 重组体的制备
对Survivin基因BIR结构域的PCR扩增结果如图1所示,扩增得到的片段为276 bp,在250~500 bp之间,与预期的片段大小一致。该片段经双酶切、连接到载体上构成重组体,经验证该重组体已经成功转入大肠杆菌中(图2)。
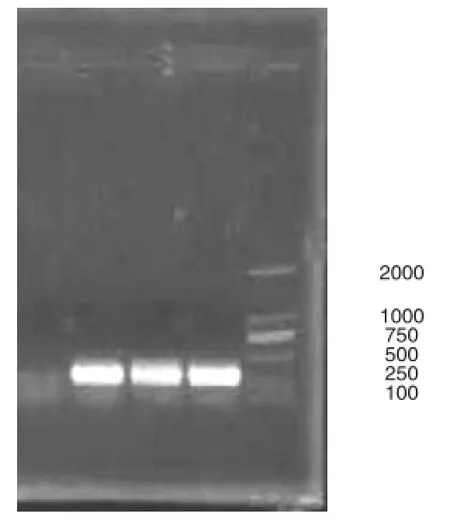
图1 Survivin PCR
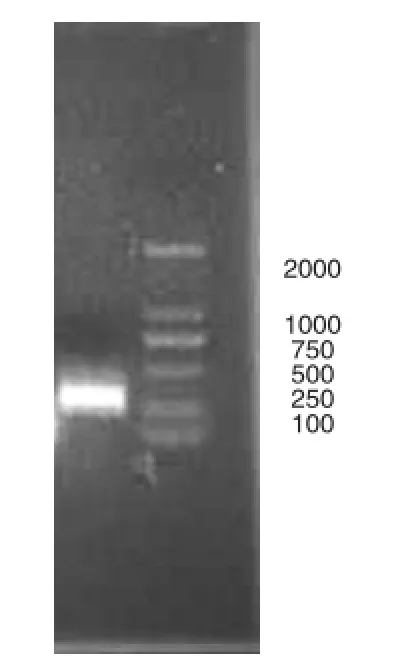
图2 菌落PCR验证
2.2 融合蛋白的诱导表达及纯化
Survivin基因的BIR结构域编码的蛋白经IPTG诱导及谷胱甘肽琼脂糖亲和层析技术纯化的结果见图3。经IPTG诱导2 h后,菌体中融合蛋白的表达量显著增加,离心除去菌体后的上清中也显示出大量的融合蛋白,从上清中纯化出了融合蛋白,约为37 ku。
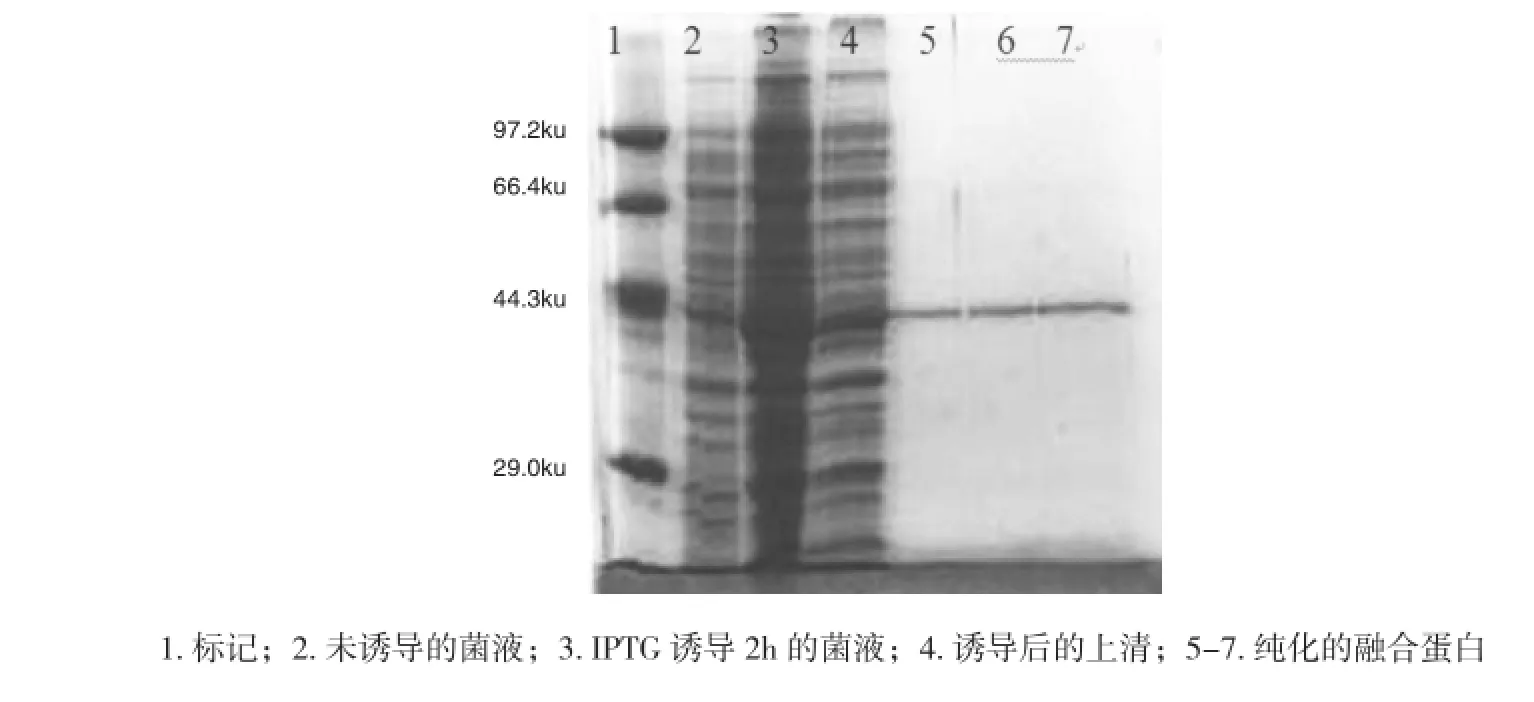
图3 融合蛋白的诱导表达及纯化
3 讨 论
对Survivin基因N端BIR结构域表达的研究,通常用真核表达载体进行表达,可直接转入瘤细胞中,观察其对肿瘤细胞的抑制作用[17-19]。但利用原核表达载体进行表达,获得融合蛋白的报道似乎很少。殷小涛等[20]将利用PCR扩增得到的人Survivin基因的全长序列(538bp)克隆至原核表达载体pET28a,并转化大肠杆菌BL21(DE3),经IPTG诱导后获得了24 ku的Survivin/His融合蛋白,用Ni亲和层析凝胶纯化后的蛋白纯度达到90%,且有良好的抗原活性。本实验也获得与上述殷小涛等相似的结果,获得的Survivin/GST融合蛋白约为37 ku,且表达量很高。此外,在利用IPTG诱导融合蛋白表达时,温度是关键因素之一,通常以18~26℃的低温进行诱导,本实验中以22℃诱导重组体表达的效果很好,说明实验所采用的条件是适合的。这些结果对进一步分析Survivin基因BIR功能结构域的融合蛋白及其与IAP家族成员的相互作用有一定的指导意义和参考价值。
[1] AMBROSINI G, ADIDA C, ALTERI D C. A novel anti-apoptosis gene, surviving, expressed in cancer and lymphoma[J]. Nat Med, 1997, 3(8): 917-921.
[2] 蒋玮. survivin在妇科肿瘤中的研究进展[J]. 医学理论与实践, 2010, 23(10): 1200-1201.
[3] 姜峰玉, 陈定法, 孙抒. Livin在肿瘤凋亡中的研究进展[J]. 中国老年学杂志, 2012, 32(15): 3343-3345.
[4] 肖建华, 游艳, 董自强. survivin在膀胱癌中应用的研究进展[J]. 实用医学杂志, 2012, 28(15): 2632-2634.
[5] 刘云, 王希君, 陈舒丽. 肿瘤基因治疗中survivin的研究进展[J]. 咸宁学院医学报, 2007, 21(4): 178-179.
[6] HANA B, RONG XIAO, JOHN ZHAO, et al. Expression of survivin in human oocytes and premplantation embryos[J]. Fertilty and sterility, 2012, 99(2): 518-525.
[7] AZZA ABDEL-AZIZ, MIE ALI ALI M, FATMA M, et al. Survivin expression in medulloblastoma: a possible marker for survival[J]. Pathology and Oncology Research, 2013, 19(3): 413-419.
[8] CORNELIA MUSCHOL-STEINMETZ, ALEXANDRA F, NINA-NAMI K, et al. Function of survivin in trophoblastic cells of the placenta[J]. Placenta, 2013, 34(9): A27.
[9] 张海燕, 高大新, 刘国良. survivin 基因及其与肿瘤靶向治疗[J]. 肿瘤防治治疗, 2005, 12(10): 787-790.
[10] 张文梁, 王举, 王有德. survivin 基因和蛋白的分子生物学研究进展[J]. 吉林大学学报, 2006, 5(32): 937-940.
[11] 蔡贤福, 何卫阳. survivin特性及其在肿瘤中的应用[J]. 医学综述, 2012, 18(3): 42-45.
[12] 鲁凯, 姚壮凯, 刘燕文, 等. 乳腺癌中survivin基因的研究及临床意义[J]. 中国内分泌外科杂志, 2012, 6(5): 323-326.
[13] 成志勇, 万建设, 王亚丽, 等. PTEN基因对慢性粒细胞白血病survivin、xiap、smact调控的研究[J]. 中华医学杂志, 2011, 91(40): 2868-2872.
[14] 宰红艳, 易小平, 李宜雄, 等. 抑制X染色体连锁的凋亡抑制蛋白(XIAP)和survivin表到对胰腺癌Panc-1细胞增殖及化疗敏感性[J]. 北京大学学报: 医学版, 2013,45(2): 242-249.
[15] 何金花, 陈顺仪, 王莉, 等. survivin、xiap、apollon和livin反义寡核苷酸对人消化系肿瘤增值及凋亡的影响[J]. 中国药理学通报, 2011, 27(3): 367-372.
[16] SAMBROOK J, RUSSELL D W. 分子克隆实验指南[M]. 3 版. 黄培堂,译. 北京: 科学出版社, 2002.
[17] RITA NOGUEIRA-FERREIRA, RUI VITORINO, MANUEL J, FERREIRA, et al. Exploring the role of post-translations on protein-protein interactions with surviving[J]. Archives of Biochemistry and Biophysics, 2013, 538(2): 64-70.
[18] GABRIELA N M, FLAVIA C V, DEBORAH D, et al. Analysis of surviving, XIAP and FoxM1 as potential chemoresistance factors in breast cancer cells[J]. BMC Proceedings, 2013, 7(Suppl2): 27.
[19] KAPELLOS G, POLONIFI K, FARMAKIS D, et al. Overexpression of survivin levels in circulation and tissue samples of lung cancer patients[J]. Anticancer Res, 2013, 33(8): 3475-3480.
[20] 殷小涛, 王伟, 田仁礼, 等. 人survivin基因的原核表达、纯化及抗原活性鉴定[J]. 细胞与分子免疫学杂志, 2013, 29(8): 877-879.
(责任编辑:裘永强)
Expression and purification of Survivin gene fusion protein
LI Li, LIU Jing, JIANG Jizhi
(College of Life Sciences of Hebei University, Baoding 071000, china)
Objective Survivin gene is the strongest apoptosis-inhibition factor among inhibitor of apoptosis protein (IAP), and purification of fusion protein of functional domains (baculovirus IAP repeat, BIR) may provide the foundation for interaction research between the gene and related other genes. Methods BIR sequence, after amplification with PCR and validation by Escherichia coli DH5α through pGEX4T-2 vector, was transformed into E. coli BL21. Fusion protein of BIR was induced by IPTG and purified by Glutathione Agarose Affinity Chromatography. Results The amplified fragment BIR was about 276bp, purified fusion protein molecular weight of approximately 37ku. Conclusion PCR results are consistent with the expected fragment size, recombinant plasmids after 2h after IPTG induction, the cell in the fusion protein increase significantly, which provide basis for further research on Survivin gene function and its interacting protein.
Survivin; pGEX4T-2; IPTG induction; purification
R3
A
1674-490X(2014)01-0013-04
2013-11-25
河北省科技支撑计划项目(13226502D);河北省自然科学基金项目(C2011201003)
李丽(1988—),女,河北邢台人,在读硕士,主要从事生物化学与分子生物学研究。
蒋继志(1960—),男,宁夏中宁人,教授,博士,博士生导师,主要从事植物病害生物防治研究。E-mail: jizhijiang@163.com
