脂联素对巨噬细胞源性泡沫细胞ABCA1及胆固醇含量的影响及机制
2014-05-25郭晓红边云飞梁斌白瑞肖传实
郭晓红边云飞梁 斌白 瑞肖传实
(1 山西医科大学第一临床医学院心内科,山西 太原030001;2 山西医科大学第二临床医学院心内科,山西 太原 030001)
脂联素对巨噬细胞源性泡沫细胞ABCA1及胆固醇含量的影响及机制
郭晓红1边云飞2梁 斌1白 瑞2肖传实1
(1 山西医科大学第一临床医学院心内科,山西 太原030001;2 山西医科大学第二临床医学院心内科,山西 太原 030001)
目的探讨脂联素对RAW264.7巨噬细胞源性泡沫细胞ABCA1及胆固醇含量的影响及其可能的机制。方法体外培养RAW264.7细胞,加入20 mg/L氧化低密度脂蛋白(ox-LDL)共同孵育48 h,将其诱导成泡沫细胞,加入不同浓度(0、1、5、10 μg/mL)的脂联素干预24 h,RT-PCR测定ABCA1 mRNA的表达,高效液相色谱测定细胞内胆固醇含量。观察脂联素对泡沫细胞中ABCA1表达的影响。结果脂联素显著增加RAW264.7巨噬细胞源性泡沫细胞ABCA1 mRNA的表达(P<0.05),并增加细胞内胆固醇含量,且呈浓度依赖性(P<0.05)。结论脂联素可以增加巨噬源性泡沫细胞ABCA1转录水平,促进胆固醇流出,延缓AS的发生发展。
脂联素;巨噬细胞源性泡沫细胞;ABCA1;胆固醇含量
动脉粥样硬化(atherosclerosis,AS)是一种影响动脉血管的综合征。巨噬细胞摄入大量脂质形成泡沫细胞是动脉粥样硬化的一个早期重要特征,因此促使细胞内脂质流出即胆固醇逆转运(reverse cholesterol transport,RCT)对防治AS具有重要作用。ATP结合盒转运子A1(ATP binding cassettetransporter A1, ABCA1)是该过程中的一种重要转运体,已有研究表明ABCA1在RCT过程中与载脂蛋白结合参与高密度脂蛋白(high density lipoprotein,HDL)的形成,促使细胞内多余脂质流出并运输至肝脏排出,在细胞胆固醇代谢中起着关键的调控作用,是RCT中的第一步也是关键的一步。脂联素(Adiponectin,ADN)是脂肪细胞分泌的特异性细胞因子,它能抑制内皮细胞的炎性反应及血管平滑肌细胞增殖,同时抑制巨噬细胞向泡沫细胞转化[1-5],在肥胖相关疾病及多种心血管疾病中起保护作用。本研究旨在观察脂联素对巨噬细胞源性泡沫细胞ABCA1表达的影响及胆固醇流出的作用,并进一步探讨其可能的作用机制。
1 材料与方法
1.1 细胞:巨噬细胞株(RAW264.7细胞)来自本实验室。
1.2 主要材料、试剂及仪器:人重组脂联素购自Sigma公司, RPMI1640培养基购自武汉博士德生物工程有限公司,胎牛血清购自杭州四季青公司,氧化低密度脂蛋白购自北京协和三友科技开发有限公司;RT-PCR逆转录试剂盒和RNAiso购自TaKaRa公司;ABCA1引物购自Abcam公司,β-actin(内参)购自上海生物工程有限公司。
1.3 实验方法
1.3.1 泡沫细胞的制备及鉴定[6,7]:泡沫细胞模型的建立参照文献[9,10]进行:用含10%胎牛血清的RPMI1640培养基,于37 ℃、5%CO2培养箱中静置培养。待细胞长到80%满的时候,进行传代,传至4-5代时将生长良好的RAW 264.7细胞以2×104个/L的密度接种于6孔培养板,培养24 h,细胞贴壁后弃细胞液,加入20 mg/Lox-LDL共培养48 h建立泡沫细胞模型。用油红O染色15 min,再用60%油红O异丙醇清洗,再立即用PBS清洗3遍,显微镜下观察泡沫细胞形态,显微镜下可见胞内亮红色脂滴即为泡沫细胞。
1.3.2 实验分组:实验分为4组:①对照组;②加入1 μg/mL脂联素组;③加入5 μg/mL脂联素组;④加入10 μg/mL脂联素组,干预24 h。每组设3个复孔。
1.3.3 RT-PCR法检测细胞中ABCA1 mRNA的表达:采用Trizol法提取各组细胞总mRNA,合成cDNA第一链,以其为模板进行扩增,以β-actin为内参,引物由生工生物工程(上海)有限公司合成。ABCA1上游引物序列为:TGGATGGATTAGATTGGACTG,下游引物序列为TGTTGATGAGCCTGACTTC,bp为201,β-actin上游引物序列为GTCAGGTCATCACTATCGGCAAT,下游引物序列为AGAGGTCTTTACGGATGTCAACGT,bp为184。ABCA1 反应条件为:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 延伸30 s,共35个循环;72 ℃再延伸5 min。PCR产物经琼脂糖凝胶电泳鉴定,并用Quantitity One凝胶图像分析系统分析,以目的基因与β-actin基因区带面积积分灰度值的比值表示目的基因的相对表达量。试验重复3次。
1.3.4 细胞内胆固醇含量的测定:酶法结合高效液相色谱法测定各组细胞内胆固醇含量。RIPA裂解液裂解细胞,使蛋白含量在100~200 mg/L。取2份各100 μL,采用酶法结合高效液相色谱法测定各组细胞内总胆固醇(total cho-lesterol,TC)和游离胆固醇(free cholesterol,FC),TC与FC的差值为胆固醇酯(cholesterol ester,CE),胆固醇酯与总胆固醇的比值(CE/ TC),实验重复2次。
1.3.5 统计学分析:应用SPSS13.0软件进行统计分析,实验数据以均数±标准差表示,组间比较采用析因设计资料的方差分析, P<0.05为差异有统计学意义。
2 结 果
2.1 泡沫细胞的鉴定:细胞吞入脂质形成的泡沫细胞经油红O染色,镜下可见细胞内脂质染成亮红色,见图1、图2。
2.2 细胞中ABCA1 mRNA的表达:RT-PCR结果显示,与对照组相比,不同浓度脂联素干预组ABCA1 mRNA的表达均明显升高,且呈浓度依赖性,见表1、图3。
2.3 不同浓度脂联素对泡沫细胞内胆固醇含量的影响:检测结果显示,与对照组比较,不同浓度的脂联素干预组胆固醇含量,均明显增高,且呈浓度依赖性,见表2。

图1 RAW264.7巨噬细胞

图2 RAW264.7巨噬细胞源性泡沫细胞。图中箭头所指即为泡沫细胞

图3 RT-PCR测定RAW264.7巨噬细胞源性泡沫细胞ABCA1基因mRNA的表达水平
1为DNAMaker,2为对照组,3为β-actin(184bp),4为1 μg/mL脂联素组,5为5 μg/mL脂联素组,6为10 μg/mL脂联素组。
表1 各组RAW264.7源性泡沫细胞ABCA1mRNA的表达水平(相对表达量,,n=3)

表1 各组RAW264.7源性泡沫细胞ABCA1mRNA的表达水平(相对表达量,,n=3)
注:与同时间点对照组比较,aP<0.05;与同时间点1 μg/mL脂联素组比较,bP<0.05;与同时间点5 μg/mL脂联素组比较,cP<0.05
3 讨 论
胆固醇逆转运(RCT)是指胆固醇从外周细胞中流出[11-16],与载脂蛋白A-Ⅰ(ApoA-I)结合,形成HDL,转运至肝脏排出的过程,是体内抗动脉粥样硬化(AS)的生理性保护机制,也是防止泡沫细胞形成的重要途径。ABCA1是ATP结合盒转运子超家族的成员,是RCT过程中的一种重要转运蛋白,介导细胞内胆固醇流出,是起始步骤的关键。脂联素在心血管疾病中起保护作用,大量研究显示脂联素具有广泛的抗AS作用,能抑制巨噬细胞清道夫受体的表达,促使细胞内胆固醇外流。研究发现,冠状动脉病变的严重程度与脂联素水平呈负相关。还有研究提示,脂联素可能对心肌肥厚具有抑制作用。在抗AS中,脂联素可抑制血管平滑肌细胞的增殖、迁移,促使巨噬泡沫细胞内胆固醇流出,抑制动脉斑块形成及稳定斑块。但脂联素促使细胞内胆固醇流出上调ABCA1表达,其机制尚不明确[17-19]。
表2 各组RAW264.7源性泡沫细胞内胆固醇含量的表达量
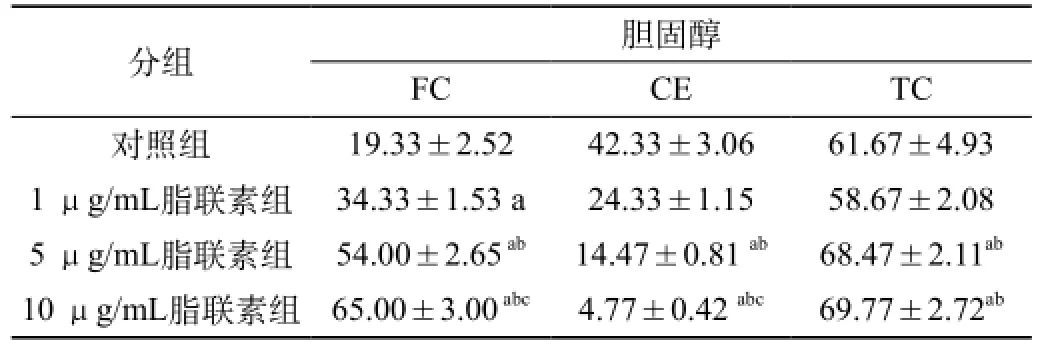
表2 各组RAW264.7源性泡沫细胞内胆固醇含量的表达量
注:与同时间点对照组比较,aP<0.05;与同时间点1 μg/mL脂联素组比较,bP<0.05;与同时间点5 μg/mL脂联素组比较,cP<0.05
本实验结果显示,脂联素能呈浓度依赖性地上调巨噬细胞源性泡沫细胞中ABCA1基因的转录水平,提示脂联素可能通过上调ABCA1的表达[20],增加细胞内胆固醇流出率,促进胆固醇外流,从而延缓AS的发生、发展。
[1] Sage AP,Demer LL.Regulatory mechanisms in vascular calcification[J].Nat Rev Cardiol,2010,7(9):528-536.
[2] AHM Nurun Nabi and Fumiaki Suzuki.Biochemical properties of renin and prorenin binding to the (pro)renin receptor[J]. Hypertens Res,2010,33(2):91-97.
[3] Melnyk RA,Tam J,Boie Y,et al.David Percivalet al.Renin and prorenin activate pathways implicated in organ damage in human mesangial cells independent of angiotensin II production[J].Am J Nephrol,2009,30(3):232-243.
[4] Liu Y,Shanahan CM.Signalling pathways and vascular calcification[J].Front Biosci(Landmark Ed),2011,16:1302-1314.
[5] Borderet WW,Lu X,Leijten F,et al.Renin and prorenin-induced effects in rat vascular smooth muscle cells overexpressing the human (pro)renin receptor: does(pro)renin -(pro)renin receptor interaction actually occur? [J].Hypertension,2011,58(6):1111-1119.
[6] Huang Y,Wongamorntham S,Kasting J,et al.Renin increases mesangial cell transforminggrowth factor-β1 and matrix proteins throughreceptor-mediated,angiotensin II-independentmechanisms[J].Kidney Int,2006,69(1):105-113.
[7] Melnyk RA,Tam J,Boie Y,et al.Renin and prorenin activate pathways implicated in organ damage in human mesangial cells independent of angiotensin II production[J].Am J Nephrol,2009,30(3):232-243.
[8] Tanaka T,Sato H,Doi H,et al.Masahiko Kurabayashietal.Runx2 represses myocardin-mediateddifferentiation and facilitates osteogenic conversion ofvascular smooth muscle cells[J].Mol and Cell Biol,2008,28(3):1147-1160.
[9] Bear M,Butcher M,Shaughnessy SG.Oxidized low-density lipoprotein acts synergistically withbeta -glycerophosphate to induce osteoblast differentiation in primary cultures of vascular smooth muscle cells [J].CellBiochem,2008,105(1):185-193.
[10] McCaffrey TA.TGF-ß signalinginatherosclerosis and restenosis[J].Front Biosci(Schol Ed),2009:236-45.
[11] Nguyen G,Delarue F,Burcklé C Sraer.et al.Pivotal role of the renin/prorenin receptor in angiotensinIIproduction and cellular responses to renin[J].J Clin Invest,2002,109(11):1417-1427.
[12] Baldan A,Tarr P,Lee R,et al.ATP-binding cassette transporter G1 and lipidhomeostasis[J].Curr Opin Lipidol,2006,17(3):227-232.
[13] Wang N,Ranalletta M,Matsuura F,et al.LXR-induced redistribution of ABCG1 toplasma membrane in macrophages enhances cholesterol mass efflux to HDL[J].Arterioscler Thromb Vasc Biol,2006,26(6):1310-1316.
[14] Kusuhara H,Sugiyama Y.ATP-binding cassette,subfamily G (ABCG family) [J].Pflugers Arch,2007,453(5):735-744.
[15] Sankaranarayanan S,Oram JF,Bela F,et al.Effects of acceptor composition andmechanism of ABCG1-mediated cellular free cholesterol efflux[J].Journal of LipidResearch,2009,50(2):275-284.
[16] Klucken J,Buchler C,Orso E,et al.ABCG1 (ABC8),the human homolog of theDrosophila white gene,is a regulator of macrophage cholesterol and phospholipidtransport[J].Proc Natl Acad Sci USA,2000,97(2):817-822.
[17] Kennedy MA,Barrera GC,Nakamura K,et al.ABCG1 has a critical role in mediatingcholesterol efflux to HDL and preventing cellular lipid accumulation[J].Cell Metab,2005,(2): 121-31.
[18] 杨磊.ABCA1在胆固醇逆转运中作用的研究进展[J].健康研究,2010,30(3):214-217.
[19] 沃兴德.RAW264.7巨噬细胞源性泡沫细胞模型的建立及鉴定[J].中国动脉硬化杂志,2010,18(9):687-690.
[20] 赵水平.载脂蛋白嵌合模拟肽对巨噬细胞胆固醇流出的影响[J].中国药理学通报,2010,26(12):1572-1578.
Adiponectin Effects on Macrophage Derived Foam Cells and Cholesterol Content and Mechanism of ABCA1
GUO Xiao-hong1, BIAN Yun-fei2, LIANG Bin2, BAI Rui2, XIAO Chuan-shi1
(1 Department of Cardiology, The First Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China; 2 Department of Cardiology, The Second Affiliated Hospital of Shanxi Medical University, Taiyuan 030001, China)
ObjectiveEffects of adiponectin on RAW264.7 macrophage derived foam cells and cholesterol content to ABCA1) objective and its possible mechanisms.MethodsRAW264.7 cells cultured in vitro, joined the 20mg/L oxidized low density lipoprotein (ox-LDL) were incubated for 48 h, the induced into foam cells, with different concentrations (0,1,5,10 μg/mL) of adiponectin 24h expression of RT-PCR ABCA1 mRNA, determination, HPLC determination of intracellular cholesterol content. To observe the effects of adiponectin on the expression of ABCA1 in foam cells.ResultsThe expression of adiponectin was significantly increased in RAW264.7 macrophage derived foam cells in ABCA1 mRNA (P<0.05), and increased cellular cholesterol content, in a dose-dependent manner (P<0.05).ConclusionAdiponectin can increase the macrophage derived foam cell ABCA1 transcription level, promote cholesterol efflux, delay the occurrence and development of AS.
Adiponectin; Macrophage derived foam cells; ABCA1; Cholesterol
R54
B
1671-8194(2014)25-0046-03
