牦牛INHBA基因的克隆及序列分析
2014-05-24穆晓琨字向东毕琳
穆晓琨, 字向东, 毕琳
(1.肇庆学院生命科学学院, 广东 肇庆 526061; 2.西南民族大学生命科学与技术学院, 四川 成都 610041;3.犍为县畜牧局, 四川 犍为 614400)
牦牛INHBA基因的克隆及序列分析
穆晓琨1, 字向东2, 毕琳3
(1.肇庆学院生命科学学院, 广东 肇庆 526061; 2.西南民族大学生命科学与技术学院, 四川 成都 610041;3.犍为县畜牧局, 四川 犍为 614400)
根据GenBank检索到的普通牛的INHBA基因序列设计一对特异性引物, 以牦牛卵巢组织总RNA为模板, 通过RT-PCR技术对牦牛INHBAcDNA进行克隆测序和序列分析.结果表明: 扩增片段1360bp, 包含1277bp的编码区, 编码426个氨基酸.与普通牛相比, 牦牛INHBA基因编码区存在2处碱基转化.牦牛与普通牛、绵羊、人、鼠和猪的核苷酸序列同源性分别为99.84%、97.97%、91.41%、87.79%、91.94%, 氨基酸序列同源性分别为99.53%、98.82%、95.77%、93.88%、93.88%.蛋白质结构分析显示,INHBA蛋白不易形成α螺旋和跨膜结构, 是相对保守的疏水性蛋白.
牦牛;INHBA;克隆; 序列分析
抑制素是一种主要由雄性睾丸支持细胞[1]和雌性卵巢颗粒细胞分泌[2]的二聚体糖蛋白激素.抑制素属于转化生长因子β(transforming growth factor-β, TGF-β)超家族成员, 该家族成员主要参与体内各种影响细胞生长和分化的功能[3-5].抑制素主要有INHA、INHBA和INHBB三种类型的亚基.INHA亚基上具有糖基化位点,INHA亚基分别与INHBA和INHBB亚基之间通过二硫键连接而成异质二聚体[6], 即抑制素A(αβA)和抑制素B(αβB).许多动物实验研究证实抑制素可以抑制FSH在垂体中的分泌[7-11], 是哺乳动物FSH分泌的主要负反馈调节因子.抑制素的水平能反映出发情周期中卵泡生长的数量, 是决定动物排卵的关键调节激素[12].
牦牛是青藏高原的一个特有畜种, 分布于海拔 3000m以上, 能适应高寒、低氧等极端生态条件[13], 是青藏高原畜牧业的支柱, 在遗传资源上是一个极为宝贵的基因库[14].然而牦牛的繁殖性能相对低下, 在如何提高牦牛繁殖形状的课题上, 国内外进行了大量的科学研究.本研究对牦牛INHBA基因编码区进行克隆分析, 并通过生物信息学方法对其蛋白进行功能和结构预测, 以期为牦牛INHBA基因的表达调控和繁殖性状的相关分析提供一定的理论基础.
1 材料和方法
1.1 材料
从成都近郊的屠宰场采集刚屠宰的牦牛卵巢, 液氮冻存.pMD 18-T Vector、Taq DNA聚合酶、DL2000 Marker均为Takara产品; 反转录试剂盒购自Fermantas(MBI)公司; OMEGA胶回收试剂盒、大肠杆菌DH5α均购于天根生化科技有限公司.
1.2 方法
1.2.1 引物设计
根据GenBank收录的牛INHBA基因 mRNA序列(登录号NM_ 74363), 利用primer5.0软件设计特异性引物,序列为: F 5'ACACAACAACTTTTGCTGCC 3', R 5'TCGTGTCACCACTGTCTTCTC 3', 扩增长度为1360bp, 由上海英骏公司合成.
1.2.2 总RNA的提取和RT-PCR
采用Trizol法提取牦牛卵巢组织总RNA, 使用Fermentas(MBI)反转录试剂盒进行反转录, 合成cDNA第一链.以该cDNA链为模板进行PCR, 反应体系25ul: 10×loading buffer 2.5μL, dNTPs(10mmol/L)2μL, cDNA 1μL, 15 umol/L 的上下游引物各1 μL, Taq酶0.3μL, 17.2 μL ddH2O.PCR反应体系: 95℃ 预变性4 min; 94℃变性 30s;56℃退火30s; 72℃延伸1min30s; 共32个循环; 最后72℃终延伸7 min; 4℃保存.产物用1.5%的琼脂糖凝胶电泳检测.
1.2.3 PCR产物的克隆、鉴定及测序
将纯化后的PCR产物与pMD 18-T载体16℃下连接过夜后, 转化感受态细胞DH5α中, 涂布含Amp、X-gal和IPTG的LB平板上, 37℃过夜培养.挑选白色菌落接种于含Amp的LB液体培养基中, 37℃, 200r/min振荡过夜培养.菌液PCR鉴定后, 送上海英骏测序.
1.2.4 INHBA基因的生物信息学分析
将扩增得到的牦牛INHBA基因序列与 GenBank中检索到的牛(NM_174363)、绵羊(NM_001009458.1)、人(NM_002192.2)、鼠(NM_008380.1)和猪(NM_214028.1)的基因序列通过 DNAMAN 软件进行序列比对和进化树的构建.利用相关在线蛋白分析软件对INHBA蛋白进行理化性质、疏水性及跨膜结构预测、信号肽预测(SignalP 4.0)等功能分析和结构预测.
2 结果与分析
2.1 INHBA基因的克隆
参照牛INHBA基因 mRNA序列设计的引物, 以牦牛总cDNA为模板进行PCR扩增, 得到一条特异性条带(图1), 测序结果显示该片段长为1360bp, 其中编码区全长1277bp, 共编码426个氨基酸, 碱基含量分析显示A、C、G和T的含量分别为25%、25.4%、31.3%和18.2%.
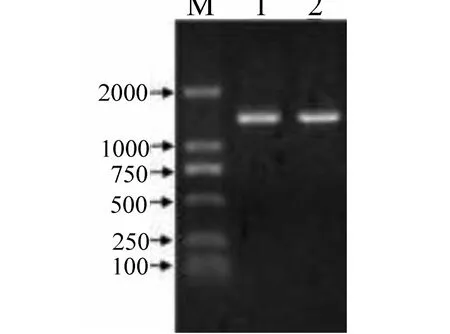
图1 牦牛INHBA基因RT-PCR产物扩增结果
2.2 序列比对和进化树的构建
将测序得到的牦牛INHBA基因序列与参照序列牛的INHBA基因序列进行序列比对, 结果显示: 2者编码区序列长度一致, 但存在2个碱基差异(图2): 53位T→C, 导致氨基酸由缬氨酸变为丙氨酸(Val→Ala); 762位G→A,导致氨基酸由缬氨酸变为甲硫氨酸(Val→Met).
通过DNMMAN软件比对后, 发现牦牛INHBA基因的核苷酸序列与普通牛、绵羊、人、鼠和猪的同源性分别为99.84%、97.97%、91.41%、87.79%和91.94%, 氨基酸序列同源性分别为99.53%、98.82%、95.77%、93.88%和93.88%, 同时进化树分析发现, 牦牛与牛亲缘关系最近, 绵羊次之(图3).

图2 牦牛与牛INHBA基因编码区序列比对结果
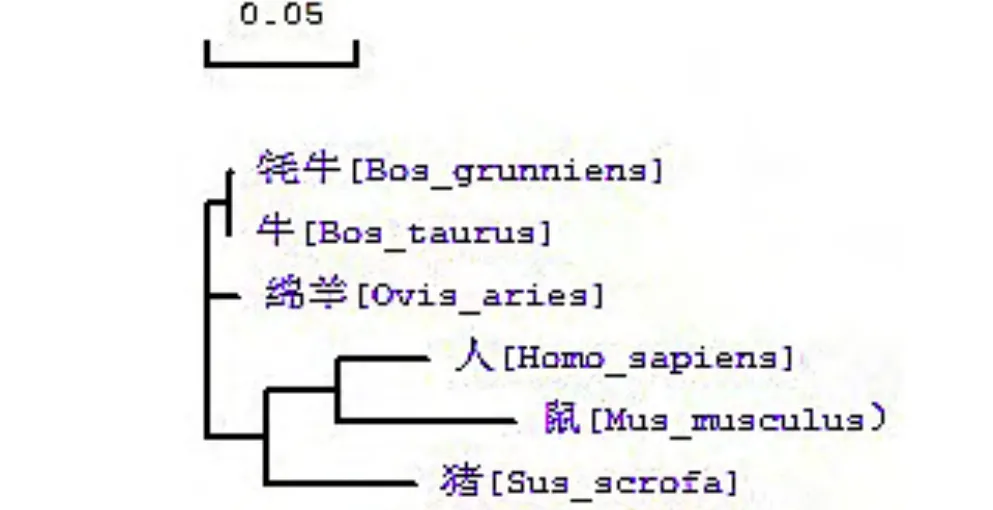
图3 不同物种INHBA基因进化树分析
2.3 牦牛INHBA蛋白质功能分析和结构预测
2.3.1 理化性质分析
利用在线蛋白分析软件(http://www.expasy.org/cgi-bin/protscale.pl)中ProtParam程序分析牦牛INHBA蛋白质的基本性质.牦牛INHBA蛋白分子量为102661.5 Da, 等电点PI﹦4.99, 该蛋白质不含任何Trp残基, 其不稳定指数为45.45(不稳定系数>40为不稳定蛋白, 不稳定系数<40为稳定蛋白), 属于不稳定蛋白, 脂质指数为25.04,Hydropathicity (GRAVY)为0.834, 表现为疏水性, 属结构蛋白.
2.3.2 疏水性及跨膜结构预测
利用Expasy在线分析软件ProtScale程序对牦牛INHBA基因疏水性进行分析(图略).该蛋白质的疏水性最小值为-0.633, 最大值为 2.422, 不易形成 α螺旋和跨膜结构, 属于具有疏水性蛋白.利用在线分析软件TMHMM-2.0、TMPRED预测结果表明, 牦牛INHBA无跨膜结构, 仅具有2个较高可能性的跨膜区.
2.3.3 亚细胞定位预测
使用POSRTⅡ在线分析程序, 发现牦牛的INHBA蛋白主要定位于细胞质(52.2%)和细胞核(21.7%),但在分泌系统囊泡(4.3%)、细胞骨架(4.3%)、液泡(4.3%)、高尔基体(4.3%)、线粒体(4.3%)和过氧化物酶体(4.3%)等细胞器中也有少量分布.分别用人工神经网络模型和隐马尔可夫模型进行蛋白核定位信号分析(http://www.cbs.dtu.dk/services/NetNES/), 发现牦牛的INHBA蛋白无潜在的核定位信号结构特征.
2.3.4 磷酸化位点预测
用NetPhos 2.0 Server在线磷酸化分析软件对牦牛INHBA进行磷酸化位点分析, 发现牦牛该蛋白存在11个磷酸化位点, 分别位于27、76、114、298、420、421、527、613、726、985、1195 bp处, 仅存在苏氨酸(Thr)中.
2.3.5 信号肽及CpG岛预测
利用在线 SignalP 4.0 Server 程序进行蛋白质序列的信号肽预测, 其中C 值代表切割位点分值、Y 值代表从C 与Y 值衍生的切割位点预测分值, S 值代表氨基酸的位置.当SP(signal peptide)为“YES”, 表示存在信号肽,SP为“NO”, 表示不存在信号肽.牦牛INHBA蛋白不存在信号肽.在线生物软件CpG Island Searcher 预测CpG岛, 发现牦牛INHBA蛋白中存在一个CpG岛, 在核苷酸序列中起始于3 bp处, 结束于587 bp处, 长585 bp, 其中GC含量为56.4%, ExpCpG值为0.652.
2.3.6 保守结构域预测
通常蛋白质高级结构中包含着许多功能结构域, 不同的功能结构域各司其职决定着该蛋白的特殊功能.通过对保守功能结构域的预测, 推测出蛋白质的生物学功能.利用NCBI在线CDD v 3.10分析软件对牦牛INHBA蛋白的保守结构域进行预测(图4).INHBA氨基酸90~725位是转化生长因子-β肽, 此肽被称为延迟关联肽(LAP)的TGF-β, 其中LAP是二硫化物连接到TGF-β结合蛋白上形成的一种同型二聚体; 同时在960~1278位是转化生长因子-β(TGF-β)超家族, 家庭成员作为二硫键连接的同源或异源二聚体发挥功能.TGFB是一种多功能的肽,其控制细胞增殖, 分化, 并且在不同细胞类型中功能各异.
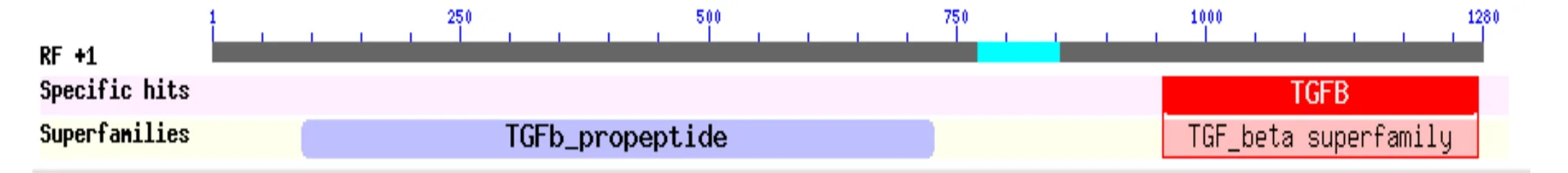
图4 INHBA蛋白的保守结构域
2.3.7 二级结构预测
通过HNN在线分析软件对牦牛INHBA蛋白二级结构进行预测(图5).该蛋白有109个α螺旋(Alpha helix Hh),占全结构的25.65%; 延伸链(Extended strand Ee)有77个, 占全结构的18.12%; 16个β转角(Beta turn, 3.76%); 无规则卷曲(Random coil Cc)有223处, 占全结构的52.47%.

图5 INHBA蛋白的二级结构预测
3 讨论
作为影响动物繁殖性状的候选基因, 抑制素基因在绵羊[15]、牛[16]、猪[17]、人[18]和鼠[19]上的结构已经阐明, 本文首次克隆了牦牛INHBA基因, 其中编码区长为1277bp, 编码426个氨基酸, 通过与其他物种的进行比对, 牦牛与普通牛和绵羊的核苷酸和氨基酸序列的同源性皆高达95%以上, 对牦牛INHBA蛋白进行功能分析和结构预测, 显示该蛋白也表明INHBA主要定位于细胞质和细胞核, 无跨膜结构.
由于抑制素对FSH分泌具有反馈抑制作用, 所以利用抑制素免疫可以不同程度的提高牛、绵羊、猪等的排卵率和受精率, 而其中INHBA基因对动物的繁殖性能的影响主要集中在羊的研究上.Leyhe[20]发现绵羊INHBA基因座Taq IA等位基因频率与绵羊品种平均产羔数呈正相关, Hiendleder通过391只Merinolandschafe母羊1585窝产羔数的动物模型分析证实了INHBA基因对绵羊的产羔数有显著影响[21].庄海滨对绵羊抑制素INHBA基因的研究中证明,INHBA基因上存在多个多态性位点, 且其中有的基因位点对绵羊的产羔数具有影响作用[22].彭志兰在对济宁青山羊的研究中也同样证明,INHBA基因对该山羊产羔数具有影响[23].目前牦牛上INHBA基因的研究较少,INHBA基因在牦牛上是否存在多态性并未被证实, 通过比对发现牦牛与绵羊的同源性高达97.97%, 而INHBA基因多态性对绵羊繁殖性状的影响是否适用于牦牛有待进一步研究.
[1]马勇江, 马毅.抑制素及其对动物繁殖的影响[J].甘肃畜牧兽医, 2000, 30(5): 38-40.
[2]张果平, 黄永宏, 李峰.抑制素/激活素和卵泡抑素对卵巢功能的调节[J].畜牧兽医杂志, 2002, 21(6): 22-27.
[3]MASSAGUE J.The transforming growth factor beta family [J].Ann Rev Cell Biol, 1990, 6: 597-641.
[4]ROBERTS AB, FLANDERS K C, KONDAIAH P, et al.Transforming growth factor beta: biochemistry and roles in embryogenesis,tissue repair and remodeling and carcinogenesis [J].Recent Prog Horm Res, 1988, 44: 157-197.
[5]KINGSLEY DM.The TGF-β superfamily: new members, new receptors and new genetic tests of function in different organisms [J].Genes Dev, 1994, 8: 133-146.
[6]PANGAS SA, WOODRUFF TK.Activin signal transduction pathways [J].Trends Endocrinol Metab, 2000, 11: 309-14.
[7]KANEKO H, NAKANISHI Y, AKAGI S, et al.·Immunoneutralization of inhibin and estradiol during the follicular phase of the estrous cycle in cows [J].Biol Reprod, 1995, 53(4): 931-939.
[8]ROSER JF, MCCUE PM, HOYE E.Inhibin activity in the mare and stallion [J].Domest Anim Endocrinol, 1994, 11(1): 87-100.
[9]FINDLAY JK, CLARKE IJ, ROBERTSON DM.Inhibin concentrations in ovarian and jugular venous plasma and the relationship of ihnibin with follicle-stimulating hormone and luteinizing hormone during the ovine estrous cyle [J].Endocrinology, 1990, 126(1):528-535.
[10]NAMBO Y, KANEKO H, NAGATA S, et al.Eeffct of passive immunization against ihnibin on FSH secretion folliculogenesis and ovulation rate during the follicular phase of the estrous cycle in mares [J].Theriogenology, 1998, 50(4): 545-557.
[11]SHI F, MOCHIDA K, SUZUKI O, et al.Development of embryos in superovulated guinea pigs following active immunization against the ihnibin alpha-subunit [J].Endocr J, 2000, 47(4): 451-459.
[12]KOGO H, TAKASAKI K, TAKEO S, et al.A role of prostaglandin in the secretion of ihnibin and oestradiol-17beta in equine chorionic gonadotrophin-primed rats [J].Eur J Pharmacol, 1993, 231(3): 481-484.
[13]《中国牦牛学》编委会.中国牦牛学[M].成都: 四川科学技术出版社, 1989.
[14]钟金城, 赵素君, 陈智华, 等.牦牛品种的遗传多样性及其分类研究.中国农业科学, 2006, 39(2): 389-397.
[15]FORAGE RG, RING JM, BROWN RW.Cloning and sequence analysis of cDNA species coding for the two subunits of inhibin from bovine follicular fluid[J].Proc Natl Acad Sci USA, 1986, 83(10): 3091-3095.
[16]RODGERS RJ.Cloning of the inhibin/activin beta B subunit gene from the Booroola merino sheep[J].J Mol Endocrinol, 1991, 6(1):87-93.
[17]MASON AJ, HAYFLICK JS, LING N.Complementary DNA sequence of ovarian follicular fluid inhibin show precursor structure and homology with transforming growth factor-beta[J].Natrue, 1985, 318(6047): 659-663.
[18]MASON AJ, NIAFL HD, SEEBURG PH.Structure of two human ovarian inhibins[J].Biochem Biophys Res Commun, 1986, 135:957-964.
[19]WOODRUFF TK, MEUNIER H, JONES PB.Rat inhibin: molecular cloning of alpha- and beta- subunit complementary deoxyribonucleic acids and expression in the ovary[J].Mol Endocrinol, 1987, 1(8): 561-568.
[20]LEYHE B, HIENDLEDER S, JAEGER C, et al.Pronounced differences in the frequency ofTaqI βA-inhibin alleles between sheep breeds with different reproductive performance[J].Anim Genet, 1994, 25: 41-43.
[21]HIENDLEDER S, JAEGER C, LEYHE B, et al.Mendelian inheritance of aTaqI polymorphism at the ovine βb-inhibin locus[J].Animl Breed Genet, 1992b, 109:320.
[22]庄海滨, 储明星, 李学伟.绵羊抑制素βA基因多态性及其与产羔数关系的研究[J]农业生物技术学报, 2007, 15(1): 52-57.
[23]彭志兰, 储明星, 陈宏权.抑制素βA基因多态性及其与济宁青山羊高繁殖力关系[J]农业生物技术学报, 2007, 15(5): 901-902.
Molecular cloning and sequence analysis of theINHBAgene in yak (Bos grunniens)
MU Xiao-kun1, ZI Xiang-dong2, BI Lin3
(1.Biology Department, Zhaoqing College, Zhaoqing 526061, P.R.C.; 2.College of Life Science and Technology, Southwest University for Nationalities, Chengdu 610041, P.R.C.; 3.Qianwei County Animal Husbandry Bureau, Qianwei 614400, P.R.C.)
The specific primers were designed according to reference sequence of Bos taurus in GenBank.Using the total RNA extracted from yak ovarian tissue as template, cDNA sequence ofINHBAgene of yak was cloned by RT-PCR and then the sequence was analyzed.The results demonstrated that 1360bp was cloned, with the coding region of 1277bp encoding 426 amino acids.There were two different bases between Bos taurus and Bos grunniens in the coding region.Nucleotide sequence similarities of theINHBAgene in Bos grunniens are compared with Bos taurus, Ovis aries, Homo sapiens, Mus musculus, Sus scrofa were 99.84%, 97.97%, 91.41%, 87.79%, and 91.94%, respectively, and the amino acid sequence similarities of theINHBAprotein in Bos grunniens were 99.53%, 98.82%, 95.77%, 93.88%, and 93.88% respectively.Structural analysis of protein demonstrated that theINHBAprotein which was difficult to form Alpha helix and Membrane structure, was relatively conservative hydrophobic proteins.
Bos grunniens;INHBA; cloning; sequence analysis
S823
A
1003-4271(2014)02-0173-06
10.3969/j.issn.1003-4271.2014.02.03
2013-12-21
穆晓琨(1988-), 男, 助教, 硕士, 研究方向: 遗传学; E-mail:x_laws@126.com.
中央高校基本科研业务费专项资金项目(项目编号: 12NZYTH07).
