生活方式对延缓老年人认知功能衰退的研究
2014-05-23周成林
徐 畅,周成林,马 阳
机体衰老过程中,认知功能随龄性衰退最明显,从脑无病变无症状到大脑改变无明显症状,逐步发展成轻度认知功能障碍(Mild Cognitive Impairment,MCI)和严重认知功能障碍——阿尔茨海默病(Alzheimer disease,AD)。流行病学研究指出,老年人群中MCI患病率高达10%~30%[2],年均15%的MCI可转化为AD[72]。AD患者认知功能受损且伴有严重的行为异常,已经成为继心脑血管病、恶性肿瘤之后危害老年人生命质量的主要疾病之一。因此,老年人认知功能衰退的预防和早期干预,是近年来学者们关注的一个重要问题。
认知功能衰退(Cognitive Decline),是指人脑加工、储存和提取信息的能力下降现象,表现在学习记忆、认知加工速度、执行功能、语言理解表达等方面。不同认知功能具有年老化差异性,记忆力衰退是最常见的老化现象,而执行功能是个体有效启动并完成意图性活动的能力,不仅与老年人日常生活联系最为紧密,同时还是许多神经系统疾病的前期基础。此外,相对于其他认知能力,记忆力衰退最早出现,执行功能下降最为明显,故相关研究多聚焦于这两个认知功能子成分。脑衰老形态功能学研究表明,突触及树突具有可塑性,在正常脑衰老过程中,特定脑区(如海马等)神经元联接会出现一定程度消失,但依靠突触和树突形成的新环路可以有效补偿由其带来的神经结构缺陷[76]。这一结构的改变与修复为认知功能衰退干预提供了重要依据。
老年人认知功能衰退的发生发展受很多因素作用,如图1分析可发现,上述因素可分为人为可控和非人为控制两类,如受教育程度和职业类型是认知功能的保护因素[42],体力活动缺乏、不合理膳食和吸烟等不良生活方式可加速认知 损 害[9,69,84]。积 极 体 力 活 动 与 合 理 膳 食 结 构 被誉为健康生活方式的两大重要组成部分,然而,生活方式如何才能推迟脑衰老的发生和延缓认知功能衰退的速度呢?体力活动与膳食结构等因素间是否互为影响?为此,本文就体力活动和膳食结构对老年人认知功能衰退的影响机制进行探讨,以期为制定认知功能衰退干预策略、提升老年人生命质量提供参考与借鉴。
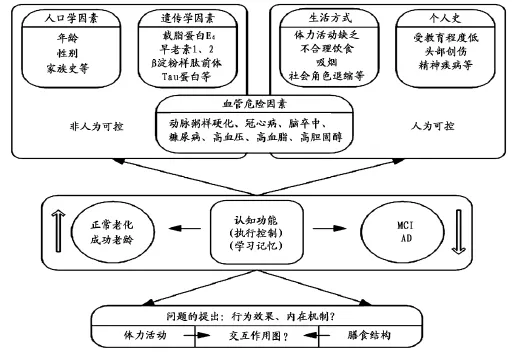
图1 认知功能衰退发生发展的影响因素Figure 1. The Factors Affecting the Onset and Development of Cognitive Function Decline
1 体力活动对老年人认知功能的影响
体力活动(physical activity,PA)是任何由骨骼肌收缩引起的能量消耗高于休息状态的身体运动,日常生活中的体力活动包含工作、家务劳动、体育锻炼和娱乐活动等内容。积极的体力活动可有效延缓老年人认知功能的衰退,但是体力活动的方式、活动量、强度、持续时间及能量消耗等协同因素是“剂量效应”的关键,相关研究成果聚焦在以下3个方面。
1.1 体力活动方式对认知功能的影响
研究者们探讨了有氧运动、无氧运动和身心运动等体力活动方式的影响效果,其中针对有氧运动的研究较多。大量实证研究表明,快步走、骑车、慢跑、舞蹈、游泳等有氧运动会对老年人认知功能产生正性影响[33、75]。Laura D.Baker等(2010)[49]对55~85岁 MCI患者6个月有氧运动和拉伸运动干预的对比研究得出,与拉伸运动组相比,有氧运动组被试完成symbol digit modality任务120s内回答正确数目明显增加(P=0.05),Verbal Fluency任务正确率明显提高(P=0.01),Trails B任务反应时间明显缩短(P=0.04)。另一项针对179名58~81岁健康老年人研究也表明,为期1年的有氧运动干预在提高执行功能方面发挥重要作用,其中142名被试干预后背外侧前额皮质灰质体积显著增加,为有氧运动与执行功能的中间调节变量,有氧运动可能通过延缓特定区域脑萎缩进而影响认知功能[88]。游泳运动因具有全身参与、心肺功能和关节承受压力小、运动损伤发生率低等特点深受老年人群喜爱。一些研究考察了游泳(封闭式)与网球、乒乓球和篮球等开放式运动项目对认知功能的影响差异,结果表明开放式运动组在执行Go/NoGo、Stop-signal任务的反应速度、准确性更好,N2成分潜伏期更短,波幅更大,具有更好的抑制控制 能 力[26,86]。
以肌肉力量训练为代表的无氧运动能够提升正常认知老年人的注意力和工作记忆[67]。Teresa 等(2010)[81]将155名65~75岁妇女随机分为每周1次、每周2次阻力活动组和控制组。每次课程时间60min,包括热身、阻力训练内容和放松3个环节,采用Stroop任务考察被试选择注意和冲突化解能力。研究结果表明,12个月阻力活动干预对老年女性的选择注意和冲突化解能力产生积极影响(P=0.03),每周1次和每次2次阻力活动干预分别提高Stroop任务表现12.6%和10.9%,而控制组则下降0.5%。然而,也有一些研究中未能发现大肌肉群力量和平衡能力训练对老年人任务转换能力的正性作用,可能与被试基础水平差异度大、干预周期过短和样本量小等因素有关[45、55]。由此,Patrick(2010)运用 Meta技术对29项实证研究(总样本量达2 049名)进行元分析得出,有氧与无氧运动相结合的综合干预对老年人注意力、工作记忆保护和改善效果强于单独有氧或无氧运动干预,原因可能是综合干预方式更有助于降低心脑血管危险因素(如高血压等),缓解脑白质退化和脑组织缺血缺氧[61]。
以太极拳、瑜伽、气功等代表的身心活动因拥有有氧、力量和柔韧的综合特点而被国内外研究者关注。张楠楠等(2006)[5]选择53名练习太极拳活动半年以上的健康中老年人为锻炼组,48名无体育锻炼习惯为对照组。认知功能评定包括平均反应时、最佳反应时、手脚协调技能、手臂稳定性、记忆能力、注意集中时间、注意分散次数和表象旋转。两组被试分为45~54岁、55~64岁、65~74岁3个年龄段进行比较,锻炼组按锻炼年限分为≤3年、4~6年、≥7年进行组内比较,93人进入结果分析。结果表明,两组被试的认知能力均有随龄衰退趋势,锻炼组3个年龄段各个指标(最佳反应时除外)均优于对照组(P<0.05);锻炼年限长者的认知能力评分均优于锻炼年限短者(P<0.05)。可见,长期进行太极拳练习有利于老年人的认知保 护和 促 进[51,53,80]。
综上可以认为,不同方式的体力活动对老年人认知功能保持有积极影响作用。
1.2 中等(负荷的)体力活动对老年人认知功能影响效果
体力活动之所以能够延缓老年人认知功能衰退,是通过体力活动促进机体的能量代谢过程,而要达到能量代谢的增强,必须适度负荷才能实现。相关研究成果表明,长期坚持中等强度体力活动能够有效保护认知功能,并能降低老 年 人 患 MCI或 AD 的 危 险 系 数[82、93]。Boucard等(2012)结合体力活动问卷和佩戴活动记录器获取过去和当前体力活动参与数据,然后以两个变量的z-score来界定和控制运动强度和能量消耗。研究表明,短时中等强度有氧运动干预能有效提高老年人抑制控制(Flanker任务)能力、干预组 P3电位潜伏期较控制组明显缩短[12,44]、从事中、高强度体力活动被试大脑左尾部激活容量与低强度相比增加25%,从而促进认知功能[74]。然而,也有部分研究提出,高强度体力活动易引起运动疲劳,会选择性地损害执行功能[83]。鉴于此,多数研究推崇老年人群从事中等强度体力活动较为合理。Patrick J Smith(2009)[61]对运动干预周期在6周~18个月不等的实证研究进行元分析得出,干预周期的长短与老年人注意力和处理速度的提高程度相关,干预周期越长,其注意力和处理速度提高幅度越大,少于12周的干预不足以产生改善认知功能的效果[55、75]。
1.3 体力活动有效延缓老年人执行功能和记忆力的衰退
机体在随龄衰老过程中,身体机能常以反应速度和体能减退为早期表现,而认知功能则多以记忆力和执行功能衰退为早期表现。Kramer(1999)提出,体力活动对老年人执行功能影响最为明显的假说[47],相关学者开展了一系列实证研究。Colcombe等(2004)[18]通过对18项随机控制实验研究进行元分析得出,有氧运动对执行功能任务影响最为明显,影响效应ES值为0.68,而控制任务、空间任务、速度 任 务 分 别 为 0.46、0.42、0.27。Matthews 等(2008)[53]的研究发现,10个月太极拳练习显著提高了老年人(平均76.5岁)的连线和画钟测试成绩。由于数字-符号替换成绩改变不显著,这一结果提示,太极拳训练可以促进执行功能,但不能提高一般认知功能。这与Ann等(2008)[7]和 Taylor-Piliae等(2010)[80]研 究 发 现,体 力 活 动对执行功能改善效果更好的结论一致,并提示digit-letter、plus-minus、Stroop、Erikson Flanker、Go/NoGo、Stop-signal、verbal-spatial running span、the n-back task等是执行功能评价的敏感指标,它们与注意集中、信息加工和行为控制等心理活动有关。
Erickson等(2009)[20]在发现老年人体适能水平与左(t=5.45;β=0.45;P<0.001)、右(t=4.38;β=0.36;P<0.001)侧海马容量呈显著正相关后,进一步探讨了1年步行干预对120名改编版 MMSE得分不低于51分、55~80岁老年人空间记忆的影响作用,结果表明,步行干预组被试左、右海马区容量分别增加2.12%和1.97%,控制组被试分别减少1.40%和1.43%,并选择性激活了前海马区包括齿状回、菌丝层和CA1分支;血液中BDNF含量变化、空间记忆任务完成准确率与左、右海马容量变化呈显著正相关(r=0.36,r=0.37,P<0.01)。对于非 AD老年人而言,海马容量每年以1%~2%的比例萎缩,从而大大增加了罹患MCI和AD的危险。上述研究的结果提示,有氧运动干预可有效增加海马容量2%左右,相当于健康无积极运动习惯老年人海马容量1~2年的正常衰退速率。
2 膳食结构对老年人认知功能的影响
膳食结构与老年人认知功能关系密切,相关研究聚焦在探讨合理膳食(如低碳水化合物、不饱和脂肪酸、膳食纤维和特定营养素等)与不合理膳食结构(高脂肪、高胆固醇和高热量饮食等)对老年人认知功能的影响作用。
2.1 合理的膳食结构可延缓老年人认知功能衰退
20世纪90年代初,研究者们开始关注膳食与认知的关系,有两项大样本、长时间跟踪研究比较有代表性。Morris等 (2004)[54]借 助 Howard食 物 摄 入 频 率 问 卷 对2 560名65岁以上无心脏病、脑卒中和糖尿病老年人调查发现,饱和脂肪摄入(P=0.04)和反式不饱和脂肪(P=0.07)摄入与老年人认知功能衰退显著正相关,多不饱和脂肪酸与饱和脂肪酸摄入比值(PUFA-SFA Ratio)与认知衰退趋势呈显著负相关。另一项长达21年的跟踪研究也得出,与大量摄入多不饱和脂肪和养成经常吃鱼习惯的被试相比,中年时期摄入大量饱和脂肪被试的MMSE得分和前瞻记忆任务正确率明显降低(P=0.05),在调节人口统计学、血管危险因素及ApoEg4等位基因等变量后患MCI的危险系数明显增加(P=0.06),PUFA-SFA Ratio与精神运动速度、执行功能任务正确率成正相关[21]。随着研究的深入,膳食结构、营养成分逐渐成为焦点。Wengreen等(2009)[36]按照美国健康饮食标准,将合理膳食界定为:低脂肪牛奶、低脂肪奶制品、水果和果汁、蔬菜和蔬菜汁(不包括土豆)、谷物、坚果。对3 634名65岁以上老年人的基线测试中,健康膳食高分被试的MMSE得分高出低分被试1.8分(P=0.001),此趋势在11年的跟踪测试中进一步加强,高分被试的下降幅度显著小于低分被试(P=0.001)。Yian Gu等(2010)[92]则通过对大样本调查数据进行降秩相依回归分析,明确合理膳食结构为高摄入色拉调味品、坚果、鱼类、番茄、禽肉、十字花科蔬菜、水果和绿叶蔬菜以及低摄入高脂牛奶、生肉、黄油,相关营养成分如w-3和w-6多元不饱和脂肪酸、叶酸、维他命E和B12、低饱和脂肪酸能够抑制AD的发生发展。
低碳水化合物饮食对认知功能的保护作用在6~54周 不 等 的 干 预 研 究 中 被 证 实[48,89]。 例 如,Grant 等(2009)[32]的研究得出,长达1年的低碳水化合物膳食干预提高了肥胖老年人的工作记忆和信息处理速度。其次,流行病学研究发现,橄榄油和海鱼中富含的不饱和脂肪酸可改善老年人心血管和免疫功能,从而降低认知损害和罹患 AD 的 危 险[40]。Martha等 (2005)[52]对65岁 以 上 芝 加哥老年人的6年跟踪研究发现,混合类型鱼类摄入与认知功能衰退速度相关,每周有1次鱼类摄入的下降速度减慢10%,每周有2次或以上为13%,增加omega-3多不饱和脂肪酸摄入可以显著提高MCI患者认知水平[17]。但也有研究未曾发现该效应,研究者分析可能与不饱和脂肪酸的类型、剂量控制和被试基线水平有关[8]。作为合理膳食必不可少的成分,膳食纤维在保持消化系统健康上扮演着重要角色,不仅可以预防心血管疾病、癌症和糖尿病,还可延缓老年人认知功能衰退。因此,地中海沿岸国家以蔬菜水果、五谷杂粮、豆类和橄榄油为主、富含大量膳食纤维的饮食方式受到研究者的关注[71]。Scarmeas等(2009)[66]通过回顾调查美国纽约老年人7种食物(豆类、蔬菜、水果、牛奶、肉类、鱼类、谷物)的摄入情况计算地中海饮食指数,通过Cox比例风险模型分析得出,地中海饮食指数越高,MCI发生率及MCI向AD转化率则越低,与地中海饮食低得分被试相比,中、高得分被试发生MCI的风险分别降低17%(P=0.24)和28%(P=0.05),转化为 AD的风险分别降低45%(P=0.01)和48%(P=0.02)。而另一项在法国波尔多的类似研究只得出,地中海饮食指数与MMSE得分显著相关,原因可能是 Feart Catherine(2009)[14]研究的跟踪时间较短,两个国家老年人对摄入膳食的评价标准存在偏差,另外美国老年人(63%)采用维生素剂补充营养素的比例远远大于法国老年人(29%)。此外,还有研究发现,蔬菜水果(种类和摄入量)和营养素(铜、锌元素等)可延缓认知功能衰退,例如,蓝莓和葡萄酒富含以花青素和白藜芦醇为代表的多酚类化合物具有抗氧化作用,可提高细胞内游离谷胱甘肽活性,增强大脑细胞信号传导,从而产 生 神 经 细 胞 保 护 作 用[65,87,91]。
2.2 不合理的膳食结构会加速老年人认知功能衰退
全国营养调查研究结果显示,我国居民膳食中热量分配不合理,脂肪摄入过高,长期摄入高脂肪“垃圾食品”不仅可以诱发一系列慢性疾病,而且,实证研究也证实,高脂肪 膳 食会 造 成 严 重 认 知 损 害[50,70]。 Winocur等 (2005)[30]参照西方国家人群脂肪摄入最高限值,制作实验组高龄大鼠饲料,控制高饱和(牛油、猪油)或不饱和(豆油)脂肪摄入占40%卡路里。组间和组内比较结果显示,3个月高脂摄入使老龄大鼠空间、短时和长时学习与记忆能力严重受损。高胆固醇膳食损害认知功能最初见于Sparks等(1994)[19]的研究,Yaffe等(2002)[90]对1 037名罹患 冠 心病、无AD症状绝经后妇女的4年跟踪研究也发现,总胆固醇和低密度脂蛋白水平越低,记忆、注意、言语、定向和视觉空间技能测试得分越高,约可降低50%的认知损害风险。大量动物实验进一步证实了高胆固醇饮食的认知损害作用,如 Ullrich等(2010)[15]对高龄大鼠的研究表明,5个月高胆固醇饮食组(胆固醇含量增加5%)的血胆固醇显著高于控制组和正常饮食组,出现记忆障碍、胆碱能系统功能障碍以及类似AD病理特征,如炎症、皮质β淀粉样蛋白和Tau蛋白沉积和微出血。其次,研究者还发现,高热量膳食也会增加认知损害风险,Aβ缩氨酸斑块随龄增长与其认知水平的下降具有相关性,减少30%碳水化合物摄入可降低大脑皮质中Aβ1-40和Aβ1-42缩氨酸成分,从而减少β淀粉样蛋白沉积[60,89]。除碳水化合物外,脂肪、蛋白质摄入同样可以产生大量热量,适当增加脂肪、蛋白质中的能量摄入和控制碳水化合物中的热量摄入,则罹患 MCI或 AD的 风 险 越 小[28,65]。
如何评定膳食结构和认知功能是此类研究的重要环节。目前多采用食物摄入频率问卷、24h膳食回顾、膳食日记法。实证研究中多采用半定量或定量食物摄入频率问卷,对每份食物的外形大小和摄入量进行量化,同时结合24h回顾法、膳食日记或营养素生化指标检测法。前文已提及的2项研究[36、92]还通过参照相关标准、多因素回归、量化评分等方法构建合理膳食结构以提高研究生态效应。例如Yian Gu等(2010)的研究将确定的合理膳食结构与地中海饮食结构进行Pearson相关分析,两者显著相关(r=0.35;P<0.001),并按照降秩相依回归各营养成分,其载荷量依次排序为w-6多元不饱和脂肪酸(48.75)、w-3多元不饱和脂肪酸(36.34)、饱和脂肪酸(19.37)、维他命E(13.85)、维他命 B12(6.05)、叶酸(5.30)。与地中海饮食结构相比,该研究确定的合理膳食结构中各营养成分信息更加具体,而且针对性更强[92]。
简 易 智 能 状 态 问 卷 (Mini-mental state examination,MMSE)和蒙特利尔认知评估问卷(Montreal cognitive assessment,MoCA)是流行病学研究中使用率较高的两个工具。在实际运用中,研究者们通过比较研究得出[35,57],MMSE易识别AD症状,MoCA在筛查MCI患者时较MMSE的敏感度高,建议先用MMSE筛选出AD患者,再使用MoCA区分正常认知和MCI患者。除此之外,测试种类繁多,可根据所考查的不同认知功能归类:学习记忆(Verbal Paired associate learning、Benton Visual Retention、Free and Cued Selective Reminding、Einstein测试等),心理灵活性(Stroop、Purdue Peg Board、Wechsler数字编码任务等),言语流畅、理解与表达(Isaacs Set、类别流畅、波士顿命名任务等),执行功能(连线、画钟、Go/NoGo任务等)。
综上可认为,合理的膳食结构可以延缓老年人认知功能衰退,降低罹患认知功能障碍或老年性痴呆的风险系数,评定膳食结构与认知功能的方法可依据研究任务而定。
3 体力活动与膳食结构的交互作用影响认知功能
积极的体力活动与合理的膳食结构对老年人认知功能均能起到保护作用,但两者联合作用是否可以达到1加1大于2的效果,国内外学者以此为假设的研究为数不多。Molteni等(2004)最初从在分子水平考量了运动与高脂肪膳食两者对大鼠学习记忆能力的相互影响,研究结果指出,运动可通过增加分子磷酸化水平影响突触蛋白I和细胞核内转录因子环磷酸腺苷反应元件结合蛋白(CREB)的激活状态,进而逆转高脂肪膳食对突触和行为可塑性的损害,扭转BDNF下降趋势[56、64]。值得 关注的是,大量 动物实验已证实,长期规律的有氧运动可通过增加大鼠海马组蛋白乙酰化酶(HAT)活性和降低组蛋白去乙酰化酶(HDAC)活性诱导组蛋白乙酰化,影响BDNF基因启动子Ⅳ区域组蛋白H3乙酰化和DNA甲基化,调控相关基因表达水平和海马神经突触的兴奋性,进而影响记忆和行为表现[94]。
高强度体力活动可削弱不合理膳食对记忆损害的程度[11,68]。一项针对198名65~84岁健康老年人的研究,将健康生活方式界定为BMI<22、饮食富含蔬菜、水果、低脂肪食物和不饱和脂肪酸、每周体力活动能量消耗>13 000kcal、不吸烟、每周4~10杯酒摄入,得出健康生活方式指数得分与记忆任务得分显著正相关(P=0.004),复合生活方式指数与记忆得分的相关关系强于单一因素[25]。Baker等(2012)则在基线测试中发现,正常老化组被试随着体力活动强度的增加,脑脊液tau蛋白(r=-0.54,P=0.02)和白细胞介素-8(r=-0.70,P=0.025)的水平显著下降;干预研究结果表明,从事高强度体力活动的正常老化组被试不易受高脂肪膳食引起的神经病理性影响,对于MCI患者而言,高强度体力活动与膳食结构共同干预对脑脊液Aβ水平的调节效果更好[10]。
适度体力活动会加速合理的膳食利用效率,两者协同发挥延缓老年人认知功能衰退的效益更佳。如图2所示,机体内稳态(能量代谢)对维持神经兴奋性和突触功能十分重要,线粒体内的能量代谢可以调节BDNF和IGF-1分子激活水平,BDNF则借助P13K/Akt和 Mtor-p13k信号系统激活学习和记忆通路,如MAP激活酶、CaMKII和CREB,对突触可塑性和海马神经功能实现保护作用。例如,合理的膳食结构可通过减少β淀粉样蛋白沉积、tau蛋白异常磷酸化以及提高miRNA表达水平等路径对认知功能发挥正性作用。反之,不合理膳食摄入的高能量形成活性氧(ROS),当ROS水平超出细胞的缓冲能力后氧化应激状态,便对海马神经突触功能产生损害,而中、高强度的体力活动可消耗部分额外能量,增加氧化磷酸化水平和CREB激活状态,影响BDNF基因组蛋白H3乙酰化、DNA甲基化和改变相关基因表达,一定程度上逆转上述负面效应。这些研究成果对诠释体力活动和膳食结构对老年人认知功能交互影响机制具有指导价值。
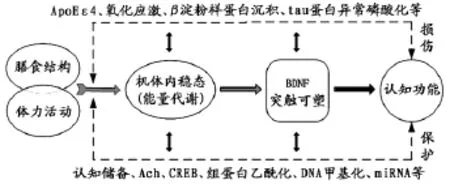
图2 体力活动与膳食结构影响认知功能的交互机制Figure 2. The Interaction Mechanism between Physical Activity and Dietary Structure on Cognitive Function
3.1 体力活动以何种方式影响认知功能
研究者先后提出了选择性提高假说[47]、心血管功能假说[23]。例如,有氧运动可通过促进有氧适能选择性提高依赖于前额叶的执行功能,但无法解释无氧运动等方式对一般认知功能的作用;再如,心血管功能是体力活动影响认知功能的生理中介变量,与体力活动引起的脑结构、BOLD及BDNF水平有关。近年新提出的两个理论关注度较高,一是身体活动/锻炼-认知中介模型[77],在阐述了体力活动对认知功能直接影响的同时,还较充分反映了身体资源、心理资源和慢性疾病3个中介变量,但对此进行验证的实证研究报道寥若晨星。二是认知储备理论[78],主要描述心理资源和体力活动对认知功能的保护效应,在神经病理学症状相似的前提下,高认知储备个体可通过潜在的认知保护和代偿机制表现出较轻程度的认知障碍和病理性变化,体力活动能通过激活个体的认知储备,进而延缓老年认知衰退或降低损害[27]。基于此开展的系列动物和人类研究表明(如图2所示),体力活动促进能量代谢平衡,刺激脑组织合成BDNF,其与胆碱能受体TrkB结合并激活相应的信号传导通路,调控神经细胞增殖与分化,促进新神经元及其突触的生长[24,58]。另外,动物实验证实,BDNF及其受体能够对抗β淀粉样蛋白的神经毒性[13,39]。但也有研究指出,MCI和AD患者血清BDNF水平显著高于正常人群,而且这种增高与 MCI、AD病情严重程度、抗抑郁治疗药物和乙酰胆碱抑制剂的应用无关[6]。
大量神经生理学和影像学研究证实,长期积极的体力活动对前额叶结构和功能的影响最为明显,前额叶是执行功能 重 要 的 物 质 基 础。Hillman(2008)[37]采 用 Erikson Flanker任务考察了不同运动强度对执行功能的影响,研究发现,从事高、中等强度有氧运动老年组前额区P3潜伏期明显较低强度老年组短,P3波幅较青年控制组大。ERP技术可记录到被试在极短时区内的大脑信息加工速度等特征,N2、P3是相关研究中关注较多的两个内源性成分,N2一般在刺激呈现后200ms左右出现极值,主要分布在脑区前部(前扣带回)等区域。而P3分布较广,且脑区后部波幅一般大于前部。毫秒级的时间精度是ERP技术的优势,但在空间精确度方面较弱势。fMRI技术则通过血氧依赖水平(BOLD)准确定位脑区的活动程度,弥补了这一不足。相关研究已发现,体力活动会对大脑额叶内侧的前扣带皮层产生重要影响,而前扣带皮层的生理功能为对正在进行的目标行为进行监控,为处理冲突信息提供信号,并依照即时任务加工要求对注意资源进行有效配置,被认为是执行功能网络中的一个高级调控结构。积极参与有氧运动可增加老年人前额叶背侧和顶叶脑区域激活度,Venkatraman等(2010)[85]干预研究进一步证实,与控制组相比,1年步行干预(每周步行150min以上)显著提高了老年组被试Digit Symbol Substitution任务准确率,且与左侧额中回和右侧顶叶皮层的激活呈显著正相关,积极体力活动组被试额区前带扣皮层产生的错误相关负电位ERN 振 幅降 低[29,41]。
载脂蛋白E4型等位基因(ApoEε4)被公认为AD发病的重要危险遗传因素,在中国家族性AD家系中,ApoEε4等位基因高频率存在。Smith等(2011)[73]依据体力活动水平和血液中ApoEε4水平将459名65~85岁被试随机分成4组,研究结果得出,高危险与高体力活动组被试在完成著名名字辨识任务过程中大脑相关区域激活最大(39.7ml),低危险与低体力活动组为4.0ml,低危险与高体力活动组为7.8ml,高危险与低体力活动组为2.6ml,高程度激活脑区包括:双侧中央前回/辅助运动区、中央前回/右中额叶脑回、左额叶脑回/左额上回、右额叶脑回/左额上回、左中颞回/角回/缘上回/楔前叶、左颞回/颞下回。国内学者崔建梅等(2012)[1]则试图从组织学层面进行探讨,连续8周递增负荷游泳运动组老龄大鼠完成八臂迷宫测试的时间和错误次数显著优于控制组,海马CA1、CA3及DG区nNOS神经元的表达水平均高于控制组,且DG区nNOS免疫阳性细胞灰度值较8周干预前显著增加。
3.2 膳食结构以何种方式影响认知功能
已报道的相关研究尚未提出成型的理论学说来揭示膳食结构对认知功能的影响路径,但总结文献可发现,研究者在人群研究证实膳食与认知功能衰退相关性后,开展了大量动物研究探讨其神经生物学机制,如海马功能、能量代谢调控激素(胰岛素、瘦素、开胃素)、中枢神经递质(Ach、BDNF、β淀粉样蛋白和tau蛋白)、相关基因表达(mRNA和miRNA)等,并试图构建相关理论依据。
海马是学习、记忆的重要解剖基础和神经中枢,海马神经突触联结与认知功能密切相关。有关糖尿病脑病的研究指出,糖尿病会引发海马神经突触数量显著减少,间隙模糊不清或连接间断,影响突触功能,导致空间学习记忆障碍。其次,以瘦素、胰岛素、开胃素为代表的能量代谢调节激素也与学习记忆能力改变有关。高脂肪、高热量膳食摄入会导致血清瘦素水平降低,损伤学习记忆能力,可能与瘦素介导“能量代谢-神经内分泌”联动调控过程有关[34,38],瘦 素 干 预 可 以 提 高 啮 齿 目 动 物 的 认 知 表 现[59,62]。同样,BNDF在学习记忆过程中发挥重要作用。记忆的存取伴随特定脑区BDNF表达水平的增加,阻断BDNF会导致学习记忆能力下降。研究发现,高脂肪摄入与皮质BDNF水平下降显著相关(P=0.030),诱发老化脑内凋亡相关蛋白FAS(属神经生长因子受体家族的凋亡相关基因)表达水平增加,抗凋亡蛋白Bcl-2(哺乳动物细胞凋亡的重要调控基因)表达下调,从而间接促进了神经细胞凋亡的发生[3,63]。乙酰胆碱(Ach)是中枢胆碱能神经系统的重要递质,相关研究指出,高脂饮食可增加体内游离脂肪酸浓度,抑制骨骼肌葡萄糖摄取,易造成大脑细胞和肝脏组织胰岛素抵抗,影响Ach合成,致使神经元冲动的传递受阻;而适当限制膳食热量摄入可提高胰岛素敏感性和(或)葡萄糖利用效率,增加不饱和脂肪酸摄入则可降低大鼠海马组织Ach水解酶活性,增加一氧化氮(NO)含量,有益于空间 记 忆 的 巩 固[4,16,65]。
老年斑被予为AD主要病理特征之一,其主要成分为β淀粉样蛋白沉积及tau蛋白异常磷酸化形成的神经纤维缠结。近年研究发现,β淀粉样蛋白、氧化应激、认知受损三者关系密切,β淀粉样蛋白吸引并激活小胶质细胞分泌炎症因子,同时产生大量自由基,加剧氧化应激过程,进而发生认知损伤。除了炎症反应,大脑皮质β淀粉样蛋白沉积,形成寡聚体抑制神经突触功能,进一步引起认知受损[22,79]。相关研究发现,鱼类摄入可对这一过程产生正性作用,可能是多不饱和脂肪酸(DHA和EPA)具有抗炎特性,在一定程度上阻止了炎症因子的产生[17,21]。Kanoski等(2010)[43]的研究发现,以高水平饱和脂肪和碳水化合物为特点的高能量膳食摄入使得mRNA表达下调,特别是脉络丛Claudin-5和-12基因表达,改变自脉管系统至海马软组织NaF1渗透性,进而影响大脑内环境稳态。除此之外,作为mRNA基因表达的重要调节因素,miRNA可在RNA诱导的RISC复合体帮助下与mRNA结合形成双链RNA阻止靶基因表达水平,从而改变大鼠的学习记忆能力[46]。
4 小结
1.中等强度(不同方式)的体力活动对老年人认知功能有积极影响作用。积极的体力活动可诱导个体的认知储备,保持额叶前扣带皮层执行功能网络的激活度,减少脑组织衰老过程的损耗,保护特定脑区(双侧中央前回/辅助运动区、左、右额叶脑回/左、右颞回等)功能。
2.合理的膳食结构可以延缓老年人认知功能衰退,降低罹患认知功能障碍或老年性痴呆的风险系数。合理膳食可通过改变能量代谢类激素水平促进能量代谢平衡,启动大脑神经元突触和树突的可塑,阻止β淀粉样蛋白及tau蛋白的神经毒性,维持大脑内环境稳态,实现认知保护作用。
3.积极的体力活动和合理膳食的合力(交互)作用可以延缓老年人认知功能衰退速率。积极的体力活动可增强合理膳食的利用率,共同介导能量代谢调控过程,影响BDNF、Ach等中枢神经递质合成,并通过组蛋白乙酰化和DNA甲基化等方式,调控相关靶基因表达水平和海马神经突触的兴奋性,进而延缓老年人认知功能衰退。
[1]崔建梅,付芳,贺继平,等.游泳运动对衰老大鼠学习记忆及海马CA1、CA3、DG区nNOS表达的影响[J].天津体育学院学报,2012,27(6):529-534.
[2]马永兴,俞卓伟.现代痴呆学[M].上海:科学技术文献出版社,2008:342-348.
[3]王昊,李莉,刘霞,等.高脂饮食对D-半乳糖老化小鼠海马神经元FAS、Bcl-2和脑源性神经营养因子表达的影响[J].中国老年学杂志,2010,30(5):669-671.
[4]肖忠新,云少君,贺晓娟,等.运动和饮食因素对脑老化小鼠学习记忆能力影响的行为学观察[J].中国康复理论与实践,2008,14(10):932-933.
[5]张楠楠,吕晓标,倪伟,等.长期太极拳锻炼改善中老年人认知能力的作用[J].中国临床康复,2006,10(26):7-9.
[6]ANGELUCCI F,SPALLETTA G,DI LULIO F,et al.AD and MCI patients are characterized by increased BDNF serum levels[J].Curr Alzheimer Res,2010,7(1):15-20.
[7]ANN L SMILEY-OYEN,KRISTIN A LOWRY,et al.Exercise,fitness,and neurocognitive function in older adults:the“selective improvement”and“cardiovascular fitness”hypotheses[J].Ann Behav Med,2008,36(3):280-291.
[8]ARENDASH G W,JENSEN M T,SALEM N J R,et al.A diet high in omega-3fatty acids does not improve or protect cognitive performance in Alzheimer's transgenic mice[J].Neurosci,2007,149(2):286-302.
[9]BADAUT J,COPIN J C,FUKUDA A M,et al.Increase of arginase activity in old apolipoprotein-E deficient mice under Western diet associated with changes in neurovascular unit[J].J Neuroinflammation,2012,9(1):132-143.
[10]BAKER L D,BAYER-CARTER J L,SKINNER J,et al.High-Intensity physical activity modulates diet effects on cerebrospinal amyloid-levels in normal aging and mild cognitive impairment[J].J Alzheimer’s Disease,2012,28(1):137-146.
[11]BAYER-CARTER J L,GREEN P S,MONTINE T L,et al.Diet intervention and cerebrospinal fluid biomarkers in amnestic mild cognitive impairment[J].Arch Neurol,2011,68(6):743-752.
[12]BOUCARD G K,ALBINET C T,BUGAISKA A,et al.Impact of physical activity on executive functions in aging:a selective effect on inhibition among old adults[J].J Sport Exe Psychol,2012,34(6):808-827.
[13]CACCAMO A,MALDONADO M,BOKOV A F,et al.CBP gene transfer increases BDNF levels and ameliorates learning and memory deficits in a mouse model of Alzheimer’s disease[J].PNAS,2010,107(52):22687-22692.
[14]FÉART C,SAMIERI C,RONDEAU V,et al.Adherence to a mediterranean diet,cognitive decline,and risk of dementia[J].JAMA,2009,302(6):638-648.
[15]ULLRICH C,PIRCHI M,HUMPEL C.Hypercholesterolemia in rats impairs the cholinergic system and leads to memory deficits[J].Mol Cell Neurosci,2010,45(4):408-417.
[16]CHANG Q,GOLD P E.Switching memory systems during learning:Changes in patterns of brain acetylcholine release in the hippocampus and striatum in rats[J].J Neurosci,2003,23(7):3001-3005.
[17]CHIH-CHIANG CHIU,KUAN-PIN SU,TSUNG-CHI CHENG,et al.The effects of omega-3fatty acids monotherapy in Alzheimer's disease and mild cognitive impairment:A preliminary randomized double-blind placebo-controlled study[J].Progress Neurosychopharmacol Biological Psychiatry,2008,32(6):1538-1544.
[18]COLCOMBE S J,KRAMER A F,ERICKSON K I,et al.Cardiovascular fitness,cortical plasticity,and aging[J].Procedings National Academy Sci US,2004,101(9):3316-21.
[19]D L SPARKS,STEPHEN W S,JOHN C H III,et al.Induction of alzheimer-likeβ-amyloid immunoreactivity in the brains of rabbits with dietary cholesterol[J].Experimental Neurol,1994,126(1):88-94.
[20]ERICKSON K I,PRAKASH R S,VOSS M W,et al.Aerobic fitness is associated with hippocampal volume in elderly humans[J].Hippocampus,2009,19(10):1030-1039.
[21]ESKELINEN M H,NGANDU T,HELKALA E L,et al.Fat intake at midlife and cognitive impairment later in life:apopulation-based CAIDE study[J].Int J Geriatr Psychiatry,2008,23(7):741-747.
[22]ESPARZA T J,ZHAO H,CIRRITO J R,et al.Amyloid-βoligomerization in Alzheimer dementia versus high-pathology controls[J].Ann Neurol,2013,73(1):104-19.
[23]ETNIER J L,NOWELL P M,LANDERS D M,et al.A metaregression to examine the relationship between aerobic fitness and cognitive performance[J].Brain Res Rev,2006,52(1),119-130.
[24]GOMEZ-PINILLA F,ZHUANG Y,FENG J,et al.Exercise impacts brain-derived neurotrophic factor plasticity by engaging mechanisms of epigenetic regulation[J].Eur J Neurosci,2011,33(3):383-390.
[25]FLOEL A,WITTE A V,LOHMANN H,et al.Lifestyle and memory in the elderly[J].Neuroepidemiol,2008,31(1):39-47.
[26]DI RUSSO F,BULTRINI A,BRUNELLI S,et al.Benefits of sports participation for executive function in disabled athletes[J].J Neurotrauma,2010,27(12):2309-2319.
[27]FRATIGLIONI L,Paillard-Borg S,Winblad B.An active and socially integrated lifestyle in late life might protect against dementia[J].Lancet Neurol,2004,3(6):343-353.
[28]GIULIO M P,JACQUELINE A E.Metabolic syndrome and the role of dietary lifestyles in Alzheimer’s disease[J].J Neurochem,2009,106(4):1503-1514.
[29]GOMEZ-PINILLA F,HILLMAN C.The influence of exercise on cognitive abilities[J].Comprehensive Physiol,2013,3(1):403-428.
[30]WINOCUR G,GREENWOOD C E.Studies of the effects of high fat diets on cognitive function in a rat model[J].Neurobiol Aging,2005,26(1):46-49.
[31]GRANHOLM A C,BIMONTE-NELSON H A,MOORE A B,et al.Effects of a saturated fat and high cholesterol diet on memory and hippocampal morphology in the middle-aged rat[J].J Alzheimers Dis,2008,14(2):133-145.
[32]GRANT D B,MANNY N,JONATHAN D B,et al.Long-term effects of a very-low-carbohydrate weight loss diet compared with an isocaloric low-fat diet after 12month[J].Am J Clin Nutr,2009,90(1):23-32.
[33]GUINEY H,MACHADO L.Benefits of regular aerobic exercise for executive functioning in healthy populations[J].Psychon Bull Rev,2013,20(1):73-86.
[34]GUNSTAD J,SPITZNAGEL M B,KEARY T A,et al.Serum leptin levels are associated with cognitive function in older adults[J].Brain Res,2008,1230(7):233-236.
[35]SIKAROODI H,YADEQARI S,MIRI S R.Cognitive impairments in patients with cerebrovascular risk factors:a comparison of mini mental status exam and montreal cognitive assessment[J].Clin Neurol Neurosurgery,2013,115(8):1276-1280.
[36]WENGREEN H J,NEILSON C,MUNGER R,et al.Diet quality is associated with better cognitive test performance among aging men and women[J].J.Nutr,2009,139(10):1944-1949.
[37]HILLMAN C H,ERICKSON K L,KRAMER A F.Be smart,exercise your heart:Exercise effects on brain and cognition[J].Nature Rev Neurosci,2008,9(1):58-65.
[38]HOLDEN K F,LINDQUIST K,TYLAVSKY F A,et al.Serum leptin level and cognition in the elderly:findings from the health ABC study[J].Neurobiol Aging,2009,30(9):1483-1489.
[39]ILL-RAGA G,RAMOS-FERNANDEZ E,GUIX F X,et al.Amyloid-βpeptide fibrils induce nitro-oxidative stress in neuronal Cells[J].J Alzheimer’s Disease,2010,22(2):641-652.
[40]ISSA A M,MOLICA W A,MORTON S C,et al.The efficacy of omega-3fatty acids on cognitive function in aging and dementia:a systematic review[J].Dement Geriatr Coqn Disord,2006,21(2):88-96.
[41]JASON R T,CHARLES H H.Cardiorespiratory fitness and acute aerobic exercise effects on neuroelectric and behavioral measures of action monitoring[J].Neurosci,2006,142(2):757-767.
[42]JEANINE M P,GEORGE W R,XUE Q L,et al.The role of education and intellectual activity on cognition[J].J Aging Res,2012,36(3):242-260.
[43]KANOSKI S E,ZHANG Y S,ZHENG W,et al.The effects of a high-energy diet on hippocampal function and blood-brain barrier integrity in the rat[J].J Alzheimer’s Disease,2010,21(1):207-219.
[44]KEITA K,YOICHI H,et al.Acute effects of aerobic exercise on cognitive function in older adults[J].J Gerontology:Psychological Sci,2009,64B(3):356-363.
[45]KIMURA K,OBUCHI S,ARAI T,et al.The influence of short-term strength training on health-related quality of life and executive cognitive function[J].J Physiol Anthropol,2010,29(3):95-101.
[46]KONOPKA W,KIRYK A,NOVAK M,et al.MicroRNA loss enhances learning and memory in mice[J].Neurosci,2010,30(44):14835-14842.
[47]KRAMER A F,SOWON H,NEAL J C.Ageing,fitness and neurocognitive function[J].Nature,1999,400(6743):418-419.
[48]KRIKORIAN R,SHIDLER MD,DANGELO K,et al.Dietary ketosis enhances memory in mild cognitive impairment[J].Neurobiol Aging,2012,33(2):19-27.
[49]LAURA D B,LAURA L F,FOSTER-SCHUBER K,et al.Effects of aerobic exercise on mild cognitive impairment:a controlled trial[J].Arch Neurol,2010,6(1):71-79.
[50]EDWARDS L M,MURRAY A J,HOLLOWAY C J,et al.Short-term consumption of a high-fat diet impairs whole-body efficiency and cognitive function in sedentary men[J].FASEB J,2011,25(3):1088-1096.
[51]MAROLLA A R.Effect of Tai Chi exercise on cognitive function during weight loss in obese older women[D].Rhode Island:University Rhode Island,2012.
[52]MARTHA C M,DENIS A E,CHRISTINE C,et al.Fish consumption and cognitive decline with age in a large community study[J].Arch Neurol,2005,62(12):1849-1853.
[53]MATTHEWS M M,WILLIAMS H G.Can Tai chi enhance cognitive vitality-A preliminary study of cognitive executive control in older adults after Tai chi intervention[J].J South Carolina Med Asso,2008,104(8):255-257.
[54]M C MORRIS,D A EVANS,J L BIENIAS,et al.Dietary fat intake and 6-year cognitive change in an older biracial community population[J].Neurol,2004,62(9):1573-1579.
[55]VOSS M W,NAQAMATSU L S,LIU-AMBROSE T,et al.Exercise,brain and cognition across the life span[J].J Appl Physiol,2011,111(5):1505-1513.
[56]MOLTENI R,WU A,VAYNMAN S,et al.Exercise reverses the harmful effects of consumption of a high-fat diet on synaptic and behavioral plasticity associated to the action of brain-derived neurotrophic factor[J].Neurosci,2004,123(2):429-440.
[57]NASREDDINE Z S,PHILLIPS N A,BEDIRIAN V,et al.The montreal cognitive assessment,MoCA:A brief screening tool for mild cognitive impairment[J].J Am Geriatrics Soc,2005,53(4):695-699.
[58]NITHIANANTHARAJAH J,HANNAN A J.The neurobiology of brain and cognitive reserve:Mental and physical activity as modulators of brain disorders[J].Progress Neurobiol,2009,89(4):369-382.
[59]OOMURA Y,HORI N,SHIRAISHI T,et al.Leptin facilitates learning and memory per-formance and enhances hippocampal CA1long-term potentiation and CaMK II phosphorylation in rats[J].Peptides,2006,27(11):2738-2749.
[60]PATEL N V,GORDON M N,CONNOR K E,et al.Caloric restriction attenuates abeta-deposition in Alzheimer transgenic models[J].Neurobiol Aging,2005,26(7):995-1000.
[61]PATRICK J S,JAMES A B,et al.Aerobic exercise and neurocognitive performance:a meta-analytic review of randomized controlled trials[J].Psychosom Med,2010,72(3):239-252.
[62]PAZ-FILHO G J,BABIKIAN T,ASARNOW R,et al.Leptin replacement improves cognitive development[J].PLoS ONE,2008,3(8):1-10.
[63]PISTELL P J,MORRISON C D,GUPTA S,et al.Cognitive impairment following high fat diet consumption is associated with brain inflammation[J].J Neuroimmunol,2010,219(1-2):25-32.
[64]PITTENGER S,DUMAN R S.Stress,depression,and neuroplasticity:A convergence of mechanisms[J].Neuropsychopharmacol,2008,33(1):88-109.
[65]ROBERTS R O,ROBERTS L A,GEDA Y E,et al.Relative intake of macronutrients impacts risk of mild cognitive impairment or dementia[J].J Alzheimer’s Disease,2012,32(2):329-339.
[66]SCARMEAS N,STERN Y,MAYEUX R,et al.Mediterranean diet and mild cognitive impairment[J].Arch Neurol,2009,66(2):216-25.
[67]SCHERDER E J,EGGERMONT L H,GEUZE R H,et al.Quadriceps strength and executive functions in older women[J].Am J Phys Med Rehabil,2010,89(6):458-463.
[68]SCHROEDER J E,RICHARDSON J C,VIRLEY D J.Dietary manipulation and caloric restriction in the development of mousemodels relevant to neurological diseases[J].Biochim Biophys Acta,2010,1802(10):840-846.
[69]SCISCO J L,LEYNES P A,KANG J.Cardiovascular fitness and executive control during task-switching:An ERP study[J].Int J Psychophysiol,2008,69(1):52-60.
[70]KANOSKI S E,DAVIDSON T L.Western diet consumption and cognitive impairment:Links to hippocampal dysfunction and obesity[J].Physiol Behavior,2011,103(1):59-68.
[71]SOFI F,CESARI F,ABBATE R,et al.Adherence to Mediterranean diet and health status:meta-analysis[J].BMJ,2008,337(7671):673-683.
[72]SILVIA V,CARLOS A,JOSE M C,et al.Effects of two different intensities of aerobic exercise on elderly people with mild cognitive impairment:a ramdomized pilot study[J].Clin Rehabilitation,2011,26(5):442-450.
[73]SMITH J C,NIELSON K A,WOODARD J L,et al.Interactive effects of physical activity and APOE-ε4on BOLD semantic memory activation in healthy elders[J].Neuroimage,2011,54(1):635-644.
[74]SMITH J C,NIELSON K A,WOODARD J L,et al.Does physical activity influence semantic memory activation in amnestic mild cognitive impairment[J].Psychiatry Res,2011,193(1):60-62.
[75]SMITH J C,NIELSON K A,WOODARD J L,et al.Physical activity and brain function in older adults at increased risk for Alzheimer’s disease[J].Brain Sci,2013,3(1):54-83.
[76]SMITH P J,BLUMENTHAL J A,HOFFMAN B M,et al.Aerobic exercise and neurocognitive performance:a meta-analytic review of randomized controlled trials[J].Psychosomatic Med,2010,72(3):239-252.
[77]SPIRDUSO W W,POON L W,CHODZKO-ZAJKO W.Using resources and reserves in an exercise-cognition model[M].Champaign:Human Kinetics,2008:3-13.
[78]STERN Y.What is cognitive reserve?Theory and research ap-plication of the reserve concept[J].J Int Neuropsychol Soc,2002,8(3):448-460.
[79]TAMAGNO E,GUGLIELMOTTO M,MONTELEONE D,et al.Transcriptional and post-transcriptional regulation ofβsecretase[J].IUBMB,2012,64(12):943-950.
[80]TAYLOR-PILIAE R E,NEWELL K A,CHERIN R,et al.Effects of Tai Chi and western exercise on physical and cognitive functioning in healthy community-dwelling older adults[J].J Aging Physical Activity,2010,18(3),261-279.
[81]TERESA L A,LINDSAY S N,et al.Resistance training and executive functions[J].Arch Intern Med,2010,170(2):170-178.
[82]THORLEIF E,DIRK S,et al.Physical activity and incident cognitive impairment in elderly persons[J].Arch Intern Med,2010,170(2):186-193.
[83]VAN DUINEN H,RENKEN R,MAURITS N,et al.Effects of motor fatigue on human brain activity:An fMRI study[J].Neuroimage,2007,35(4):1438-1449.
[84]VAN NORDEN A G,VAN DEN BERG H A,DE LAAT K F,et al.Frontal and temporal microbleeds are related to cognitive function[J].Stroke,2011,42(12):3382-3386.
[85]VENKATRAMAN V K,AIZENSTEIN H,GURALNIK J,et al.Executive control function,brain activation and white matter hyperintensities in older adults[J].Neuroimage,2010,49(4):3436-3442.
[86]WANG C H,CHANG C C,LIANG Y M,et al.Open vs closed skill sports and the modulation of inhibitory control[J].Plos One,2013,8(2):1-10.
[87]WANG L,MANSON J E,BURING J E,et al.Dietary intake of dairy products,calcium,and vitamin D and the risk of hypertension in middle-aged and older women[J].Hypertension,2008,51(4):1073-1079.
[88]WEINSTEIN A M,VOSS M W,PRAKASH R S,et al.The association between aerobic fitness and executive function is mediated by prefrontal cortex volume[J].Brain Behav Immun,2011,26(5):811-819.
[89]WITTE A V,FOBKER M,GELLNER R,et al.Caloric restriction improves memory in elderly humans[J].Proc Natl Acad Sci USA,2009,106(4):1255-1260.
[90]YAFFE K,BARRET-CONNOR E,LIN F,et al.Serum lipoprotein levels,statin use,and cognitive function in older women[J].Arch Neural,2002,59(3):378-384.
[91]YE X,BHUPATHIRAJU S N,TUCKER K L.Variety in fruit and vegetable intake and cognitive function in middle-aged and older Puerto Rican adults[J].British J Nutr,2013,109(3):503-510.
[92]YIAN G,JERI W N,et al.Food combination and alzheimer disease risk:A protective diet[J].Arch Neurol,2010,67(6):699-706.
[93]YONAS E G,ROSEBUD O R,et al.Physical exercise,aging,and mild cognitive impairment[J].Arch Neurl,2010,67(1):80-86.
[94]TIMOTHY J JAROME,FARAH D LUBIN.Histone lysine methylation:critical regulator of memory and behavior[J].Rev Neurosci,2013,24(4):375-387.
