自愿转轮运动对抑郁模型大鼠行为学、脑组织神经Y肽及中央杏仁核一氧化氮合酶表达的影响
2014-05-23崔建梅苏晓云贺继平
崔建梅,苏晓云,王 昕,贺继平
抑郁症(depression)是情感性精神障碍的主要类型,是一种以情感病态变化——主要是情绪低落为显著特征的精神性疾病,它的发病与逐渐增大的各种压力带来的应激性事件有关。应激(stress)是生物体在生存过程中受到各种各样的刺激后产生的非特异性适应性反应,一定频率和强度的应激会导致生物体产生情绪和认知等方面的障碍,诱发抑郁症。慢性不可预知性应激(Chronic Unpredictable Stress,CUMS)是近年来国内、外应用最为广泛的抑郁动物模型之一,它可模拟抑郁的核心症状——快感缺乏及行为绝望,目前被广泛运用于抑郁症的病理生理机制、抗抑郁药物研发及作用机制的研究。学习记忆能力下降是抑郁症状的重要表现,有实验表明,一定程度的应激可以引起大鼠及人类学习记忆能力的减退[4,33],而运动锻炼能降低应激导致的啮齿动物的焦虑行为,改善动物的认知功能[5]。
应激是机体的非特异性反应,以下丘脑-垂体-肾上腺皮质轴为介导,神经Y肽(neuropeptide Y,NPY)是中枢神经系统最丰富的肽类,与应激导致的摄食异常、抑郁相关行为及学习记忆等许多生理过程有关,尤其在应激导致的焦虑与抑郁样行为的病理生理机制中起重要作用[6]。NPY在应激反应中涉及的脑区主要与杏仁核、海马、下丘脑等有关。众所周知,额叶新皮质、杏仁核复合体、海马和下丘脑这4个关键脑结构的功能与人类情感活动密切相关,而杏仁核则是介导情绪的躯体反应和新皮层中参与意识、情感,特别是恐惧核团之间的联系者。进一步的研究显示,杏仁核的不同核团在情绪记忆巩固过程中有着不同功能,其中,杏仁基底外侧核是感觉信息与行为输出的情感意义之间联合学习的关键部位,加工并转达给中央杏仁核神经元,通过大量动物实验和临床实践观察,中央杏仁核(central amygdala,CeA)的功能已逐渐被了解,其与学习记忆、情绪调控和神经系统疾病,如抑郁症等情绪情感密切相关[2,7]。一氧化氮(nitric oxide,NO)作为一种神经递质在神经元之间起信息传递作用,直接和间接调节机体各种神经系统紊乱,与焦虑、抑郁行为等有关[1]。在正常生理情况下,神经元型一氧化氮合酶(nNOS)催化产生的NO作为中枢神经系统细胞的信使分子,在抑郁症发病中具有重要作用[15]。研究证实,海马、下丘脑、基底外侧杏仁核等大脑区域nNOS表达与应激及抑郁有关,那么,CeA区nNOS是否参与抑郁症的发病,有关文献较少涉及,而且,长期有氧运动改善抑郁模型大鼠学习记忆的机制尚不清楚。
本实验以中央杏仁核为研究重点,通过复制CUMS大鼠模型,观察自愿转轮运动4周后应激大鼠脑组织NPY及血浆皮质酮(Cort)含量,测试大鼠抑郁样行为、空间学习记忆能力及CeA区nNOS表达的变化,探讨自愿转轮运动改善抑郁模型大鼠抑郁样行为及学习记忆能力的可能机制。
1 材料与方法
1.1 动物及分组
雄性健康成年SD大鼠3月龄45只,体重200~220g,室温20℃±2℃,湿度55%±10%,12h昼夜循环光照,实验期间,大鼠自由摄食、饮水(应激模型组及应激运动组大鼠禁食、禁水期除外)。大鼠购回后适应环境1周,将45只大鼠随机分为3组,即正常对照组(C)、应激模型组(SM)及应激运动组(SE),每组15只,SM组及SE组大鼠单独喂养,其中,每组10只大鼠用于肾上腺指数及脑组织NPY含量测试,其余每组5只大鼠用于测试中央杏仁核nNOS的表达。
1.2 慢性不可预知性应激模型[11]
制备慢性中等不可预知应激抑郁动物模型。应激刺激为24h禁水、5min悬尾、2h束缚应激、5min冷水强迫游泳(水温4℃)、24h禁食、昼夜颠倒、20min电击足底(0.8A,每次持续4s,间隔5min),共7种刺激,每日1种,每天1次,以上刺激顺序随机安排,同种刺激不连续出现,且每种刺激在每一轮中出现的次序不同,连续4周。
1.3 试剂
血浆Cort放射免疫试剂(天津德普生物技术医学产品有限公司);NPY测试盒(南京建成生物工程研究所),nNOS测定试剂盒由武汉博士德生物工程有限公司生产。
1.4 训练方案
1)应激模型组大鼠从第2周开始接受为期4周的CUMS程序。2)应激运动组大鼠在整个实验过程中从第2周开始接受自愿转轮锻练,笼内有一可自由转动的跑轮(直径33cm,宽度10cm),动物可自由进跑轮进行锻炼,红外线检测装置和数据分析系统自动采集数据,每天接受1次CUMS程序,为期4周。3)正常对照组:在整个实验过程中,非应激模型组大鼠除了必要的例行鼠笼清洁,不做任何干扰。
1.5 测试
1.5.1 糖水偏爱实验
评定抑郁大鼠的快感缺失水平。参照Lin等[19]的方法,大鼠单笼喂养,正式实验前先训练动物适应含糖饮水12h,每笼同时给予装有1%蔗糖水的2个小瓶。随后,随机将2瓶糖水中的1瓶换成蒸馏水,适应12h;在23h的禁食、禁水后,进行糖水消耗实验,同时给予每只大鼠事先定量好的两瓶水:一瓶1%的蔗糖水,一瓶纯水。1h后,取走两瓶水计算每笼大鼠的糖水消耗量和蒸馏水消耗量。计算动物的糖水偏爱率作为糖水偏爱测试指标(糖水偏爱率=糖水消耗量/总液体消耗量×100%)。糖水偏爱率降低反映大鼠的兴趣水平降低。
1.5.2 强迫游泳实验
糖水偏爱实验后次日开始,分2天进行。将大鼠禁食16h后单独放在塑料桶中(水深20cm,直径20cm),水温25℃±1℃。强迫游泳6min,用秒表记录后4min内大鼠的累积不动时间(大鼠停止挣扎或呈漂浮状态,四肢有轻微动作以保持头部在水面)。
1.5.3 八臂迷宫实验程序
强迫游泳实验结束后第2天,所有大鼠进行八臂迷宫实验,实验前大鼠先在迷宫中适应2天,每天2次。适应时3~4只大鼠同时置于迷宫中,自由活动和摄取食物10 min,适应后进行每天2次的训练。每次训练中,八臂中只有四臂放置了食物(分别为1、3、5、7号臂),整个实验过程均维持此顺序。正式实验前所有大鼠限制饮食2天,正式实验时1、3、5、7号臂放置食物,大鼠置于迷宫中央区,15s后将门打开并开启分析测试软件,测试定时10min,大鼠可选择进入任意一臂,以摄取食物。大鼠进入有食物的臂且摄取了食物为1次正确选择;分析记忆的记录参数为错误选择的次数,重新进入放食物臂或第一次进入放食物臂而不摄取食物为工作记忆错误(working memory error,WME),进入不放食物臂称为参考记忆错误(reference memory error,RME),两者之和为总记忆错误(total error,TE)。当大鼠将4臂食物吃完或10min后实验结束,记录所需时间(total time,TT)。
1.5.4 各组大鼠肾上腺指数的测定及脑组织NPY、血浆Cort含量测试
八臂迷宫行为测试结束后即刻,各组大鼠随机选取10只称体质量,心脏取血(取血测血浆Cort含量)处死,迅速取出脑组织。将脑组织置于0.2mol/L醋酸钠溶液中,煮沸5min,擦干称重后,按每100mg脑组织1.5mL的量加入醋酸钠溶液,冰浴下匀浆。匀浆液在4℃条件下,以3 000rpm离心30min,取上清液入EP管中,-20℃保存待测,测前用pH值为7.4的PBS缓冲液1∶1稀释,具体测定按NPY放免试剂盒说明书进行。剖开大鼠腹腔,把肾上腺连同周围少量脂肪组织一起摘出,浸入生理盐水中洗净附着的血液,并将残余的脂肪组织剔除干净,用滤纸吸干表面水分,迅速称质量。
肾上腺指数=肾上腺重量(mg)/大鼠体质量(g)×100
1.5.5 脑组织的取材及免疫组织化学染色
八臂迷宫行为测试结束后即刻,每组剩余5只大鼠腹腔注射戊巴比妥钠(40mg/kg)麻醉,开胸,经常规灌注固定,脑冠状位连续冰冻切片,片厚30μm,隔4张取1张。切片经0.1%Triton X-100PBS 37℃液孵育1h,0.01M PBS液漂洗3次/10min后入0.3% 双氧水PBS液中孵育15min,然后加入nNOS血清第一抗体(1∶100)37℃孵育1h,随后加入生物素标记的羊抗兔抗体37℃孵育1h;接着入ABC液(1∶100)37℃孵育1h,DAB呈色、裱片、脱水、透明、封片。
1.6 图像分析和统计学处理
根据大鼠脑立体定位图谱确定大鼠中央杏仁核的位置(图1),用数码显微镜拍片,江苏捷达形态学分析软件对大鼠中央杏仁核nNOS阳性神经元的表达进行分析,计数nNOS阳性细胞个数、面积及灰度(400倍)。采用SPSS l8.0软件进行统计分析,数据结果用±SD表示,组间比较采用单因素方差分析(one-way ANOVA),用homogeneity of variance test进行方差一致性检验,方差齐采用LSD法检验组间差异,方差不齐采用Dunnetts法检验组间差异,检验水准α=0.05,以P<0.05表示统计学上具有显著性差异,P<0.01表示统计学上具有极显著性差异。
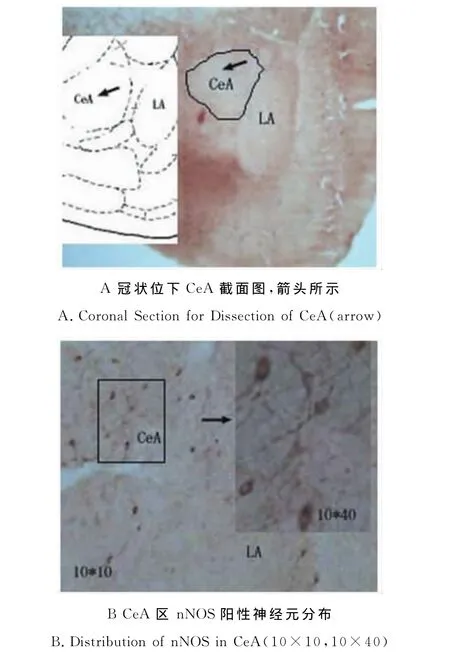
图1 本研究大鼠脑立体定位图谱Figure 1. The Rat Brain CeA in Stereotaxic Coordinates
2 研究结果
2.1 慢性应激对应激运动组大鼠自愿转轮运动的影响
应激运动组大鼠转轮距离自1~3周逐渐增加,从第1周9.46±0.46km到第3周转轮距离达到峰值21.48±0.98km,第4周转轮距离下降为17.53±0.64km。与第1周应激运动组大鼠转轮距离比较,第3周及第4周大鼠转轮距离均显著增加(P<0.01和P<0.05,表1)。
表1 本研究应激运动组大鼠每周转轮距离结果一览表Table1 Results of Weekly Running Distance in Stress Exercise Rats (±SD,n=15;km)

表1 本研究应激运动组大鼠每周转轮距离结果一览表Table1 Results of Weekly Running Distance in Stress Exercise Rats (±SD,n=15;km)
注:##P<0.01,#P<0.05,与第1周转轮距离比较(Compared with the running distance of week 1)。
第1周week 1第2周week 2第3周week 3第4周week 4应激运动组stress exercise group 9.46±0.46 15.86±0.62 21.48±0.98## 17.53±0.64#
2.2 各组大鼠糖水偏爱实验及强迫游泳实验结果
应激模型组大鼠糖水摄入量及糖水偏爱百分比均低于对照组(P<0.01,P<0.01);经过4周自愿转轮运动,应激运动组大鼠糖水摄入量及糖水偏爱百分比均高于应激模型组(P<0.05,P<0.05),而液体总摄入量3组之间比较无统计学意义(P>0.05,表2)。
强迫游泳实验中,应激模型组大鼠不动时间较对照组显著延长(P<0.01),增加幅度为148%;经过4周自愿转轮运动,应激运动组大鼠强迫游泳不动时间显著缩短(P<0.05),平均减少36%(表2)。提示,慢性应激可以导致大鼠绝望、无助及快感缺乏,而长期自愿转轮运动可以在一定程度上改善大鼠慢性应激引起的行为绝望及兴趣水平的降低。
表2 本研究各组大鼠糖水偏爱实验及强迫游泳实验测试结果一览表Table 2 Results of Sugar Water Preference and Forced Swimming Test of Rats in Various Groups (±SD,n=15)

表2 本研究各组大鼠糖水偏爱实验及强迫游泳实验测试结果一览表Table 2 Results of Sugar Water Preference and Forced Swimming Test of Rats in Various Groups (±SD,n=15)
注:##P<0.01,#P<0.05,与对照组比较(Compared with the C group);**P<0.01,*P<0.05,与应激模型组比较(Compared with the SM group);下同。
糖水摄入(mL/24h)sucrose,water intaking 1%糖水偏爱(%)sucrose consumption ratio液体总消耗量(mL/24h)total consumption不动时间(s)immobilitytimes对照组control group 16.42±4.38 84.38±12.46 21.23±2.81 38.32±8.28应激模型组stress model group 10.16±3.24## 54.58±11.88## 19.38±6.54 95.24±13.89##应激运动组stress exercise group 13.59±1.87#* 72.93±10.62#* 20.38±3.65 60.56±10.56##*
2.3 大鼠八臂迷宫行为学测试结果
与对照组比较,应激模型组及应激运动组大鼠完成八臂迷宫时间显著延长(P<0.01,P<0.05);与应激模型组比较,经过长期自愿转轮运动,应激运动组大鼠完成八臂迷宫时间显著缩短(P<0.01,表3)。
与对照组比较,应激模型组大鼠工作记忆错误次数、参考记忆错误次数及总记忆错误次数均显著增多(P<0.05,P<0.01,P<0.01),总记忆错误次数增加98%;与应激模型组比较,应激运动组大鼠参考记忆错误次数及总记忆错误次数均显著减少(P<0.05,P<0.01),总记忆错误次数减少31%,工作记忆错误次数有减少的趋势,但无统计学意义(P>0.05,表3)。
表3 本研究各组大鼠八臂迷宫实验测试结果一览表Table 3 Results of 8-arms Radial Maze of Rats in Various Groups (±SD,n=15)

表3 本研究各组大鼠八臂迷宫实验测试结果一览表Table 3 Results of 8-arms Radial Maze of Rats in Various Groups (±SD,n=15)
TT(s) WME(次) RME(次) TE(次)对照组control group 384.68±48.98 1.56±0.42 3.05±0.49 4.89±0.96应激模型组stress model group 492.38±78.89## 3.22±0.86# 5.53±1.02## 9.96±1.84##应激运动组stress exercise group 413.88±88.36#** 2.32±1.64# 3.89±0.95#* 6.88±1.04#**
2.4 各组大鼠肾上腺指数、血浆Cort及脑组织NPY含量结果
与对照组比较,应激模型组大鼠血浆Cort含量及肾上腺重量指数均显著增加(P<0.01,P<0.01),血浆 Cort含量增加74%,肾上腺重量指数增加17%;脑组织NPY含量显著下降(P<0.01),平均减少35%;经过4周自愿转轮运动,大鼠血浆Cort含量及肾上腺重量指数均显著降低(P<0.05,P<0.05),血浆Cort含量减少26%,肾上腺重量指数减少9%,脑组织NPY含量增加(P<0.05),平均增加20%(表4)。
2.5 各组大鼠中央杏仁核nNOS表达结果
CeA内分布有大量nNOS阳性神经元,表达产物为深褐色,定位于胞质,胞核不着色,神经元大小不一,呈散在分布,胞体形态多种多样呈卵圆形、椭圆形或梭形,突起较明显(图2)。
与正常对照组比较,应激模型组及应激运动组大鼠CeA区nNOS免疫阳性细胞数量及面积均显著增多(P<0.01,P<0.05),应激模型组大鼠nNOS免疫阳性细胞数量及面积增加幅度分别为88%及93%,灰度值较对照组显著降低(P<0.01);经过4周自愿转轮运动,应激运动组大鼠CeA区nNOS免疫阳性细胞数量及面积均显著下降,下降幅度分别为33%及39%,灰度值显著增加(P<0.05,表5)。
表4 本研究各组大鼠肾上腺指数、血浆Cort及脑组织NPY含量结果一览表Table 4 Results of Adrenal Gland Index,the Contents of Blood Plasma Cort and Brain NPY of Rats in Various Groups (±SD,n=10)

表4 本研究各组大鼠肾上腺指数、血浆Cort及脑组织NPY含量结果一览表Table 4 Results of Adrenal Gland Index,the Contents of Blood Plasma Cort and Brain NPY of Rats in Various Groups (±SD,n=10)
对照组control group应激模型组stress model group应激运动组stress exercise group Cort(ng/mL) 9.28±1.39 16.12±8.64## 11.88±2.64#*肾上腺指数(mg/g×100)(adrenal gland index) 116.52±10.32 138.23±4.05## 125.56±9.36#*NPY(pg/mg) 28.65±4.18 18.56±3.89## 22.28±5.38#*
表5 本研究各组大鼠中央杏仁核nNOS神经元图像分析结果一览表Table 5 Results of Image Pattern Analysis of nNOS Immune Positive Cells within CeA of Rats in Various Groups (±SD,n=5)

表5 本研究各组大鼠中央杏仁核nNOS神经元图像分析结果一览表Table 5 Results of Image Pattern Analysis of nNOS Immune Positive Cells within CeA of Rats in Various Groups (±SD,n=5)
统计片slice面积(μm2)area细胞个数number灰度gray degree对照组control group 20 466.34±54.87 4.32±0.68 102.18±18.64应激模型组stress model group 20 900.54±169.48## 8.14±1.82## 89.98±14.98##应激运动组stress exercise group 20 645.38±104.88#* 5.48±1.12#* 96.86±22.14*

图2 本研究A-C:中央杏仁核nNOS阳性神经元分布的免疫组织化学图Figure 2. A-C:The Distribution of nNOS Immunoreactive Neurons within CeA
3 讨论
3.1 自愿转轮运动对抑郁模型大鼠糖水偏爱实验及强迫游泳实验的影响
抑郁模型目前可供选择的很多,有应激模型、药物模型、脑损伤模型、遗传选择性模型、基因敲除模型等。其中,由Katz等率先提出,后经Willner改进的慢性轻度不可预见性应激模型相对较为可靠,与人类抑郁症中慢性、低水平的应激源促进疾病发生、加速疾病发展的机理接近,此模型由多种相对温和的应激因子组成,顺序随机,使动物不能预测刺激的发生,应激因子的多变性和不可预测性是模型制造成功的关键[32]。本研究所涉及的行为学实验中,大鼠在强迫游泳实验中停止挣扎、处于不动状态的时间延长,反映了“行为绝望”的状态,也被看作抑郁症患者情绪低落所表现出的悲观、绝望、无助的表现。糖水偏爱实验是一个用动物行为指标检测类似于人的复杂情绪,如情绪低落、兴趣丧失和乐趣(快感)丧失的经典实验。目前,国内、外研究大多采用糖水消耗量或糖水消耗百分比作为评价抑郁模型快感缺乏的有效客观指标。本实验结果显示,在大鼠糖水偏爱实验中,应激大鼠糖水消耗量和糖水偏爱百分比均显著下降,这些行为改变表明,长期慢性应激使大鼠快感缺乏,与国内、外报道类似[21]。本实验中抑郁大鼠糖水饮用量的下降,不能单纯地解释为动物渴觉的下降,因为,大鼠的总液体消耗量并未减少,只能提示抑郁大鼠奖赏反应性的下降,是一种特异性的快感缺乏,本实验得到验证。强迫游泳实验中,大鼠停止挣扎、处于不动状态的时间延长,反映了大鼠悲观、绝望程度增加。
多数研究发现,自愿转轮运动可以改善抑郁大鼠的抑郁样行为[17],然而,Greenwood等[10]研究认为,2~3周的自愿转轮运动不能阻止和改善应激引起的大鼠的抑郁样行为,而≥4周的转轮运动可以改善抑郁大鼠的抑郁样行为。在本研究中,设计的抑郁模型大鼠自愿转轮运动为4周,结果发现,抑郁大鼠转轮距离自1~3周逐渐增加,但第4周转轮距离开始下降,可能与抑郁大鼠随着不可预知应激时间的延长,转轮运动的主动性及运动能力下降有关,具体机制需进一步研究。本实验也证实,经过4周自愿转轮运动,应激运动组大鼠糖水消耗量和糖水偏爱百分比显著增加,强迫游泳实验中,大鼠不动时间缩短。提示,长期自愿转轮运动可以在一定程度上改善抑郁模型大鼠快感缺乏的表现,并能对抗抑郁大鼠的绝望行为,使抑郁大鼠强迫游泳不动时间缩短。
3.2 自愿转轮运动对抑郁模型大鼠肾上腺指数、脑组织NPY及血浆Cort含量和学习记忆的影响
下丘脑-垂体-肾上腺轴(HPA)涉及人体的多种生理功能和病理变化,如情感、代谢调节、应激反应等,当机体感受应激源时,HPA轴兴奋性提高,但若机体长期处于应激状态,将严重影响人体的身心健康,使机体出现抑郁症状[29]。有研究显示,抑郁症患者血浆皮质醇浓度升高,而经抗抑郁治疗后随着抑郁缓解其浓度下降[24]。肾上腺是参与应激反应的主要器官之一,亦是应激的靶器官,有研究表明,肾上腺指数可以作为评价慢性应激对HPA轴活性影响的重要指标[16]。Rubin等[26]发现,35名未经治疗的抑郁症患者与健康者相比,抑郁患者的肾上腺皮质增生约38%,增生的程度与皮质醇的浓度有关,且随着抑郁的恢复,这种增生随着皮质醇的正常化会逐步消失。本实验结果显示,经过4周慢性不可预知应激,大鼠血浆Cort水平显著增加,肾上腺指数增加,可能是因为慢性应激引起脑内促肾上腺皮质激素释放激素(CRH)基因表达增强,进一步促进ACTH(促肾上腺皮质激素)分泌增多,ACTH再作用于肾上腺皮质促进血浆Cort分泌增多,肾上腺皮质增生,引起持续的HPA轴功能亢进和高皮质醇血症,从而出现一系列的抑郁情绪和症状。研究证实,高水平的血浆Cort可以导致大鼠HPA轴功能紊乱,增强大鼠绝望和抑郁样行为[13],与本研究结果一致。
NPY为36个氨基酸组成的多肽,广泛分布于中枢及外周组织,基础医学和临床研究发现,NPY在调节情绪和应激的相关行为中起重要作用,被称为“应激分子”。Heilig等[12]研究发现,在大脑特定区域,中枢神经系统高水平的NPY可以导致抗抑郁及抗焦虑行为,而低水平的NPY在情绪反应中可以引起相反的结果。Luo等[22]通过向大鼠海马微量注射NPY可明显改善慢性不可预见性温和应激诱发的大鼠抑郁样行为表现。本实验中,大鼠经过4周慢性应激,脑组织NPY水平下降,因此,可以推测抑郁大鼠快感缺乏及绝望行为增强与脑组织NPY水平下降有关。研究认为,在应激反应中,NPY可以通过影响CRF的释放从而间接导致ACTH及血浆Cort的释放增加,引起大鼠的抑郁行为。Thorsell等[31]通过长期给予大鼠血浆Cort发现,下丘脑室旁核NPY表达减少与抑郁有关,提示,NPY在长期给予血浆Cort引起的大鼠抑郁样行为中起重要作用。而大鼠杏仁核注射NPY可以通过减少血浆Cort的释放阻止HPA轴功能亢进而改善大鼠焦虑行为[27]。因此推断,本实验中应激大鼠经过4周自愿转轮运动,大鼠快感增强、绝望行为减弱与脑组织NPY含量增加,拮抗HPA轴功能亢进,从而减少血浆Cort释放有关。
大量研究证实,抑郁症会导致认知功能的损害,认知损害程度与抑郁症状的严重程度明显相关[20]。最近的研究表明,NPY在应激的情感及行为反应中发挥重要的调节功能,另有研究证明,NPY也涉及到啮齿动物的记忆过程,在伴有学习记忆损害的疾病中,中枢神经系统NPY免疫反应阳性神经元含量明显下降[9]。八臂迷宫实验已被公认为是一种评估啮齿动物空间学习记忆能力比较理想的模型,已被广泛接受和应用。本实验结果显示,大鼠经过4周慢性不可预知的应激,与对照组比较,学习记忆能力明显下降,可能与慢性应激大鼠脑组织NPY水平下降有关,具体机制需进一步研究。
3.3 自愿转轮运动对抑郁模型大鼠中央杏仁核nNOS表达的影响
有研究认为,大脑许多区域与焦虑和抑郁行为有关。然而,杏仁体在整合大脑各种信息方面起重要作用,是产生焦虑样行为及参与情绪性学习认知的重要脑区[25]。对人的研究发现,激活杏仁体可以产生与焦虑有关的行为学及生理学的改变,而损害此区域可以改善焦虑行为[3]。杏仁核位于颞叶内,分为许多大小不等的核团,通常将这些核群分为皮质内侧群、基底外侧核群和皮质杏仁移行区。中央杏仁核属于皮质内侧核群,与行为、自主神经系统、内分泌及抑郁等调节有关[28]。
NO在体内是一种自由基性质的气体分子,作为非经典的新型神经递质和第二信使在中枢神经系统中分布广泛,与许多精神障碍性疾病有关,在双向情感障碍、精神分裂症、焦虑及抑郁等疾病的发病中起重要作用[23]。动物实验表明,海马iNOS及nNOS的过度表达及NO水平的升高与慢性应激引起的大鼠抑郁样行为有关[14];Talarowska等[30]通过临床研究证实,抑郁病人血清NO浓度显著高于对照组,且病人认知功能下降,提示,NO水平的改变与抑郁症的发病之间有密切关系。nNOS活性可以直接反映NO含量。本研究结果发现,长期慢性应激模型组大鼠中央杏仁核nNOS表达明显增强,同时,大鼠学习记忆能力显著下降,可以推测,nNOS来源的NO增多可能是应激大鼠学习记忆能力下降的病理机制之一,可能是由于长期慢性应激促进杏仁核谷氨酸的释放,过度激活NMDA受体,抑制NPY的合成[35]。研究认为,高水平的NPY能抑制应激引起的NOS的高表达,有效地改善慢性应激引起的抑郁样行为表现[18]。因此推测,本实验中慢性应激引起脑组织NPY水平下降可能是中央杏仁核nNOS高表达的原因之一,导致NO水平增加。Gadek-Michalska等[8]研究认为,高水平的NO会引起促肾上腺皮质激素释放增加,促使HPA轴的功能亢进,并使血浆Cort分泌进一步增加。杏仁核区是高浓度血浆Cort攻击的主要靶区,进而损伤杏仁核神经元,随之出现神经细胞坏死,损伤LTP,导致慢性应激大鼠学习记忆能力下降。而应激运动组大鼠转轮运动4周后中央杏仁核nNOS表达明显减弱,提示,慢性应激大鼠经过长期转轮运动,八臂迷宫成绩提高可能与脑组织NPY含量增加,使中央杏仁核nNOS表达减少,导致NO神经毒性减弱有关。Wortwein等[34]研究认为,NO释放过量导致海马神经元损伤,可能在抑郁症发病机制中起重要作用,而减少海马NO的产生可能有利于突触的生长,从而增强大鼠的学习记忆能力,具体机制需进一步研究。
4 结论
1.长期慢性不可预见性应激可以导致大鼠快感缺乏、绝望行为以及肾上腺指数和血浆皮质醇水平的异常。由此推测,慢性应激引起的大鼠抑郁样行为与应激导致肾上腺皮质增生及HPA轴功能亢进有关。
2.长期慢性不可预见性应激导致大鼠学习记忆能力下降,脑组织NPY含量下降,中央杏仁核nNOS表达升高。由此推测,慢性应激引起的大鼠学习记忆能力下降可能与应激引起脑组织NPY水平下降,导致中央杏仁核nNOS高表达有关。
3.自愿转轮运动减少大鼠的抑郁样行为,可能与此运动降低慢性应激大鼠肾上腺皮质增生及血浆皮质醇含量,拮抗HPA轴功能亢进有关。
4.自愿转轮运动增强抑郁大鼠学习记忆,可能与此运动增加脑组织神经肽Y含量,减弱NO神经毒性有关。提示,中央杏仁核可能是运动干预抑郁症的作用脑区之一,且这一作用可能是由脑组织NPY水平上调、中央杏仁核nNOS表达下调共同介导的。
[1]AKPINAR A,YAMAN G B,DEMIRDAS A,et al.Possible role of adrenomedullin and nitric oxide in majordepression[J].Prog Neuropsychopharmacol Biol Psychiatry,2013,46:120-125.
[2]ALEMANY S,MAS A,GOLDBERG X,et al.Regional gray matter reductions are associated with genetic liability for anxiety and depression:An MRI twin study[J].J Affect Disord,2013,(13):74-78.
[3]AMARAL D.The primate amygdala and the neurobiology of social behavior:implication for understanding social phobia[J].Biol Psychiatry,2002,51:11-17.
[4]BOEKER H,SCHULZE J,RICHTER A,et al.Sustained cognitive impairments after clinical recovery of severe depression[J].J Nerv Ment Dis,2012,200(9):773-776.
[5]CLARK P J,BRZEZINSKA W J,THOMAS M W,et al.Intact neurogenesis is required for benefits of exercise on spatial memory but not motor performance or contextual fear conditioning in C57BL/6Jmice[J].Neurosci,2008,155(4):1048-1058.
[6]E ZAMBELLO,E FUCHS,N ABUMARIA,et al.Chronic psychosocial stress alters NPY system:different effects in rat and tree shrew[J].Progress Neuro-Psychopharma Cology Biological Psy,2010,34:122-130.
[7]FLANDREAU E I,RESSLER K J,OWENS M J,et al.Chronic overexpression of corticotropin-releasing factor from thecentral amygdala produces HPA axis hyperactivity and behavioral anxiety associated with gene-expression changes in the hippocampus and paraven-tricular nucleus of the hypothalamus[J].Psychoneuroendocrinol,2012,37(1):27-38.
[8]GADEK-MICHALSKA A,TADEUSZ J,RACHWALSKA P,et al.Effect of repeated restraint on homotypic stress-induced nitric oxide synthases expression in brain structures regulating HPA axis[J].Pharmacol Rep,2012,64(6):1381-1390.
[9]GONCALVES J,BAPTISTA S,OLESEN M V,et al.Methamphetamine-induced changes in the mice hippocampal neuropeptide Y system:implications for memory impairment[J].J Neurochem,2012,123(6):1041-1053.
[10]GREENWOOD B N,LOUGHRIDGE A B,SADAOUI N,et al.The protective effects of voluntary exercise against the behavioralconsequences of uncontrollable stress persist despite an increase inanxiety following forced cessation of exercise[J].Behav Brain Res,2012,233(2):314-321.
[11]HANG ZHENG,YANYOU LIU,WEI L I,et al.Beneficial effects of exercise and its molecular mechanisms on depression in rats[J].Behavioural Brain Res,2006,168:47-55.
[12]HEILIG M.The NPY system in stress,anxiety and depression[J].Neuropeptides,2004,38:213-224.
[13]HG KIM,EY LIM,WR JUNG,et al.Effects of treadmill exercise on hypoactivity of the hypothalamo-pituitary-adrenal axis induced by chronic administration of corticosterone in rats[J].Neurosci Lett,2008,434:46-49.
[14]JOCA S R,GUIMARÃESFS.Inhibitionofneuronalnitricoxide synthase in the rat hippocampus induces antidepressant-like effects[J].Psychopharmacol(Berl),2006,185(3):298-305.
[15]JOUNG H Y,JUNG E Y,KIM K,et al.The differential role of NOS inhibitors on stress-induced anxiety and neuroendocrine alterations in the rat[J].Behav Brain Res,2012,235(2):76-181.
[16]KESSING L V,WILLER I S,KNORR U.Volume of the adrenal and pituitary glands in depression[J].Psychoneuroendocrinology,2011,36(1):19-27.
[17]LAPMANEE S,CHAROENPHANDHU J,CHAROENPHANDHU N.Beneficial effects of fluoxetine,reboxetine,venlafaxine,and voluntary running exercise in stressed male rats with anxiety-and depression-like behaviors[J].Behav Brain Res,2013,250:316-325.
[18]LIAN T,AN S C.Antidepressant effect of microinjection of neuropeptide Y into the hippocampus is mediated by decreased expression of nitric oxide synthase[J].Sheng Li Xue Bao,2010,62(3):237-246.
[19]LIN Y H,LIU A H,XU Y,et al.Effect of chronic unpredictable mild stress on brain-pancreas relative protein in rat brain and pancreas[J].Behav Brain Res,2005,165(1):63-71.
[20]LIU M,YAN J,ZHOU X,et al.Effect of Kaixin San on learning and memory in chronic stress depression model rats[J].Zhongguo Zhong Yao Za Zhi,2012,37(16):2439-2443.
[21]LL ZHANG,JJ WANG,Y LIU,et al.GPR26-deficient mice display increased anxiety-and depression-like behaviors accompanied byreduced phosphorylated cyclic AMP responsive element-binding protein level in central amygdala[J].Neurosci,2011,196:203-214.
[22]LUO D D,AN S C,ZHANG X.Involvement of hippocampal serotonin and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Brain Res Bull,2008,77(1):8-12.
[23]MORENO J,GASPAR E,LÓPEZ-BELLO G,et al.Increase in nitric oxide levels and mitochondrial membrane potential in platelets of untreated patients with major depression[J].Psychiatry Res,2013(12):847-8455.
[24]PIWOWARSKA J,WRZOSEK M,RADZIWON-ZALESKA M,et al.Serum cortisol concentration in patients with major depression after treatment with clomipramine[J].Pharmacol Rep,2009,61(4):604-611.
[25]POULIN J F,BÉRUBÉP,LAFOREST S,et al.Enkephalin knockdown in the central amygdala nucleus reduces uncondi-tioned fear and anxiety[J].Eur J Neurosci,2013,37(8):1357-1367.
[26]RUBIN R T,PHILLIPS J J,MCCRAEKEN J T,et al.Adrenal gland volume in major depression relationship to basal and stimulated Pituitary-adrenal cortical axis function[J].Biological Psychiatry,1996,40(2):89.
[27]SAJDYK T J,FITZ S D,SHEKHAR A,et al.The role of neuropeptide Y in the amygdala on corticotropin-releasing factor receptor-mediated behavioral stress responses in the rat[J].Stress,2006,9:21-28.
[28]SAJDYK T J,SHEKHAR A,GEHLERT D R.Interactions between NPY and CRF in the amygdala to regulate emotionality[J].Neuropeptides,2004,38(4):225-234.
[29]SCHUTTER D J.The cerebello-hypothalamic-pituitary-adrenal axis dysregulation hypothesis in depressive disorder[J].Med Hypotheses,2012,79(6):779-783.
[30]TALAROWSKA M,GALECKI P,MAES M,et al.Nitric oxide plasma concentration associated with cognitive impairment in patients with recurrent depressive disorder[J].Neurosci Lett,2012,510(2):127-131.
[31]THORSELL A,CARLSSON K,EKMAN R,et al.Behavioral and endocrine adaptation,and up-regulation of NPY expression in rat amygdala following repeated restraint stress[J].Neuroreport,1999,29:3003-3007.
[32]WILLNER P.The validity of animal models of depression[J].Psychopharmacol,1984,83(1):1-16.
[33]WOLF O T,BAUSER D S,DAUM I.Eyeblink conditional discrimination learning in healthy young men is impaired after stress exposure[J].Psychophysiol,2012,49(2):164-171.
[34]WORTWEIN G,HUSUM H,ANDERSSON W,et al.Effects of maternal separation on neuropeptide Y and calcitonin generelated peptide in “depressed”Flinders Sensitive Line rats:a study of gene-environment interactions[J].Neuropsychopharmacol Biol Psychiatry,2006,30(4):684-693.
[35]YU L,AN SC,LIAN T.Involvement of hipppocampal NMDA receptor and neuropeptide Y in depression induced by chronic unpredicted mild stress[J].Acta Physiol Sin,2010,62(1):14-22.
