聚乳酸/肉桂醛复合纳米纤维膜的制备及表征
2014-05-22李林建刘俊渤唐珊珊常海波梁大栋
李林建,刘俊渤,唐珊珊,常海波,梁大栋
(吉林农业大学资源与环境学院,吉林 长春 130118)
0 前言
一维纳米功能材料是国际上的研究热点之一,其制备方法有气相沉积法、模板法、静电纺丝法及溶剂热法等。其中静电纺丝法由于设备简单,方便高效及制备的纤维具有较大的比表面积与较高的孔隙率,使其不仅在实验室研究中备受关注[1-2],而且在药物释放及组织工程领域的应用研究更是受到了广泛的重视[3-4]。
肉桂醛是一种天然广谱抗菌剂,且具有很好的药理活性。由于肉桂醛低浓度时对黄曲霉、白地霉、黑曲霉、酵母菌等均有强烈的抑菌作用[5],且不受pH值影响,因此无论对于酸碱性物质,肉桂醛都具有很强的杀菌功能,可广泛用于防腐、防霉及保鲜,近年来得到许多研究者的重视[6-7]。研究表明,肉桂醛对肉类及家禽类产品表面的沙门氏菌及大肠杆菌具有很强的抗菌作用,能有效控制食物表面有害病原体的传播[8]。但肉桂醛易挥发,使其杀菌作用不持久,经过β-环糊精包合后具有缓释特性,可达到气态长效杀菌效果。
PLA是以玉米等农作物淀粉为原料,由生物发酵生成乳酸,然后经过化学合成得到的可生物吸收与降解的生物质材料,因不污染环境,具有良好的生物相容性、可降解性及力学性能等优点而被广泛应用于医用材料及食品包装包材[9-10]。但研究发现单一PLA聚合物制备的材料存在功能上的不足或缺陷,因此有关PLA复合材料制备的报道[11-12]越来越多被关注,但添加肉桂醛的PLA复合纳米纤维膜却少有文献报道。将广谱天然抗菌剂肉桂醛添加到生物可降解高分子聚合物PLA溶液中,利用静电纺丝技术制备PLA/肉桂醛复合纳米纤维膜,不仅可赋予纤维膜的抗菌性能,使其拥有长效广谱抗菌、杀菌作用,同时又可降低膜材料在生产、使用及废弃后对环境的污染。
本研究采用静电纺丝法制备了PLA/肉桂醛复合纳米纤维膜,并探讨了溶剂比例、纺丝液浓度、纺丝电压、接收距离等因素对PLA/肉桂醛复合纳米纤维膜的纤维直径及表面形态的影响,同时对其性能进行了表征。
1 实验部分
1.1 主要原料
PLA,薄膜级,相对分子质量为1.0×105,深圳光华伟业实业有限公司;
β-环糊精,分析纯,天津市光复精细化工研究所;
肉桂醛,分析纯,阿拉丁试剂(上海)有限公司;
N,N-二甲基甲酰胺(DMF),分析纯,国药集团化学试剂有限公司;
丙酮,分析纯,北京化工厂;
酵母提取物,生物试剂,北京奥博星生物技术有限公司;
胰蛋白胨,生物试剂,北京奥博星生物技术有限公司;
NaCl,分析纯,天津市天新精细化工开发中心;
琼脂,分析纯,兰州市鹏程生物技术有限公司。
1.2 主要设备及仪器
恒温加热搅拌机,501,上海实验仪器有限公司;
高压直流电源,DW-P503-1ACCC,天津市东文高压电源厂;
热失重分析仪(TG),SEM,JSM-6510,日本电子株式会社;
FTIR,Spectrum RSIFT-IR System,德国 Perkin Elmer公司;
微型电子拉力机,HZ(08)X-O,上海黑子仪器有限公司;
真空干燥箱,DZF-6020,上海恒科仪器有限公司;
综合型热分析仪,ZRY-ZP,北京大学仪器厂;
高压蒸汽灭菌锅,LDZX-30KBS,上海申安医疗机械厂;
恒温培养箱,BPH-9082,上海凯朗仪器设备厂;
恒温恒湿震荡培养箱,LHS-250HC-I,上海一恒科技有限公司;
电子数显卡尺,0-150mm,哈尔滨量具刃具集团有限公司。
1.3 样品制备
称取一定质量的β-环糊精加入到45℃的水中制成饱和溶液,按1gβ-环糊精加入0.1mL肉桂醛的比例添加肉桂醛,恒温搅拌1h;包合完成后,降温析出固体粉末得到包合物,用乙醚洗脱包合物直至洗脱溶液中检测不到肉桂醛为止,置于烘箱50℃干燥2h得到肉桂醛/β-环糊精包合物;
保持环境温度为20~22℃,相对湿度为40%~50%;将肉桂醛/β-环糊精包合物添加到一定浓度的PLA纺丝溶液中,40℃恒温水浴加热搅拌5h;待溶液降温到室温,转入注射器中(用7号针头作为纺丝喷头),以铝箔(15cm×15cm)作为接收器,调节接收距离和纺丝电压制备PLA/肉桂醛复合纳米纤维膜;
PLA纤维膜的制备过程除不加肉桂醛/β-环糊精包合物外,其余过程与PLA/肉桂醛复合纳米纤维膜制备条件相同。
1.4 性能测试与结构表征
根据文献[5]报道的方法,配制肉桂醛/β-环糊精包合物无水乙醇溶液测定肉桂醛含量,按照式(1)计算得到包合率89.25%;
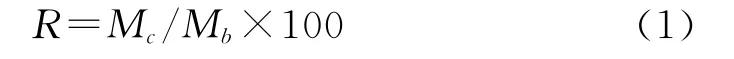
式中 R——包合率,%
Mc——包合物中肉桂醛的含量
Mb——包合前肉桂醛添加量
使用SEM进行纤维形貌的观察,采用Nano Measurer 1.2软件对纤维的直径进行测量,统计直径分布,比较不同样品纤维形貌的差异,取样品100根;
使用FTIR,利用KBr压片法制样,设置扫描范围500~2500cm-1,测定真空干燥后纤维膜样品的FTIR吸收光谱;
采用TG测定纤维膜的热稳定性,称取样品10mg,氮气气氛,以10℃/min速度升温,测定温度范围为30~900℃,分析复合纤维膜的分解温度;
在25℃,65%湿度条件下测定纤维膜的拉伸性能,将纤维膜样品平衡24h后裁剪成50mm×5mm样条,选择5个点测量其厚度并计算其平均厚度,通过拉力试验测试纤维膜的拉伸强度及断裂伸长率,每个样品夹持长度为10mm,拉伸速率为5mm/min,5次测定取其平均值;
抑菌性测定:使用LB培养基,培养基在高压蒸汽灭菌锅中灭菌,将大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌利用恒温恒湿震荡培养箱进行活化,于37℃培养1d时间,将裁剪好的样品(直径12mm圆片)膜覆盖在涂有大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的培养皿上,进行抑菌圈实验,每组平行5次试验,培养皿置于37℃恒温培养箱培养18h后取出观察抑菌圈大小。

图1 丙酮和DMF不同体积比例纳米纤维膜的SEM照片Fig.1 SEM for nanofiber membranes with different volume ratio of acetone and DMF
2 结果与讨论
2.1 混合溶剂体积比例对纤维形貌的影响
静电纺丝纤维直径和形貌受许多因素的影响,其中溶剂是主要影响因素之一。本研究使用丙酮和DMF混合溶液作为PLA的纺丝溶剂,当PLA质量分数为10%,纺丝电压12kV,接收距离13cm,丙酮和DMF混合溶剂体积比例1∶2时,制备的纤维膜由于DMF含量较多,纺丝过程溶剂挥发较慢,PLA溶液部分凝胶造成纤维中出现了粘连串珠;当混合溶剂体积比例1∶1时,纤维膜纤维连续性及平整性较好,没有串珠或断丝现象。而混合溶剂体积比例2∶1时,此时丙酮含量较高,溶剂挥发过快,极易造成针孔尖端阻塞,而使静电纺过程无法正常连续进行,结果图1所示。
2.2 纺丝液浓度对纤维形貌及直径的影响
固定混合溶剂体积比例1:1,在纺丝电压12kV,接收距离15cm的条件下,不同质量分数PLA纺丝液(6%、8%、10%、12%)制备的 PLA 纳米纤维膜SEM照片见图2。由图2可知,PLA质量分数为6%时,纺丝溶液浓度较低,黏度值偏低,纤维在电场中不易拉伸且溶剂挥发不完全,导致纤维中有断裂和串珠现象。随着溶液浓度的增加,断裂和串珠逐渐消失,所得纤维直径随着溶液浓度的增加呈现逐渐增大的趋势,PLA质量分数8%、10%、12%时,其纤维平均直径分别为189、316、401nm。静电纺丝过程中针头喷射出来的带电射流直经为影响纤维细度的重要因素,带电射流半径与溶液的浓度成正比[13]。PLA质量分数为8%时,依然存在少许纤维断裂现象;而PLA质量分数为12%时,溶液浓度过高,黏度过大,纤维不易“分裂”,导致所得到的纤维直径较大且分布离散度较大,因此,选择PLA质量分数10%的溶液作为纺丝液。
2.3 操作电压和接收距离对纤维形貌及直径的影响
图3(a)、(b)、(c)分别是固定纺丝电压12kV,接收距离分别为13、15、17cm时制备PLA纤维膜SEM照片。随着接收距离的增大,纤维平均直径逐渐减少,但不显著,分别为337、316、301nm。静电纺丝过程中,针头喷射的带电射流半径与纺丝距离成反比[13],即纺丝距离的增大致使带电射流半径减小,从而纤维直径也随之减小。接收距离17cm时,PLA纤维膜的纤维直径相对较小且粗细比较均匀,因此采用17cm作为静电纺丝的接收距离。
图3(c)、(d)、(e)是固定接收距离17cm,纺丝电压分别为12、15、18kV时制备PLA纤维膜SEM照片。随着纺丝电压的提升,纤维平均直径逐渐降低,分别为301、259、235nm。这是因为随着电压的增大,电场强度增强,纤维直径逐渐减小。操作电压增大到18kV时,PLA纤维膜的纤维直径最小且分布离散度较小。综合以上研究,本研究将采用PLA质量分数10%,接收距离17cm,纺丝电压18kV的纺丝工艺条件制备PLA/肉桂醛复合纳米纤维膜,该条件下制备得到的PLA纳米纤维膜直径分布如图4所示。

图2 不同PLA浓度纳米纤维膜的SEM照片Fig.2 SEM for nanofiber membranes with different PLA concentrations

图3 PLA纳米纤维膜的SEM照片和纤维直径分布Fig.3 SEM for PLA nanofiber membrane
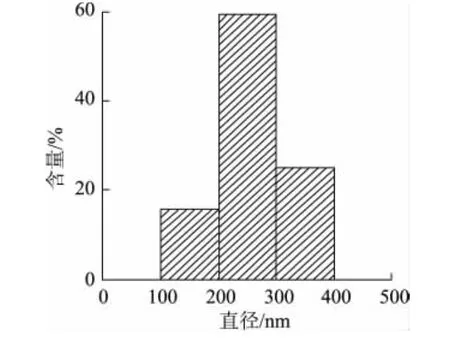
图4 PLA纳米纤维膜的纤维直径分布Fig.4 Fiber diameter distribution of PLA nanofiber membrane
2.4 PLA/肉桂醛复合纳米纤维膜的微观结构
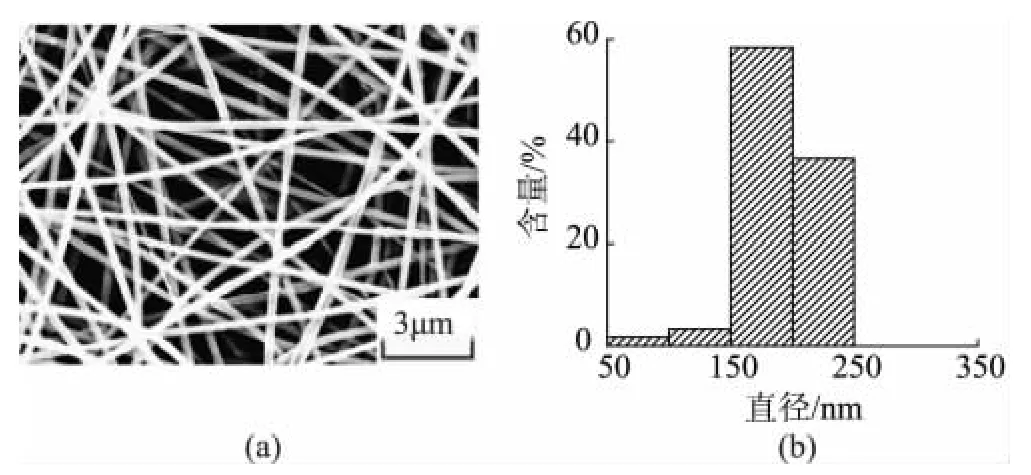
图5 PLA/肉桂醛复合纳米纤维膜的SEM照片和纤维直径分布Fig.5 SEM and fiber diameter distribution for PLA/cinnamic aldehyde composite nanofiber membrane
图5是PLA质量分数10%,接收距离17cm,纺丝电压18kV时,肉桂醛/β-环糊精包合物添加质量0.8g,即在纺丝液中占质量分数4%时制备的PLA/肉桂醛复合纳米纤维膜的SEM照片及直径分布图。相同纺丝条件下,PLA纤维膜的平均直径为235nm,PLA/肉桂醛复合纳米纤维膜平均直径为175nm,和PLA纤维膜相比,肉桂醛/β-环糊精包合物的加入显著降低了复合纤维膜的纤维直径。这是由于肉桂醛/β-环糊精包合物的添加,改变了聚合物纺丝溶液的物理性质[14](如极性、表面张力、电导率等),致使纤维直径减少。
2.5 PLA/肉桂醛复合纳米纤维膜的FTIR分析
从图6中可以看出,PLA纤维膜的FTIR对应的特征吸收峰主要是在755.96cm-1、869.73cm-1的C—H振动吸收峰,1045.23cm-1、1087.66cm-1的C—O吸收峰,1182.15cm-1的C—O—C伸缩振动吸收峰,1213.00cm-1的 C—C,1452.13cm-1的—CH3和1754.90cm-1的C== O振动吸收峰。添加肉桂醛/β-环糊精包合物后,其特征官能基并无明显的偏移或改变,因此该PLA/肉桂醛复合纳米纤维膜肉桂醛与PLA之间属于物理混合。
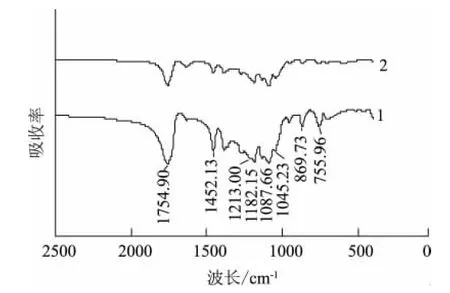
图6 PLA和PLA/肉桂醛纳米纤维膜的FTIRFig.6 FTIR spectra of PLA and PLA/cinnamic aldehyde nanofiber membranes
2.6 PLA/肉桂醛复合纳米纤维膜的热稳定性
图7为PLA纤维膜与PLA/肉桂醛复合纳米纤维膜的TG谱图。以TG曲线外推基线与曲线最大斜率处切线的交点温度作为的初始热分解温度,图中可以看出,PLA/肉桂醛复合纳米纤维膜和PLA纤维膜的初始热分解温度分别为265.52、298.62℃,显然PLA/肉桂醛复合纳米纤维膜初始热分解温度比PLA纤维膜低,这是由于肉桂醛/β-环糊精包合物的热分解温度在220~260℃之间[15],在热分解过程中,PLA/肉桂醛复合纳米纤维膜中的包合物先分解使其复合纳米纤维膜热分解初始温度降低了。通过对比还可以看出,两种纤维膜在310~380℃之间都出现了极大的质量损失,这是由于PLA主链的分解引起的[16]。
2.7 PLA/肉桂醛复合纳米纤维膜的力学性能
从图8中可以看出,PLA/肉桂醛复合纳米纤维膜的拉伸强度为2.45MPa,断裂伸长率为19.94%。PLA纤维膜的拉伸强度为4.02MPa,断裂伸长率为13.23%。相对PLA/肉桂醛复合纳米纤维膜,PLA纤维膜的拉伸强度较大,这是由于其纤维直径较大,纤维之间相互交络使其拉伸强度大,断裂伸长率小,而肉桂醛/β-环糊精包合物的添加,使纤维膜的纤维直径减小,从而导致PLA/肉桂醛复合纤维膜拉伸强度降低。
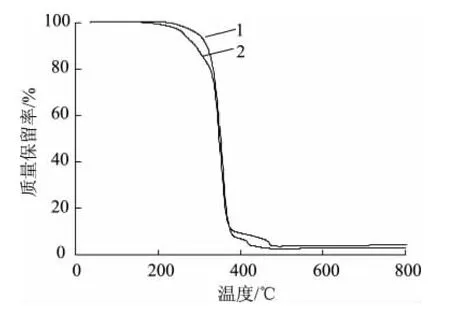
图7 PLA和PLA/肉桂醛纳米纤维膜的TG谱图Fig.7 TG of PLA and PLA/cinnamic aldehyde nanofiber membranes
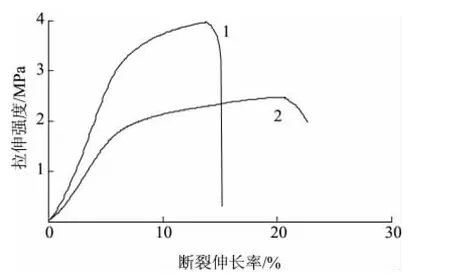
图8 PLA和PLA/肉桂醛纳米纤维膜的拉伸强度曲线Fig.8 Tensile stress-strain curves of PLA and PLA/cinnamic aldehyde nanofiber membranes
2.8 抗菌性能的研究
图9是PLA纤维膜和PLA/肉桂醛复合纳米纤维膜对大肠杆菌[图9(a)、(d)]、金黄色葡萄球菌[图9(b)、(e)]和枯草芽孢杆菌[图9(c)、(f)]的抑菌圈实验,从图中可以看出,PLA纤维膜对大肠杆菌[图9(a)]、金黄色葡萄球菌[图9(b)]和枯草芽孢杆菌[图9(c)]的生长无抑制作用。添加了肉桂醛/β-环糊精包合物之后,PLA/肉桂醛复合纳米纤维膜对大肠杆菌[图9(d)]、金黄色葡萄球菌[图9(e)]和枯草芽孢杆菌[图9(f)]产生了明显的抑菌圈,抑菌圈直径分别为29、31、24mm。这主要是由于从膜中释放出的肉桂醛通过破坏大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌的细胞壁并渗入其细胞内,从而破坏细胞器而起到杀菌作用。由抑菌圈直径可以看出PLA/肉桂醛复合纳米纤维膜对金黄色葡萄球菌的抗菌效果最强,对枯草芽孢杆菌的抑菌性最弱。
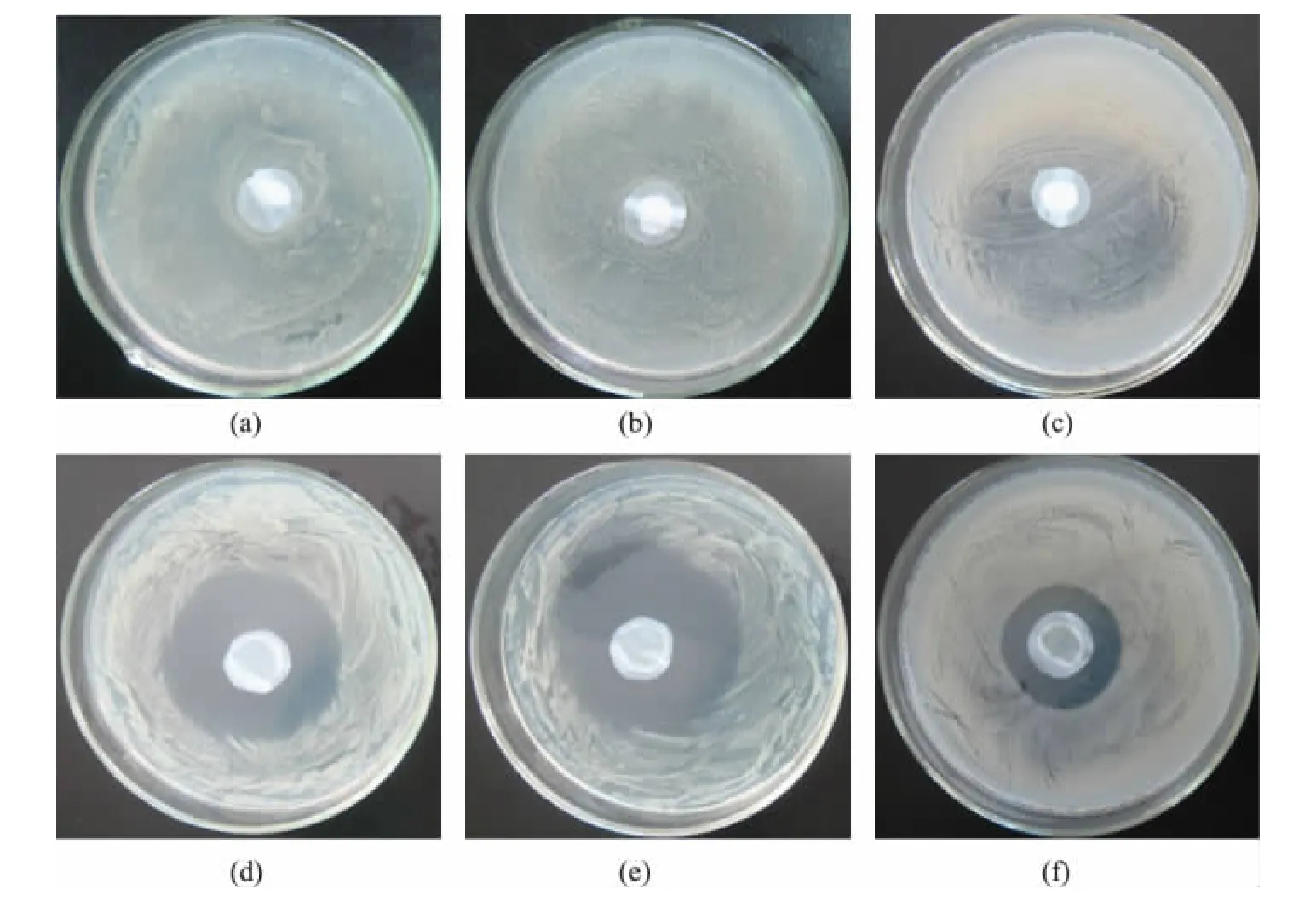
图9 PLA和PLA/肉桂醛纳米纤维膜的抑菌性能Fig.9 Antibacterial ability of PLA and PLA/cinnamic aldehyde nanofiber membranes
3 结论
(1)复合纤维膜最佳制备条件为混合溶剂丙酮/DMF体积比为1∶1,PLA质量分数10%,接收距离17cm,纺丝电压18kV;
(2)肉桂醛与PLA之间属于物理混合,具有较好的热稳定性与力学性能;
(3)PLA/肉桂醛复合纳米纤维膜对大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌均具有良好抑菌性,其中对金黄色葡萄球菌的抑菌性最强。
[1]Feng C H,Ruan S P,Zhu L H,et al,Preparation and Ethanol Sensing Properties of ZnO Nanofibers[J].Chemical Research in Chinese Universities,2011,27(5):720-723.
[2]Lu J,Liu J G,Song X F,et al.Sandwich Structure-like Meshes Fabricated via Electrospinning for Controllable Release of Zoledronic Acid[J].Chemical Research in Chinese Universities,2011,27(3):524-527.
[3]彭 慧,陶鑫峰,凌 君.低结晶度聚ε-己内酯电纺膜的制备及其药物控释行为[J].高分子学报,2011,(5):446-451.Peng Hui,Tao Xinfeng,Ling Jun.Controlled Release of Salicylic Acid From Electrospun Mats of Poly(ε-caprolac-tone)with Low Crystallinity[J].Chinese Journal of Polymer Science,2011,(5):446-451.
[4]尉继征,杨立新,胡秀丽,等.应用光亲和分子进行PEG的光照修饰及蛋白质的光照偶联[J].高分子学报,2011,(11):1341-1348.Wei Jizheng,Yang Lixin,Hu Xiuli,et al.PEG Modification and Protein Conjugation by Virtue of Azidobenzoic Acid as A Photoaffinity Molecule[J].Chinese Journal of Polymer Science,2011,(11):1341-1348.
[5]钱亮亮,金征宇,邓 力.密封控温法制备控释材料肉桂醛-β-环糊精包合物[J].食品与发酵工业,2007,33(12):13-16.Qian Liangliang,Jin Zhengyu,Deng Li.Preperation of Inclusion Complex of Cinnamaldehyde andβ-Cyclodextrin by Sealed Thermal Control Method[J].Food and Fermentation Industries,2007,33(12):13-16.
[6]Mari P B,Gracia L C,Ramon C,et al.Antifungal Properties of Gliadin Films Incorporating Cinnamaldehyde and Application in Active Food Packaging of Bread and Cheese Spread Foodstuffs[J].International Journal of Food Microbiology,2013,166(3):369-377
[7]Abad A M,Sanchez G,Fuster V,et al.Antibacterial Performance of Solvent Cast Polycaprolactone(PCL)Films Containing Essential Oils[J].Food Control,2013,34(1):214-220.
[8]Sadhaha R,Zhu L B,Carl W O,et al.Edible Apple Film Wraps Containing Plant Antimicrobials Inactivate Foodborne Pathogens on Meat and Poultry Products[J].Journal of Food Science,2009,74(8):M440-M445.
[9]Sansone L,Aldi A,Musto P,et al.Assessing the Suitability of Polylactic Acid Flexible Films for High Pressure Pasteurization and Sterilization of Packaged Foodstuff[J].Journal of Food Engineering,2012,111(1):34-45.
[10]Chih F K,Tsao N,Chou H H,et al.Release of FITCBSA From Poly(L-lactic acid)Microspheres Analysis Using Flow Cytometry[J].Colloids Surf B,2012,89(1):271-276.
[11]沈 斌,刘 亮,林水兴,等.聚乳酸/蒙脱土纳米复合材料的制备及其性能研究[J].中国塑料,2010,24(9):17-21.Shen Bin,Liu Liang,Lin Shuixing,et al.Preparation and Properties of Poly(lactic acid)/Montmorillonite Ano-Composites[J].China Plastics,2010,24(9):17-21.
[12]邓长勇,张秀成.聚乳酸/酯化纤维复合材料的制备与表征[J].中国塑料,2009,23(7):18-22.Deng Changyong,Zhang Xiucheng.Preparation and Characterization of PLA/Esterified Cellulose Composites[J].China Plastics,2009,23(7):18-22.
[13]Fong H,Chun I,Reneker D H.Beaded Nanofibers Formed During Electrospinning[J].Polymer,1999,40:4585-4592.
[14]Park S W,Bae H S,Xing Z C,et al.Preparation and Properties of Silver-containing Nylon6Nanofibers Formed by Electrospinning[J].Journal of Applied Polymer Science,2009,112(4):2320-2326.
[15]李光水,夏文水.β-环糊精与肉桂醛包合物的制备及热分解动力学研究[J].食品科学,2005,26(2):142-145.Li Guangshui,Xia Wenshui.Kinetics of Thermal Decomposition of the Inclusion Complex of Cinnamaldehyde andβ-cyclodextrin[J].Food Science,2005,26(2):142-145.
[16]闰明涛,胡晓敏,高俊刚.聚乳酸/羧基化聚丙烯共混物的形态与热性能研究[J].高分子学报,2007,(12):1121-1127.Run Mingtao,Hu Xiaomin,Gao Jungang.Morphology and Thermal Properties of The Poly(lactic acid)/Carboxylated Polypropylene Blends[J].Chinese Journal of Polymer Science,2007,(12):1121-1127.
