加味四逆散分时给药对慢性应激大鼠生物节律的影响
2014-05-21吴丽丽陈权韩
吴丽丽,刘 琰,陈权韩,严 灿
(广州中医药大学中医基础理论教研室,广东广州 510060)
机体在维持内环境稳态和外环境适应的过程中,各种功能活动常按一定的时间顺序发生周而复始的节律变化,称为生物节律(biological rhythm)。生物节律是生物体广泛存在的生命活动的基本现象之一,目前常用于生物节律的检测指标包括:皮质醇、褪黑素和核心体温[1]。20世纪前,核心体温的维持和昼夜变化一直被认为是稳态内环境的应答反应。最近发现,核心体温在自由振荡条件下显示出自身的周期节律。一些研究者认为,周期节律和内环境稳定的过程是相互独立的,昼夜节律振荡是由生化和环境刺激或时序压力引发的[2]。大量研究表明,抑郁症患者存在着明显的生物节律尤其是昼夜节律的紊乱,如大多数患者表现为每天晨间症状最为严重[3],下午和晚间减轻。研究发现,抑郁症患者体内激素、神经递质及细胞因子等的合成、分泌和代谢存在昼夜节律失调,如血浆皮质醇、去甲肾上腺素、泌乳素水平的时相改变[4],以及皮质醇分泌的不稳定模式[5]。由此可见,生物节律的紊乱可能是抑郁症发病机制的一个重要组成部分。
我们以往的研究证实,中药复方加味四逆散(jiaweisinisan,JWSNS)具有确切的抗抑郁效应,其机制与调节下丘脑-垂体-肾上腺(hypothalamuspituitary-adrenal gland,HPA)轴兴奋性、拮抗兴奋性氨基酸毒性、影响5-羟色胺(5-hydroxy tryptamine,5-HT)合成、释放、保护海马神经元等有关[6-8]。在本研究中,针对抑郁症昼夜节律紊乱这一病理现象,我们建立慢性应激大鼠模型,结合中医时间医学分时给药的理论,通过观察大鼠昼夜体温、血清5-HT、皮质酮(corticosterone,CORT)、褪黑素(melatonin,MT)的变化,从调节机体昼夜节律角度,进一步探讨JWSNS分时给药抗抑郁的作用机制,并期望为今后临床合理有效用药提供实验依据。
1 材料
1.1 实验动物 SPF级Sprague-Dawley(SD)♂大鼠,体质量(180±20)g,广东省医学实验动物中心提供,实验动物合格证编号依次为:第1批 No.0054669、第2批 No.0055096、第 3批 No.0056806、第4批No.0059563。单笼饲养,自由摄食饮水,在光暗周期为12 h,温度为(23±2)℃的安静环境适应并训练共计2周后,根据糖水消耗实验结果和体重情况进行分组。
1.2 实验药物及试剂 JWSNS由柴胡、白芍、枳壳、枸杞子、生地黄、石决明组成。药材由广州致信药业有限公司提供,经广州中医药大学第一附属医院药剂科鉴定均为纯正药材。将中药煎煮两次,合并两次药液,4层纱布过滤,待稍冷却后,用旋转蒸发仪浓缩药液至含生药量1.69 g·ml-1(以1 ml/100 g体重的比例灌胃,相当于临床成人用药剂量的2倍),4℃冰箱内保存备用。大鼠5-HT、CORT、MT酶联免疫吸附试剂盒购自广州市励恒生物科技有限公司。蔗糖:分析纯,由广州化学试剂厂提供。
1.3 实验仪器 电子秤(ES-2000E,长沙湘平科技发展有限公司);电子分析天平(BS 124S,sartorius公司);旋转蒸发仪(LABOROTA 4000,德国Heidolph公司);冷却水循环器(CA-Ⅲ,日本 EYWLA公司);超纯水器(Nexpower 1000,韩国 Human coporation公司);数字式电子体温计(BT-A11CN,温度范围:32℃~43.9℃,深圳市瑞迪恩科技有限公司);全自动酶联免疫分析仪(Model550,美国Bio-rad公司)。
1.4 实验分组 SD大鼠按体重和基础糖水消耗量分为5组:正常组(control):每天7∶30灌胃双蒸水,3 ml/次,不施加任何刺激。模型组(model):每天7∶30灌胃双蒸水,3 ml/次,施加刺激。JWSNS卯时给药组(MS group):每天于7∶30灌胃中药JWSNS,3ml/次,施加刺激。JWSNS酉时给药组(YS group):每天于 17∶30灌胃中药 JWSNS,3ml/次,施加刺激。JWSNS卯酉分时给药组(MS+YSgroup):每天于7∶30、17∶30分别灌胃中药 JWSNS,1.5ml/次,施加刺激。模型组、正常组与其它各组分房饲养。
2 方法
2.1 慢性应激大鼠模型的建立 采用Willner P慢性不可预知轻度应激(chronic unpredictable mild stress,CUMS)动物模型[9],并加以修改。接受应激处理的大鼠置于一独立房间内,在21 d内接受不同应激源的刺激,应激源包括限制空间(束缚)、持续光照、45°斜笼、并笼、禁水、空瓶、湿笼(加水入垫料中,至湿透)、禁食禁水。造模前:d 1~7:所有大鼠单笼喂养,自由摄食饮水,在光暗条件12 h/12 h(8∶00开灯,20∶00关灯),温度为(23±2)℃的安静环境中适应性喂养。d 7~14:糖水训练(d 7 9∶30开始至d 14 9∶30结束)。d 14 9∶30开始禁食禁水至d15 8∶30。d15 8∶30~9∶30糖水消耗1 h,之后根据消耗结果分组,称量体重。造模期:自d16开始,进入造模程序,d16 9∶30~10∶30束缚1 h;20:00开始持续光照。d17持续光照中。d18 8∶30终止持续光照;9∶30~16∶30斜笼45°7 h。d19 9∶00开始并笼23 h。d20 8∶30结束并笼;9∶30~12∶30禁水;12∶30~13∶30空瓶;15∶30湿笼17 h。d21 8∶30结束湿笼;16∶00开始禁食禁水23 h。d22 15∶00结束禁食禁水。d23 8∶30持续光照36 h。d24 20∶30结束持续光照。d25 9∶30开始并笼23 h。d26 8∶30结束并笼;9∶30~12∶30禁水;12∶30~13∶30空瓶;15∶30~16∶30束缚。d27 9∶30~16∶30斜笼7 h;16∶30湿笼17 h。d28 9∶30开始禁食禁水23 h。d29 8∶30结束禁食禁水;15∶30~16∶30束缚1 h。d30 9∶30开始并笼23 h。d31 8∶30结束并笼,开始持续光照36 h。d32 20∶30结束持续光照。d33 9∶30~12∶30禁水;12∶30~13∶30空瓶;15∶30开始湿笼17 h。d34 8∶30结束湿笼;9∶30~16∶30斜笼7 h;16∶00开始禁食禁水23 h。d35 15∶00~16∶00糖水消耗实验,并称量体重。d36~d37测量24 h体温(时间点为10∶00、14∶00、18∶00、22∶00、2∶00、6∶00)。d39~d40眶下静脉丛采血(时间点同上)。
2.2 体重检测及糖水消耗实验 所有大鼠在完成1周的单笼饲养适应后,接受双瓶训练,一瓶是1%(W/V)蔗糖水(在笼左侧),一瓶是纯水(在笼右侧),水瓶位置固定,训练1周,每日清晨添加糖水或纯水。之后所有大鼠禁食禁水23h,进行1 h糖水消耗实验,测量基础糖水偏爱度和基础体重。经过禁食禁水23 h后,在整个实验进程的d35 15∶00~16∶00再次进行糖水消耗实验,测量造模后糖水偏爱度和体重。糖水偏爱度/%=造模后糖水偏爱度/基础糖水偏爱度。
2.3 体温数据的采集与拟合
2.3.1 体温数据的采集 在整个实验进程的d36~d37,自d36 10∶00开始,到d37 6∶00结束,每隔4h对所有实验组别的大鼠进行一次肛门-直肠温度的测量。共得六组体温数据,时间点为依次10∶00、14∶00、18∶00、22∶00、2∶00、6∶00。
2.3.2 体温数据的拟合 采用“余弦节律分析法”,简称余弦法。将所得的每只大鼠的6个时间点体温按照单一余弦法[1]进行处理,并将用以描绘生物节律的余弦数学模型:Y=M+Acos(ωt-φ)转化为线性方程,应用SPSS15.0统计软件中线性回归的方法拟合出时间序列节律的特征值(中值M,振幅A,峰值相位φ),然后分别求出各组各特征值的平均值,依据此平均值拟合出各组对应的体温昼夜节律变化的余弦方程。之后依据方程,求出各组大鼠体温的峰值、谷值、峰值时间、谷值时间,并进行比较。
2.4 血清5-HT、CORT、MT含量的测定 在整个实验进程的d39~d40,自d39 10∶00开始,到d40 6∶00结束,每隔4 h对所有实验组别的大鼠进行一次眶下静脉丛采血。酶联免疫吸附法测定血清5-HT、CORT、MT含量,操作按说明书要求进行。以空白孔调零,450 nm波长依序测量各孔的吸光度(OD值)。按上述方法进行数据与曲线的拟合。
2.5 统计学方法 实验结果以±s表示,应用SPSS15.0统计软件进行分析,多组间比较用One-Way ANOVA,LSD法。
3 结果
3.1 各组大鼠造模前后体重的变化 与正常组比较,模型组体重增重明显下降(P<0.01);与正常组比较,MS组和YS组体重增重明显下降(P<0.01)。与模型组比较,YS组体重增重明显下降(P<0.01)。与MS+YS组比较,YS组体重增重明显降低(P<0.01);与MS组比较,YS组体重增重明显降低(P<0.05)。见 Tab 1。
Tab 1 Body weight change of each group(±s,n=7)

Tab 1 Body weight change of each group(±s,n=7)
**P<0.01 vs model;##P<0.01 vs control;△△P<0.01 vs MS+YS;▲P<0.05 vs MS
Group Weight/g Weight gain/g Control 324.33±11.71 414.00±15.90 89.67±9.Pre-modeling Post-modeling 81 Model 252.33±8.48 319.00±24.21 66.67±17.96##MS 249.67±7.97 312.83±10.50 63.17±4.22##YS 323.33±11.71 369.33±14.88 46.00±3.79**##△△▲MS+YS 283.17±14.47 351.00±23.45 67.83±13.20
3.2 各组大鼠造模前后糖水偏爱度的变化 与正常组比较,模型组、MS组、YS组糖水偏爱度明显下降(P<0.01,P<0.05)。与模型组比较,MS组、YS组、MS+YS组糖水偏爱度明显提高(P<0.01)。见Fig 1。
3.3 各组大鼠各时间点体温概况、体温昼夜节律特征值、昼/夜体温均值以及体温峰值、谷值、峰值时间、谷值时间的比较 与正常组相比,MS组体温中值明显下降(P<0.01)。在体温振幅方面:与正常组相比,模型组、MS组体温振幅明显增大(P<0.01)。与模型组相比,YS组、MS+YS组体温振幅明显减小(P<0.01)。与MS+YS组相比,YS组体温振幅减小(P<0.05)。与MS组相比,YS组体温振幅明显减小(P<0.01)。
与正常组相比,模型组白昼体温均值明显下降(P<0.01),夜间体温均值明显上升(P<0.01);MS组白昼体温均值明显下降(P<0.01),YS组白昼体温均值下降(P<0.05)。与模型组相比,YS组、MS+YS组白昼体温均值升高(P<0.05),夜间体温均值降低(P<0.05)。与MS组比较,YS组、MS+YS组白昼体温均值升高(P<0.05)。
与正常组相比,模型组白昼体温谷值明显下降(P<0.01),体温峰值上升(P<0.05);MS组体温谷值明显下降(P<0.01)。与模型组相比,YS组、MS+YS组体温谷值明显升高,体温峰值明显降低(P<0.05,P<0.01)。与 MS组相比,YS组、MS+YS组体温谷值明显升高(P<0.01)。见 Tab 2、3、4,Fig 2。

Fig 1 Change of sucrose preference of each group(±s,n=7)**P<0.01 vs model;#P<0.05,##P<0.01 vs control

Fig 2 Core body temperature of each group
3.4 各组大鼠血清5-HT昼夜节律特征值、以及峰值、谷值、峰值时间、谷值时间的比较 与正常组相比,模型组、MS组5-HT中值、峰值、谷值均明显下降(P<0.01)。与模型组相比,YS组、MS+YS组5-HT中值、峰值、谷值均明显升高(P<0.01)。与MS组相比,YS组、MS+YS组5-HT中值、峰值、谷值均明显升高(P<0.01)。与YS组相比,MS+YS组5-HT中值、峰值、谷值均明显降低(P<0.01)。
与正常组相比,模型组5-HT振幅明显减小(P<0.01),时相提前9.83 h;MS组5-HT振幅明显减小(P<0.01),时相提前8.18 h。与模型组相比,YS组、MS+YS组5-HT振幅明显增大(P<0.01),YS组时相后推0.65 h,MS+YS组时相后推1.91 h。与MS组相比,YS组、MS+YS组5-HT振幅均明显增大(P<0.01),YS组时相提前 1 h、MS+YS组时相提前 0.3 h。见 Tab 5、6。
3.5 各组大鼠血清MT昼夜节律特征值、以及峰值、谷值、峰值时间、谷值时间的比较 与正常组相比,模型组、MS组、MS+YS组MT中值、峰值、谷值均明显下降(P<0.05,P<0.01)。与模型组相比,JW酉时组中值、峰值、谷值均明显升高(P<0.01)。与MS组相比,YS组MT中值、峰值、谷值均明显升高(P<0.01);MS+YS组 MT中值、峰值、谷值均明显降低(P<0.01)。与 YS组相比,MS+YS组 MT中值、峰值、谷值均明显降低(P<0.01)。
与正常组相比,模型组MT振幅明显减小(P<0.01),时相提前10.86 h;MS组MT振幅明显减小(P<0.01),时相后推 2.02 h;YS组 MT振幅减小(P<0.05),时相提前10.32 h。与模型组相比,JW酉时组 MT振幅明显增大(P<0.01),时相后推0.54 h。与MS组相比,YS组MT振幅明显增大(P<0.01),时相后推11.66 h。YS组与MS+YS组相比,振幅明显增大(P<0.01),时相提前11.39 h。见 Tab 7、8。
Tab 2 Characteristic value of core body temperature rhythm of each group(±s,n=7)

Tab 2 Characteristic value of core body temperature rhythm of each group(±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△P<0.05 vs MS+YS;▲▲P<0.01 vs MS
Group Characteristic value M︱A︱ φ 0.48±0.81 Control 38.11±0.15 0.40±0.22 -0.67±0.97 Model 37.96±0.21 0.89±0.23**0.09±0.26 MS 37.80±0.17**0.77±0.24**-0.20±0.41 YS 37.99±0.15 0.30±0.17##△▲▲ 0.25±0.55 MS+YS 37.94±0.30 0.53±0.20##
Tab 3 Day/night core body temperature of each group(±s,n=7)

Tab 3 Day/night core body temperature of each group(±s,n=7)
*P<0.05,**P<0.01 vs control;#P<0.05 vs model;△P<0.05 vs MS
Group Day Night Control 38.22±0.28 38.00±0.22 Model 37.38±0.30** 38.54±0.32**MS 37.37±0.20** 38.23±0.34 YS 37.79±0.21*# 38.18±0.12#△MS+YS 37.78±0.40# 38.11±0.28#△
Tab 4 Peak/valley time and peak/valley value of core body temperature of each group(±s,n=7)
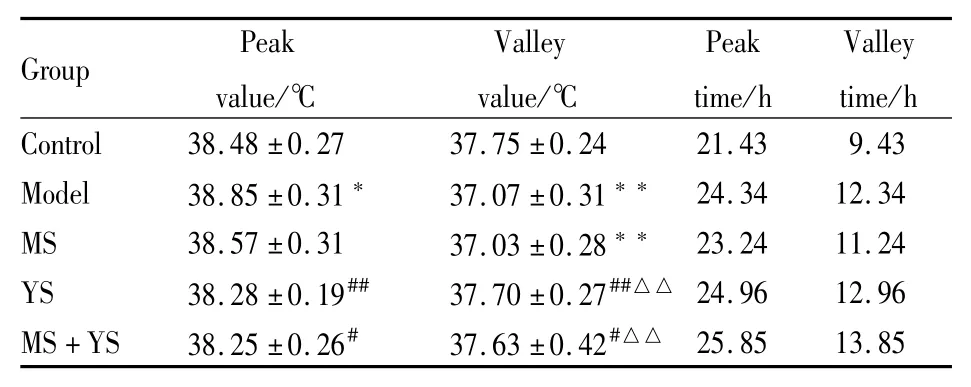
Tab 4 Peak/valley time and peak/valley value of core body temperature of each group(±s,n=7)
*P<0.05,**P<0.01 vs control;#P<0.05,##P<0.01 vs model;△△P<0.01 vs MS
Group Peak value/℃Valley value/℃Peak time/h Valley time/h 25.85 13.85 Control 38.48±0.27 37.75±0.24 21.43 9.43 Model 38.85±0.31* 37.07±0.31**24.34 12.34 MS 38.57±0.31 37.03±0.28**23.24 11.24 YS 38.28±0.19## 37.70±0.27##△△ 24.96 12.96 MS+YS 38.25±0.26# 37.63±0.42#△△
Tab 5 Characteristic value of serum 5-HT rhythm of each group(±s,n=7)

Tab 5 Characteristic value of serum 5-HT rhythm of each group(±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△△ P<0.01 vs MS;▲▲P<0.01 vs YS
Group Characteristic value M︱A︱ φ Control 424.61±37.97 64.21±27.57-0.60±0.31 0.32±0.89 Model 156.68±43.16** 13.04±3.98**-0.04±0.50 MS 148.94±33.51** 11.05±7.28**0.40±0.41 YS 434.03±39.73##△△ 51.09±24.92##0.13±0.77 MS+YS 233.39±20.62##△△▲▲ 36.28±18.38##
Tab 6 Peak/valley time and peak/valley value of serum 5-HT of each group±s,n=7)

Tab 6 Peak/valley time and peak/valley value of serum 5-HT of each group±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△△P<0.01 vs MS;▲▲P<0.01 vs YS
Group Peak value/μg·L-1 Valley time/h Control 488.82±51.92 360.41±41.33 21.69 9.6 Valley value/μg·L-1 Peak time/h 9 13.21 25.21 Model 169.71±45.55** 143.64±41.02** 11.86 23.86 MS 159.99±35.08** 137.89±33.49** 13.51 25.51 YS 485.12±46.96##△△ 382.95±46.85##△△ 12.51 24.51 MS+YS 269.67±25.79##△△▲▲ 197.11±29.34##△△▲▲
Tab 7 Characteristic value of serum MT rhythm of each group±s,n=7)
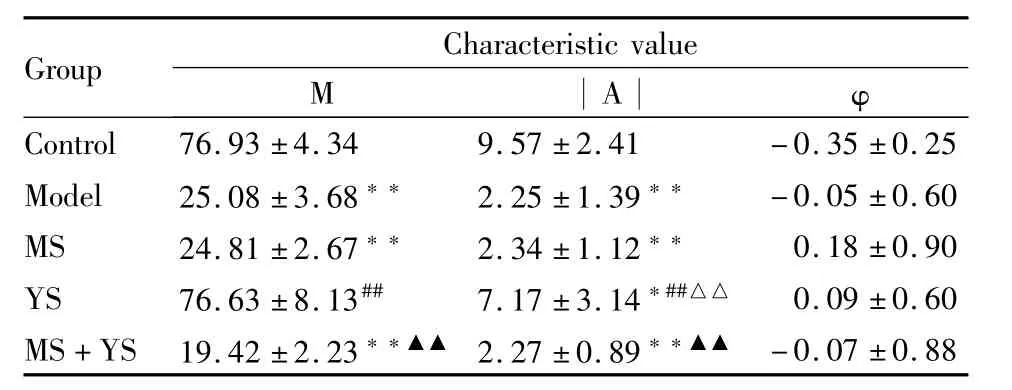
Tab 7 Characteristic value of serum MT rhythm of each group±s,n=7)
*P<0.05,**P<0.01 vs control;##P<0.01 vs model;△△P<0.01 vs MS;▲▲P<0.01 vs YS
Group Characteristic value M︱A︱ φ-0.07±0.88 Control 76.93±4.34 9.57±2.41 -0.35±0.25 Model 25.08±3.68** 2.25±1.39** -0.05±0.60 MS 24.81±2.67** 2.34±1.12** 0.18±0.90 YS 76.63±8.13## 7.17±3.14*##△△ 0.09±0.60 MS+YS 19.42±2.23**▲▲ 2.27±0.89**▲▲
Tab 8 Peak/valley time and peak/valley value of serum MT of each group(x¯±s,n=7)

Tab 8 Peak/valley time and peak/valley value of serum MT of each group(x¯±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△△P<0.01 vs MS;▲▲P<0.01 vs YS
Group Peak value/ng·L-1 Valley value/ng·L-1 Peak time/h Valley time/h Control 86.50±5.04 67.36±4.90 22.66 10.66 Model 27.33±4.57** 22.82±3.17** 11.80 23.80 MS 27.14±2.99** 22.47±2.79** 24.68 12.68 YS 83.81±6.73##△△ 69.46±10.33##△△ 12.34 24.34 MS+YS 21.69±2.51**△△▲▲ 17.15±2.29**△△▲▲23.73 11.73
3.6 各组大鼠血清CORT昼夜节律特征值、以及峰值、谷值、峰值时间、谷值时间的比较 与正常组相比,模型组、MS组CORT中值、峰值、谷值均明显升高(P<0.01)。与模型组相比,YS组、MS+YS组CORT中值、峰值、谷值均明显降低(P<0.01)。与MS组相比,YS组、MS+YS组CORT中值、峰值、谷值均明显降低(P<0.01)。与YS组相比,MS+YS组CORT中值、峰值、谷值明显降低(P<0.01)。
与正常组相比,模型组CORT振幅明显减小(P<0.01),时相提前8.16 h;MS组CORT振幅明显减小(P<0.01),时相提前9.45 h;YS组 CORT振幅明显减小(P<0.01),时相提前9.35 h;MS+YS组CORT振幅明显减小(P<0.01),时相提前9.32 h。与MS组比较,MS+YS组CORT振幅明显减小(P<0.01),时相提前 0.75 h;YS组与 MS+YS组相比,振幅明显增大(P<0.01),时相推后1.85 h。见Tab 9、10。
Tab 9 Characteristic value of serum CORT rhythm of each group±s,n=7)
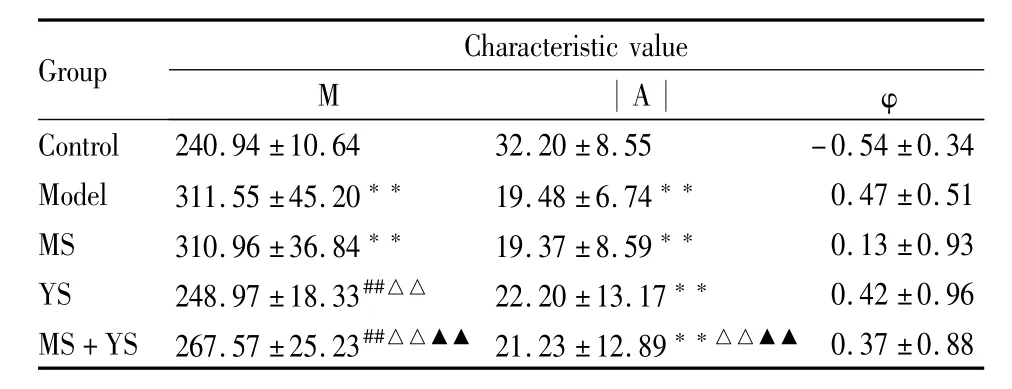
Tab 9 Characteristic value of serum CORT rhythm of each group±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△△P<0.01 vs MS;▲▲P<0.01 vs YS
Group Characteristic value M︱A︱ φ 0.37±0.88 Control 240.94±10.64 32.20±8.55 -0.54±0.34 Model 311.55±45.20** 19.48±6.74** 0.47±0.51 MS 310.96±36.84** 19.37±8.59** 0.13±0.93 YS 248.97±18.33##△△ 22.20±13.17** 0.42±0.96 MS+YS 267.57±25.23##△△▲▲ 21.23±12.89**△△▲▲
Tab 10 Peak/valley time and peak/valley value of serum CORT of each group(±s,n=7)

Tab 10 Peak/valley time and peak/valley value of serum CORT of each group(±s,n=7)
**P<0.01 vs control;##P<0.01 vs model;△△P<0.01 vs MS;▲▲P<0.01 vs YS
Group Valley time/h Control 273.15±15.94 208.74±10.87 21.96 9.9 Peak value/ng·L-1 Valley value/ng·L-1 Peak time/h 6 25.08 13.08 Model 331.03±50.81** 292.07±39.94** 13.80 25.80 MS 330.33±32.79** 291.59±42.27** 12.51 24.51 YS 271.18±28.87##△△ 226.77±13.60##△△ 13.61 25.61 MS+YS 273.69±28.51##△△▲▲ 221.65±12.89##△△▲▲
4 讨论
CUMS模型的原理是模拟抑郁症的环境诱因以及核心症状快感缺失,该模型不仅可用于抗抑郁药效学的研究,而且更适合抗抑郁剂作用机制的研究[6]。本实验观察到,CUMS可引起大鼠体重增长缓慢和糖水偏爱度的明显下降。JWSNS 3个给药组对模型大鼠体重增长缓慢现象没有抑制作用。在改善大鼠由慢性应激带来的糖水偏爱度下降方面,JWSNS3个给药组均表现出抑制作用,表明JWSNS具有抗抑郁效应。
正常情况下,大鼠体温峰值时间出现在暗时相(21.43,相当于24 h制的21∶21),谷值时间出现在光时相(9.43,相当于24 h制的9∶09)。为了进一步明确慢性应激对体温的影响以及JWSNS分时给药的效果,将24h体温分为昼体温(8∶00~20∶00)和夜体温(20∶00~8∶00),分别进行观察研究。结果表明,慢性应激可造成大鼠体温昼夜波动加剧,使白昼体温更低,夜间体温更高(体温谷值降低,峰值升高),并且这种现象在谷值方面表现得更为明显。JWSNS酉时、卯酉分时给药对昼夜体温波动加剧具有抑制作用,且酉时给药表现为对峰值、谷值的双相调节作用,而卯酉分时给药则主要是作用于光时相,即对谷值(白昼)进行调节。在慢性应激状态下,大鼠的体温节律出现延迟现象,表现为时相的推后,只有JWSNS卯时给药可以对体温节律延迟有抑制作用。慢性应激使大鼠昼夜体温中值出现下降的趋势,但没有统计学意义,需做进一步的观察研究。
在抑郁症发病机制许多不同的观点和假说里,单胺假说被大多数人所推崇[10],抑郁症的神经生化基础主要是5-HT和去甲肾上腺素水平或功能的低下[11]。正常情况下,大鼠血清 5-HT、MT、CORT含量均存在着昼夜波动,本实验结果表明,大鼠血清5-HT含量昼夜波动的幅度在(36.64~91.78)μg·L-1之间,其峰值时间出现在暗时相(21.69,相当于24 h制的21∶21),谷值时间出现在光时相(9.69,相当于24 h制的9∶09)。慢性应激状态下,大鼠昼夜血清5-HT含量波动变化不明显,即振幅减小;分泌节律紊乱,表现为时相的大幅提前。慢性应激大鼠血清5-HT的中值、峰值、谷值均降低,JWSNS酉时和卯酉分时给药对大鼠血清5-HT整体水平的低下具有抑制作用,其中JWSNS酉时给药效果最佳。JWSNS卯酉分时给药对大鼠昼夜血清5-HT振幅减小具有抑制作用;JWSNS卯时给药和卯酉分时给药则对大鼠血清5-HT分泌节律的紊乱有一定的抑制作用。
MT是人体内的一种能够影响睡眠规律、觉醒类型和体温,并与情绪调节、失眠等密切相关的物质[12]。MT主要是由松果体分泌,其前身物质是5-HT,5-HT经 N-乙酰基转移酶(N-acetyltransferase,NAT)作用转变为N-乙酰基-5-羟色胺,再经羟基吲哚氧位甲基转移酶的作用生成MT。MT的节律成分为内源性节律,是机体重要的标志节律[13]。研究人员发现MT与抑郁症密切相关,抑郁症发作时会呈现MT分泌量、分泌节律位相及幅度的异常[14]。目前一般认为,抑郁症患者发作期间MT分泌下降,缓解后MT分泌再度上升[15],MT水平的高低对抑郁症具有诊断价值。本实验结果表明,大鼠血清MT含量昼夜波动的幅度在(7.16~11.98)ng·L-1之间,其峰值时间出现在暗时相(22.66,相当于24 h制的22∶22),谷值时间出现在光时相(10.66,相当于24 h制的10∶10)。慢性应激可使大鼠昼夜血清MT中值、峰值、谷值降低,与5-HT的改变规律相一致。JWSNS酉时给药对此种改变具有抑制作用。慢性应激大鼠昼夜血清MT含量波动幅度减小,分泌节律紊乱,表现为时相的大幅提前,甚至表现为昼夜节律的颠倒。JWSNS酉时给药对波动幅度的减小具有抑制作用,而JWSNS卯时给药和卯酉分时给药则对 MT分泌节律紊乱具有抑制作用,其中JWSNS卯酉分时给药效果最佳。
抑郁症患者多有HPA轴活动亢进[16],皮质醇水平会在夜间升高[17]。Kentarou等[18]明确提出慢性应激的过程引起昼夜节律紊乱,表现在体温过高和皮质醇增多症的观点。本实验结果表明,大鼠血清CORT含量昼夜波动的幅度在(23.65~40.55)μg·L-1之间,其峰值时间出现在暗时相(21.96,相当于24 h制的21∶21),谷值时间出现在光时相(9.96,相当于24 h制的9∶09)。慢性应激可导致大鼠昼夜血清CORT含量升高,JWSNS酉时和卯酉时给药可抑制CORT的升高。慢性应激大鼠昼夜血清CORT含量波动幅度减小,分泌节律紊乱,表现为时相的大幅提前,甚至表现为昼夜节律的颠倒。JWSNS酉时和卯酉时给药对波动幅度的减小具有一定的抑制作用。
中医认为,正常人体应该处于一个阴阳平衡的状态,人体的体温和各种激素分泌也应该在一个既定范围内波动,若波动加剧或消失,则说明人体的阴阳平衡状态遭到了破坏。抑郁症的发生与昼夜节律的紊乱之间存在着密切的联系,而重新构建正常的昼夜节律可能具有抗抑郁的作用。JWSNS在组成上主要包含两部分药物,一部分是以疏肝、柔肝为主的柴胡、枳壳、白芍,一部分是以镇肝、清肝为主的石决明、栀子、干地黄和枸杞子,两部分相互配合,一升一降,一阳一阴,恰恰包含有阴阳并用、调节阴阳的思想。从中医时间医学角度而言,卯时为肝旺之时,酉时为肝衰之时,在这两个时间点分别给药,正好可以顺应肝气的盛衰变化,达到调肝,进而调节机体阴阳的作用。时间节律在中医表现为阳气周而复始地运行,在肝气升发正旺的卯时给药,有助于阳气的生发,同时也有助于对伴随阳气生发而波动的人体各种时间节律的调节;而各种激素和神经递质在中医归属于阴津范畴,在阴气渐盛、阳气渐衰的酉时给药,正好可以顺应阴阳变化,调养肝血,使阴液中的各种物质恢复到正常状态。本研究的实验结果表明,JWSNS对慢性应激大鼠具有明显抗抑郁作用,卯时(7∶30)给药可能主要与调节体温、激素以及神经递质分泌节律有关;酉时(17∶30)给药可能主要与调节激素和神经递质有关;而卯酉分时给药则与以上两方面神经内分泌节律综合调节密切相关。这一结论与中医时间医学理论和调节阴阳的思想是相契合的。
参考文献:
[1] 杨 波,刘延友,李 颖.生物节律测控和分析系统的研制及应用[J].四川大学学报(医学版),2006,37(3):447-79.
[1] Yang B,Liu Y Y,Li Y.Design and application of biological rhythm automatic monitor and data analysis system[J].J Sichuan Univ(Med Sci Edi),2006,37(3):447-79.
[2] 王 凌.国外时间生物学进展[J].生物医学工程学杂志,2005,22(11):185-8.
[2] Wang L.Developments of chronobiology abroad[J].J Biomed Eng,2005,22(11):185-8.
[3] Kaplan H I,Sadock B J,Grebb J A.Synopsis of psychiatry[M].7th edition:Baltimore USA Williams Wilkins,1994:530-31.
[4] Koenigsberg H W,Teicher M H,Mitropuolou V,et al.24-h monitoring of plasma norepinephrine,MHPG,cortisol,growth hormone and prolactin in depression[J].J Psychiatr Res,2004,38(5):503-11.
[5] Peeters F,Nicolson N A,Berkhof J.Levels and variability of daily life cortisol secretion in major depression[J].Psychiatry Res,2004,126(1):1-13.
[6] Lili W,Chuanlian R,Shukao L,et al.Jiaweisinisan facilitates neurogenesis in the hippocampus after stress damage[J].Neural Regenerat Res,2013,8(12):1091-102.
[7] 吴丽丽,王文竹,严 灿,等.加味四逆散对慢性心理应激抑郁症大鼠海马损伤的保护作用[J].中医杂志,2008,49(4):353-5.
[7] Wu L L,Wang WZ,Yan C,et al.The protective effect of modified Sini powder on hippocampus injury in chronic stressed depression rats[J].J Tradit Chin Med,2008,49(4):353-5.
[8] 吴丽丽,严 灿,丁胜元,等.加味四逆散抗应激性抑郁效应及其海马NMDA受体通道机制的初步研究[J].中国药理学通报,2007,23(11):1425-31.
[8] Wu L L,Yan C,Ding SY,et al.The initial research on the effect of anti-stressed depression of Jiaweisinisan and it’s mechanism of N-methyl-D-aspartate receptor channel in hippocampus[J].Chin Pharmachol Bull,2007,23(11):1425-31.
[9] Willner P,Benton D,Brown E.Depression increases,craving for sweet rewards in animal and human models of depression and craving[J].Psychopharmacology,1998,136(3):272-83.
[10]张亭亭,薛 瑞,李云峰,等.单胺转运蛋白与单胺重摄取抑制剂研究进展[J].中国药理学通报,2013,29(6):741-4.
[10]Zhang T T,Xue R,Li Y F,et al.Research progress in monoamine transporters and monoamine transmitter reuptake inhibitors[J].Chin Pharmachol Bull,2013,29(6):741-4.
[11]李俊旭,郑继旺,梁建辉.脑源性白介素的研究进展[J].中国药理学通报,2003,19(3):253-6.
[11]Li JX,Zheng JW,Liang JH.Progress in brain-derived interleukins[J].Chin Pharmachol Bull,2003,19(3):253-6.
[12]Chenevard R,Suter Y,Erne P.Effects of the heart-lung machine on melatonin metabolism and mood disturbances[J].Eur J Cardiothorac Surg,2008,34(2):338-43.
[13]Lam R W.High-quality remission:potential benefits of the melatonergic approach for patients with major depressive disorder[J].Int Clin Psychopharmacol,2007,22(Suppl 2):S21-5.
[14]Brotto L A,Gorzalka B B,Lamarre A K.Melatonin protects against the effects of chronic stress on sexual behaviour in male rats[J].Neuroreport,2001,12(16):3465-9.
[15]Seidman SN,Araujo A B,Roose SP,et al.Low testosterone levels in elderly men with dysthymic disorder[J].Am J Psychiatry,2002,159(3):456-9.
[16]Gold PW,Chrousos G P.The endocrinology of melancholic and atypical depression:relation to neurocircuitry and somatic conseguences[J].Proceed Association Amer Physi,1999,111(1):22-34.
[17]Dodig-Curkovic K,Kurbel S,Matic V C.Can incidence of depression in women be linked to estrogen dependent secretion of various hormone binding proteins[J]?Med Hypotheses,2009,72(2):211-2.
[18]Ushijima K,Morikawa T,Higuchi S,et al.Chronobiological disturbances with hyperthermia and hypercortisolism induced by chronic mild stress in rats[J].Behavioural Brain Res,2006,173(2):326-30.
