人结肠癌HT-29移植瘤不同生长阶段微血管密度及相关因子的表达研究
2014-05-21白丽淼黄晓峰徐寒梅
白丽淼,黄晓峰,徐寒梅
(1.中国药科大学生命科学与技术学院,江苏南京 210009;2.南京市口腔医院病理科,江苏南京 210008)
新生血管对于肿瘤的生长和转移是必不可少的[1]。肿瘤的血管新生是一个受到多种因子共同作用的复杂过程。肿瘤组织内血管的增生情况反映了肿瘤诱导血管新生的能力,检测肿瘤的微血管密度(microvessel density,MVD),作为反映肿瘤血管生长的指标,具有重要意义[2]。CD105为一种同源异体细胞膜糖蛋白,是TGF-β受体复合物成分之一。有研究表明,CD105可特异性地表达于高增殖状态的血管内皮细胞[3]。血管内皮生长因子(VEGF)能够增加血管通透性,促进内皮细胞分裂、增殖、血管构建、迁移,对肿瘤的新生血管生成起着决定性作用,是目前已知最关键的促进血管生成因子[4]。缺氧是肿瘤发生恶性转化和肿瘤转移的起始因素,缺氧诱导因子HIF-1α在肿瘤血管的生成过程中起着重要的调控作用。缺氧通过两种方式促进血管生成:一方面HIF-1α可直接增加促进血管生长的因子表达,如促进 VEGF、VEGFR1、IL-8、血管生成素(angiogenin)、成纤维细胞生长因子(FGF)、血小板源性生长因子(PDGF)的表达,以促进内皮细胞的增殖及血管生成;另一方面缺氧可降低血管生成抑制因子的活性,为血管新生提供合适的环境[5]。
肿瘤的发生和发展是多阶段性的连续过程,肿瘤组织在不同时期存在特定的微环境[6]。而血管在肿瘤生长不同时期是否存在不同的特征尚未见报道。本实验应用免疫组化方法研究了不同体积的HT-29裸鼠移植瘤组织内 CD31、CD105、VEGF、HIF-1α的表达情况,以探讨肿瘤不同阶段的微血管密度和血管相关因子的表达,为血管生成抑制剂类抗肿瘤药物的合理用药提供依据。
1 材料与试剂
1.1 实验动物及细胞株 实验动物为BALB/c裸小鼠,SPF级,5~7周龄,♀,体质量(15±2)g,购自常州卡文斯实验动物中心,实验动物生产许可证:SCXK(苏)2011-0003。人结肠癌细胞HT-29购自中国科学院细胞库。
1.2 主要试剂 DMEM培养基、胰蛋白酶、胎牛血清(美国Gibco公司);青霉素、链霉素(美国Amresco公司);HIF-1α和VEGF一抗均为兔抗人单克隆抗体,CD31和CD105一抗均为鼠抗人单克隆抗体,均购自北京中杉金桥生物技术有限公司;免疫组化试剂盒(鼠兔通用)购自Dako公司。
2 方法
2.1 裸鼠移植瘤实验 复苏冻存的HT-29细胞,置于含10%胎牛血清的DMEM培养基中,于37℃、5%CO2、饱和湿度培养箱中培养。收集生长对数期细胞,将细胞浓度调整为每毫升2.5×107个细胞,接种于BALB/c裸小鼠右侧前肢腋部皮下,每只小鼠接种0.2 ml。2周后15只裸鼠全部成瘤。根据移植瘤生长情况将15只荷瘤裸小鼠按照肿瘤大小分为3组,每组5只。3组移植瘤的大小分别为<100 mm3、100~300 mm3、>300 mm3。
2.2 免疫组化检测 免疫组化采用Envision两步法。所有标本均经中性甲醛固定、脱水、石蜡包埋、3 μm连续切片、脱蜡,EDTA pH 8.0高温抗原修复,滴加相应一抗,4℃过夜,PBS洗涤后加二抗37℃孵育,DAB显色,苏木精复染,常规梯度乙醇脱水、二甲苯透明、中性树胶进行封片。以PBS代替一抗作为阴性对照,以已知的阳性切片作为阳性对照。
2.3 结果判定 ①微血管密度的计数:肿瘤组织中的微血管均染为棕黄色,阳性定位在血管内皮细胞的细胞膜和细胞质。按Weidner法[7]对MVD进行计数,即先在低倍镜(×100)下查看整张切片,找到肿瘤组织的微血管密集区,再在高倍镜(×200)下选择5个视野计数血管数,取其平均值作为此样本的MVD值。任何一个被染为棕黄色的内皮细胞或内皮细胞簇,只要与相邻的微血管、肿瘤细胞或其他结缔组织界限分明,都被认为是一个微血管,进行计数。管腔大于8个细胞或带有较厚肌层的血管不计数;②VEGF表达的判定:细胞的细胞质或细胞膜出现黄色或棕黄颗粒为阳性表达,400倍镜下随机取5个不同视野,分别计数整个视野内阳性细胞数和总细胞数,取其比值作为阳性表达率,5个数值的平均值作为该样本的阳性表达率;③ HIF-1α表达的判定:阳性表达于细胞核,计数方法同VEGF。
2.4 统计学处理 利用SPSS 13.0统计分析软件进行统计。数据以¯x±s表示,组间差异的比较采用配对样本t检验。
Tab 1 Expression of vascular-related factors for xenografts tumor of HT-29 cells in nude mice at different growth stages(±s,n=5)

Tab 1 Expression of vascular-related factors for xenografts tumor of HT-29 cells in nude mice at different growth stages(±s,n=5)
*P<0.05,**P<0.01 G1 vs G2,and G2 vs G3
Group Tumor volume/mm3 CD31-MVD CD105-MVD VEGF expression/% HIF-1αexpression/%G1 <100 37.40±4.17 22.80±3.54 26.20±0.83 3.20±2.97 G2 100~300 18.80±1.72** 15.60±1.35* 40.73±6.29** 11.89±1.94**G3 >300 14.20±2.23* 10.20±2.48* 13.41±1.20** 80.62±3.47**
Fig 1 Expression of CD31 for xenografts tumor of HT-29 cells in nude mice at different growth stagesHT-29 xenografts tumor volumes A:<100 mm3,B:100~300 mm3,C:>300 mm3
3 结果
3.1 染色结果 CD31阳性表达于血管内皮细胞的细胞膜和细胞质,呈棕黄色颗粒。在肿瘤组织内的微血管和大血管上均有表达,与其他组织可清晰分辨(Fig 1)。CD105也将血管内皮细胞染为棕黄色,与CD31比较,多染色于微小血管上,血管内皮细胞排列不规则,与其他组织可清晰分辨。在大血管上染色不明显,分布不均匀,肿瘤组织的边缘区表达强烈(Fig 2)。VEGF阳性表达于肿瘤细胞的细胞质中,表现在肿瘤细胞的胞质内出现棕黄色颗粒。在肿瘤组织内间质细胞的细胞质也有表达(Fig 3)。HIF-1α阳性表达定位于肿瘤细胞的细胞质,染为棕黄色。在肿瘤组织的坏死区及其边缘表达明显(Fig 4)。
3.2 肿瘤不同阶段 CD31、CD105、VEGF、HIF-1α的表达 从Tab 1可以看出,随着肿瘤体积的增大:① CD31-MVD值分别为 37.40±4.17、18.80±1.72、14.20±2.23,CD105-MVD值分别为22.80±3.54、15.60±1.35、10.20±2.48。即体积增大,组织内微血管密度减小,各组间t检验结果显示P<0.05,差异有显著性;裸鼠移植瘤不同体积时CD31-MVD、CD105-MVD的变化趋势见Fig 5;②VEGF阳性表达率先增后减,分别为 26.20% ±0.83%、40.73%±6.29%、13.41%±1.20%。肿瘤体积在100~300 mm3时表达最多,体积继续增大,VEGF的阳性表达率减小;③ 组织内部的坏死程度逐渐加大,HIF-1α的阳性表达增加,分别为 3.20% ±2.97%、11.89%±1.94%、80.62%±3.47%。特别是在坏死区域和坏死边缘区域,HIF-1α的阳性表达明显。裸鼠移植瘤不同体积时VEGF、HIF-1α的阳性表达变化见Fig 6。

Fig 2 Expression of CD105 for xenografts tumor of HT-29 cells in nude mice at different growth stagesHT-29 xenografts tumor volumes A:<100 mm3,B:100~300 mm3,C:>300 mm3

Fig 3 Expression of VEGF for xenografts tumor of HT-29 cells in nude mice at different growth stagesHT-29 xenografts tumor volumes A:<100 mm3,B:100~300 mm3,C:>300 mm3

Fig 4 Expression of HIF-1αfor xenografts tumor of HT-29 cells in nude mice at different growth stagesHT-29 xenografts tumor volumes A:<100 mm3,B:100~300 mm3,C:>300 mm3
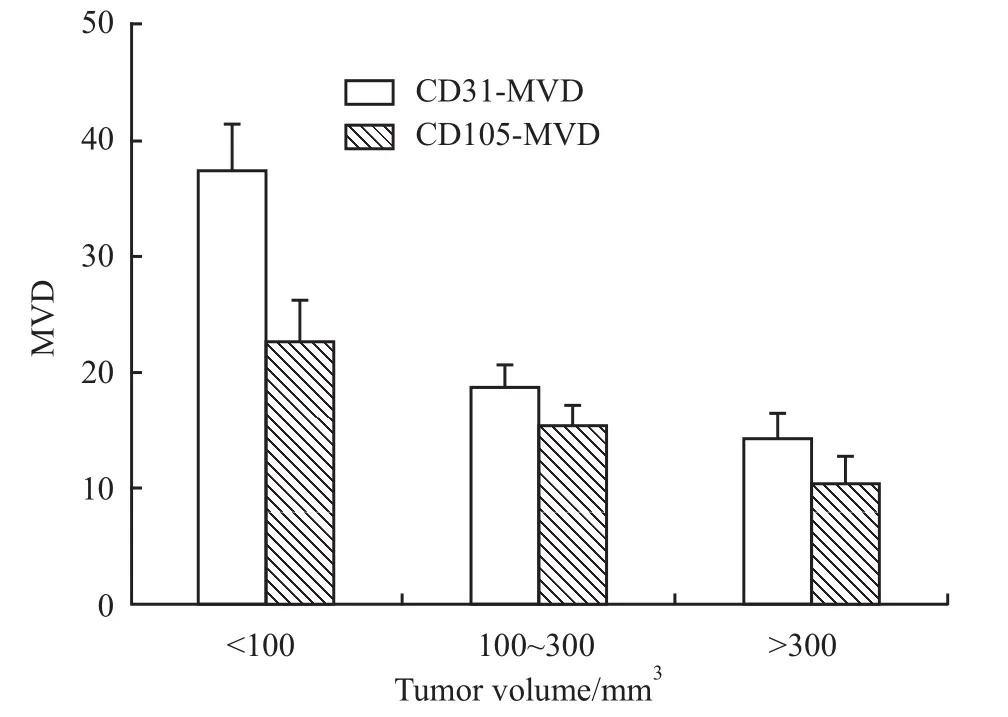
Fig 5 CD31-MVD and CD105-MVD for xenografts tumor of HT-29 cells in nude mice at different growth stages
4 讨论
早在20世纪初,Goldman就发现了血管围绕肿瘤生成的现象。1971年,Folkman提出肿瘤的生长、转移与血管生成密不可分。在无血管状态下,肿瘤的营养获得来源于简单的被动扩散,肿瘤生长直径不会超过2 mm。新生血管给肿瘤带来了丰富的营养物质和氧气,并将肿瘤细胞与循环系统联系到一起,为肿瘤转移提供机会[8]。肿瘤血管已经成为研究的热点,是最有希望的肿瘤导向治疗的靶标。
CD105又名 Endoglin,是调节转化生长因子-β(TGF-β)受体复合物成分之一。定位于人染色体9q34,分子质量为180 ku。TGF-β能降低毛细血管样结构的长度,并且可诱导缺乏CD105的内皮细胞死亡。抑制人内皮细胞中CD105蛋白的翻译,可增强TGF-β对内皮细胞生长和游走的抑制功能,说明CD105可抑制TGF-β的生物学效应[9]。有研究表明,CD105在多种实体瘤上高度表达,其与病人的生存率和转移率密切相关。黄小娟等[10]实验表明,MVD-CD105与组织学分级、腹水、有无远处转移和淋巴结转移有关。CD105表达越高,肿瘤组织学分级越高,肿瘤患者的预后越差。CD105可优先表达于肿瘤的新生血管内皮细胞上,相对于Von Willebrand因子、CD31和CD34更具特异性,对肿瘤血管的诊断具有更高的参考价值[11]。在本研究中也发现了相似的现象,CD105的阳性表达集中在肿瘤的边缘区,在移植瘤不同体积时,阳性染色多为单层内皮细胞围成的管腔。而在移植瘤体积大于300 mm3的样本中,用CD31标记的血管出现分支和大血管。从数量上比较,HT-29裸鼠移植瘤在不同时期CD105-MVD、CD31-MVD值差异均存在显著性(P<0.01)。
肿瘤的血管生成与其所处的微环境中血管形成因子有关。VEGF是一种重要的促进血管生成因子。VEGF通过与受体KDR特异性结合,发挥其对内皮细胞的促进分化和趋化作用,从而促进血管新生,所以研究肿瘤组织中VEGF的表达情况具有重要意义。在本实验中我们发现,不仅肿瘤细胞表达VEGF,间质细胞也大量表达。HT-29裸鼠移植瘤在不同体积时,VEGF的表达量不同。在肿瘤体积小于300 mm3时,VEGF的表达量较高,当肿瘤体积继续增大时,VEGF的表达量减少。所以在肿瘤体积较小时应用VEGF抑制剂类抗肿瘤药物,可能会获得好的疗效。

Fig 6 Expression of VEGF and HIF-1αfor xenografts tumor of HT-29 cells in nude mice at different growth stages
HIF-1是由HIF-1α和HIF-1β组成的具有转录活性的异源二聚体。其中HIF-1β在细胞内稳定表达,HIF-1α在氧压正常时被蛋白酶迅速降解,而在缺氧时,其半衰期延长,与HIF-1β结合成一个完整的HIF-1转录子,调控缺氧相关基因的表达,所以HIF-1α为HIF的氧调节亚单位[12]。在HT-29裸鼠移植瘤不同瘤体积时检测HIF-1α的表达,我们发现,随着肿瘤体积的增大,肿瘤坏死面积增加,HIF-1α的表达率升高。在肿瘤组织的坏死区域及边缘区,HIF-1α明显表达。肿瘤体积增大,肿瘤组织内血管密度减少,供血不足导致组织得不到充足的氧气和养分,出现缺氧,常规药物无法进入组织内部,难以达成治疗效果。
肿瘤的生长和转移不仅与肿瘤细胞本身有关,与其所处的微环境也密不可分。肿瘤微环境是指肿瘤在生长过程中,由肿瘤细胞、基质细胞(成纤维细胞、免疫细胞、脂肪细胞、血管内皮细胞等)和细胞外基质等共同组成的肿瘤发生、发展和转移的局部稳态环境,是肿瘤生理学、结构和功能的一个组成部分[13]。从本实验中我们可以发现,HT-29裸鼠移植瘤在不同体积时,肿瘤组织内各种细胞因子的表达情况不同。所以在肿瘤治疗时,肿瘤微环境为一个重要的考量因素。
恶性肿瘤是一个多因素、多基因、多阶段的病理过程。在肿瘤不同阶段,基因组、转录组、蛋白质组学呈现不同的规律[14]。只有给予适时的、恰当的药物治疗,才能达到预期的治疗效果。血管抑制剂类药物虽然在临床上取得了巨大的成功和销售利润,但其开发历史相对其他肿瘤化学治疗药物较短,其药理学研究还不够深入,非常有必要在其临床药理或临床前药理学方面进行深入的研究,以便为其更合理使用提供重要参考。在给予血管生成抑制剂类抗肿瘤药物时,一定要考虑到肿瘤所处的阶段,只有在肿瘤发生发展恰当的时期给予相应的、恰当的抗肿瘤药物治疗,才可能达到预期的效果。在肿瘤的治疗中应注意:(1)研究不同肿瘤、肿瘤不同时期的微环境,从而采取个性化治疗方案;(2)以肿瘤的微环境为靶点,开发多靶点药物或多种干预手段联合应用,从而取得期待的治疗或预后。本文结果说明,在肿瘤分化早期,CD31-MVD、CD105-MVD、VEGF的表达水平高,此时给予相应的血管抑制剂治疗会收效明显;在肿瘤分化中晚期,肿瘤组织内部缺氧程度增加,HIF-1α过度表达,此时给予 HIF-1α抑制剂,如p300/CBP抑制剂JG-ODN、sGC刺激剂YC-1、HSP90抑制剂等对于改善组织缺氧状态,抑制肿瘤生长和抑制血管生成具有重要意义[15]。
参考文献:
[1] Folkman J.What is the evidence that tumors are angiogenesis dependent[J]?J Natl Cancer Inst,1990,82(1):4-6.
[2] Schimming R,Reusch P,Kuschnierz J,et al.Angiogenic factors in squamous cell carcinoma of the oral cavity:do they have prognostic relevance[J].JCraniomaxillofac Surg,2004,32(3):176-81.
[3] Takase Y,Kai K,Masuda M,et al.Endoglin(CD105)experssion and angiogenesis status in small cell lung cancer[J].Pathol Res Pract,2010,206(11):725-30.
[4] Mäkinen T,Veikkola T,Mustjoki S,et al.Isolated lymphatic endothelial cells transduce growth,survival and migratory signals via the VEGF-C/D receptor VEGFR-3[J].EMBO J,2001,20(17):4762-73.
[5] Ruan K,Song G,Ouyang G.Role of hypoxia in the hallmarks of human cancer[J].J Cell Biochem,2009,107(6):1053-62.
[6] Hanahan D,Weinberg R A.Hallmarks of cancer:the next generation[J].Cell,2011,144(5):646-74.
[7] Weidner N,Semple J P,Welch W R,et al.Tumor angiogenesis and metastasis——correlation in invasive breast carcinoma[J].N Engl J Med,1991,324(1):1-8.
[8] Folkman J.Tumor angiogenesis:therapeutic implications[J].N Engl J Med,1971,285(21):1182-6.
[9] Li C,Hampson I N,Hampson L,et al.CD105 antagonizes the inhibitory signaling of transforming growth factor betal on human vascular endothelial cells[J].FASEB J,2000,14(1):55-64.
[10]黄小娟,齐文慧,王 立,等.CD31和CD105在卵巢上皮性肿瘤中的表达及其临床病理意义[J].中国组织化学与细胞化学,2012,21(6):544-50.
[10]Huang X J,Qi WH,Wang L,et al.Expression and clinicopathological significance of CD31 and CD105 in ovarian epithelial carcinoma[J].Chin J Histochem Cytochem,2012,21(6):544-50.
[11] Dallas N A,Samuel S,Xia L,et al.Endoglin(CD105):a marker of tumor vasculature and potential target for therapy[J].Clin Cancer Res,2008,14(7):1931-7.
[12]李玉娟,刘建勋.HIF-1活性调节及其在缺血后血管新生中的作用[J].中国药理学通报,2009,25(1):19-20.
[12]Li Y J,Liu JX.Key regulators of HIF-1 and its action in angiogenesis after ischemia[J].Chin Pharmacol Bull,2009,25(1):19-20.
[13]Mbeunkui F,Johann D J Jr.Cancer and the tumor microenvironment:a review of an essential relationship[J].Cancer Chemother Pharmacol,2009,63(4):571-82.
[14]李夏雨,沈守荣,武明花,等.对基因遗传性肿瘤不同阶段转录组学调控规律及其分子机制[J].中南大学学报(医学版),2011,36(7):585-91.
[14]Li X Y,Shen SR,Wu M H,et al.Transcriptomic regulation and molecular mechanism of polygenic tumor at different stages[J].J Cent South Univ(Med Sci),2011,36(7):585-91.
[15]吴 琪,霍兴华.以HIF-1α为靶点的抗肿瘤药的研究现状[J].齐齐哈尔医学院学报,2011,32(7):1119-21.
[15]Wu Q,Huo X H.Drugs development in anti-tumor therapy by targeting of HIF-1α[J].J Qiqihar Med Coll,2011,32(7):1119-21.
