不同方法接种构建的SCID小鼠HL-60白血病模型生物学特性分析
2014-05-18单武林章成芳马筱玲常文娇戴媛媛
单武林,章成芳,马筱玲,常文娇,戴媛媛
白血病是一类严重威胁人类健康和生命的常见疾病[1]。由于传统的化疗药物治疗一般伴有严重的毒副反应而不能达到有效的治疗作用。所以,新型抗肿瘤药物的研发依旧是目前研究的热点[2]。尽管人白血病细胞能够在体外分离并用于研究,但是仍有许多问题需要通过体内试验来验证。因此,建立一个稳定的动物模型用于新型抗白血病药物的研究具有重要意义[3]。自从1983年美国学者Bosma发现SCID小鼠以来,人们便将这类小鼠广泛用于白血病的研究。大量的研究[4-6]表明人白血病细胞可在这类小鼠体内广泛生长并扩散。通常主要采用以下几种方法构建小鼠白血病模型,主要包括:皮下、腹腔和静脉注射[4,7-8]。该研究选择皮下及腹腔2种途径接种构建HL-60白血病小鼠模型,并进一步比较两种模型的生物学特性。
1 材料与方法
1.1 材料
1.1.1 细胞株 人急性髓系白血病细胞株HL-60购于中国科学院上海细胞研究所。在细胞培养箱中常规传代,用含10%胎牛血清的RPMI-1640培养基(100 U/ml青霉素 G、100 μg/ml链霉素和 2 g/L 碳酸氢钠)培养,并置于5%CO2、37℃培养箱培养。
1.1.2 实验动物 SCID小鼠,雄性,清洁级,体重17~20 g,3~4周龄(购于北京华阜康公司),饲养于安徽医科大学清洁级实验动物房带盖鼠盒中(符合SPF标准)。室内空气经有效过滤。饮用水酸化处理pH 4~5。标准颗粒饲料,垫料及一切与鼠接触物品均灭菌处理。
1.1.3 主要试剂 小鼠抗人CD33单抗购于美国BIOSS公司;红细胞裂解液购于加拿大Stem Cell Technologies公司;抗人CD33-PE标记和阴性对照羊抗小鼠IgG-PE标记购于美国BD公司。
1.2 方法
1.2.1 急性髓系白血病SCID小鼠模型的建立SCID小鼠于移植前连续2 d腹腔注射环磷酰胺(CTX,100 mg/kg体重)。第2次注射CTX 24 h以后,将小鼠随机分为A、B和C 3组,每组8只。取对数生长期HL-60细胞,分别以右侧腹部皮下单点注射(A组)1×107/鼠,腹腔注射(B组)1×107/鼠接种于小鼠。C组小鼠不做处理作正常对照。如果小鼠出现以下症状将其处死,包括:下肢瘫痪;体重下降>20%;小鼠缩成一团;垂死的状态。
1.2.2 外周血白细胞及分类计数 接种细胞后,每周取尾静脉血检测。采用人工法计数外周血白细胞数。
1.2.3 病理和免疫组织化学检查 濒死动物进行病理检查,取肝和脾,以10%甲醛固定48 h以上,常规石蜡切片,HE染色后镜检。免疫组化检测:石蜡切片经脱蜡、脱水,抗原热修复后,加小鼠抗人CD33单抗,生物素标山羊抗小鼠IgG,辣根过氧化物酶标记链霉卵白素。
1.2.4 流式细胞分析仪检测CD33阳性率 CD33为一跨膜糖蛋白,在HL-60细胞上,CD33表达阳性率可达99%。CD33阳性率可作为模型肿瘤浸润的重要指标。取濒死小鼠外周血,红细胞裂解液去除外周血中的红细胞,制备细胞悬液备用。另取肝脾组织,制备组织单细胞悬液备用。将处理完毕的单细胞悬液加抗人CD33-PE,阴性对照羊抗小鼠IgGPE标记,4℃避光染色30 min,再经PBS洗2次,上流式细胞仪(FAcscan,美国BD)。Cell quest软件分析。
1.3 统计学处理 采用SPSS 16.0和Photoshop软件进行统计分析。数据以±s表示,组间比较采用单因素方差分析,两组生存分析采用t检验。
2 结果
2.1 HL-60白血病SCID小鼠模型 两种接种方法都能够成功构建小鼠白血病模型。在A组,所有小鼠在16 d内形成了肉眼可见的皮下肿瘤,平均成瘤时间为(12.15±3.26)d;所有小鼠在66 d内死亡,平均生存时间为(53.24±10.33)d。在B组,6只小鼠在25 d内形成了肉眼可见的腹腔肿瘤,平均成瘤时间为(19.00±5.84)d;这6只小鼠在53 d内全部死亡,平均生存时间为(36.87±10.22)d。见图1。另外2只没有形成腹腔肿瘤的小鼠没有死亡。形态学检测发现B组小鼠肝脾肿大较A组小鼠明显。另外,B组小鼠腹腔形成腹水,而A组没有腹水形成。
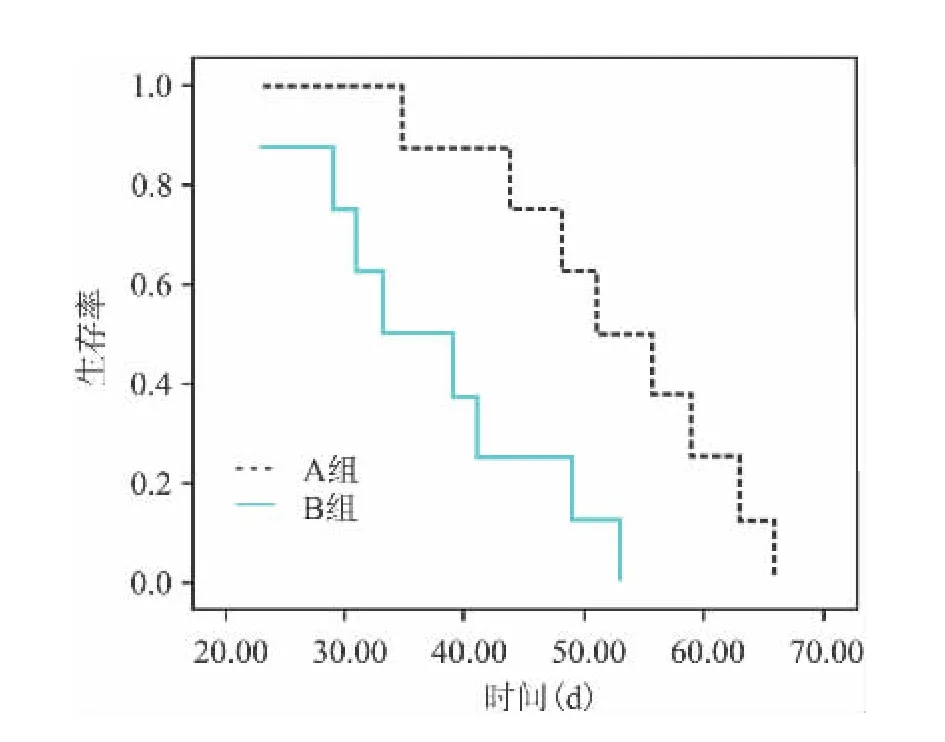
图1 两组小鼠的生存曲线
2.2 小鼠外周血和脏器中肿瘤浸润情况 接种细胞后,每周取尾静脉血检测外周血白细胞数。在同一时间,A、B两组小鼠外周血白细胞数高于C组,且B组小鼠白细胞数升高比A组快。从第4周开始,B组小鼠外周血白细胞数较A、C两组明显升高,差异有统计学意义(F=7.53,P <0.05),见表1。流式检测结果显示两组小鼠外周血均有白血病细胞浸润,但是比例较低,不超过3%。A、B两组小鼠外周血中白血病细胞平均比例分别为(1.72±1.07)%和(2.65±1.36)%,见图4。HE和免疫组织化学用于检测肝脾肿瘤浸润情况。B组小鼠脏器浸润比A组严重。B组小鼠的肝脾都有大量白血病细胞浸润并伴随着结构的严重破坏。在A组中,脾有白血病细胞并伴随着结构的破坏,然而肝脏很少能检测到白血病细胞浸润且几乎检测不到结构的破坏,见图2、3。另外,采用流式检测肝脾单细胞悬液中CD33阳性的白血病细胞比例。A组小鼠肝、脾白血病细胞比例为(1.83±1.15)%和(8.54±3.79)%,B组小鼠肝、脾白血病细胞比例为(6.93±3.15)%和(12.16±4.63)%,见图4。流式结果进一步证明了B组小鼠脏器浸润破坏较A组明显。
3 讨论
白血病是一类造血干细胞异常的克隆性恶性疾病,克隆中的白血病细胞失去进一步分化成熟能力而停滞在细胞发育的不同阶段[9]。近年来,尽管在白血病治疗方面有了很大进步,但治疗效果及预后并不理想[10]。探索新的、更加经济、有效的靶向治疗方法是临床医学的迫切需要。新型治疗药物需要在动物模型中验证其生物学效应。因此,需要建立稳定的动物模型用于新型药物抗白血病研究。
本研究显示,两种接种方法均可成功构建HL-60小鼠白血病模型。皮下接种出现肉眼可见的瘤体时间早于腹腔接种。A组成瘤率为100%,B组成瘤率为75%。以下几个因素影响人白血病细胞成功移植于小鼠体内。首先,移植成功率与人白血病细胞的生物学特性和细胞FAB类型有关。用从小鼠腹水中取出的白血病细胞接种有较高的移植成功率。因为腹水中的白血病细胞已经适应了小鼠的体内环境,易于其生长扩散。M2和M3移植成功率比其他细胞类型低。Rombouts et al[11]研究发现M0比M2、M4以及M5移植成功率高。其次,移植成功率与SCID小鼠的特性有关。SCID小鼠虽然有严重的联合免疫缺陷,但体内仍有着自然杀伤细胞(NK)细胞、粒细胞以及单核细胞的活性。随着细胞周期的延长,其他的免疫活性也会重建[12]。研究[13]显示对于>5周龄的小鼠,必须经过预处理来克服或突破剩余的免疫防御系统来提高移植成功率。给予SCID小鼠额外的生长刺激,包括IL-3、IL-6和粒细胞巨噬细胞集落刺激因子等,能提高白血病细胞的移植成功率。采取适当的方法去除SCID小鼠体内的NK细胞也能够提高移植成功率。另外,白血病细胞移植成功率与患者预后有关。研究[14]表明预后较差患者的白血病细胞具有较高的移植成功率。
表13 组小鼠外周血中白细胞数(×109/L,±s)

表13 组小鼠外周血中白细胞数(×109/L,±s)
与A组比较:*P<0.05;与C组比较:△P<0.05;在第7、8周B组小鼠已经死亡
?

图2 各组小鼠肝脏HE和免疫组化染色结果 ×400

图3 各组小鼠脾HE和免疫组化染色结果 ×400
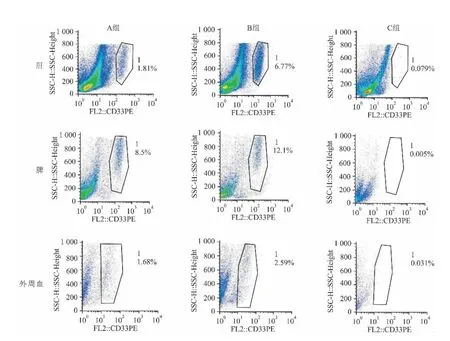
图4 各组小鼠外周血、肝和脾细胞悬液中白血病细胞比例
在存活时间方面,腹腔接种组小鼠存活时间较皮下注射组短。两种接种途径均可引起小鼠外周血白细胞升高,腹腔接种组外周血白细胞数上升速度较皮下接种组快。从接种后第4周开始,两组之间白细胞数目差异有统计学意义。这也能解释为什么腹腔接种组小鼠生存时间比皮下接种组短。两组小鼠外周血中都检测到白血病细胞,但是白血病细胞的比率较低,不超过3%,这与 Lord et al[15]研究结果一致。另外,本研究结果显示腹腔接种组小鼠脏器浸润较为严重。
总之,经皮下、腹腔两种途径接种HL-60细胞均可成功构建小鼠白血病模型。皮下注射成瘤时间短,存活时间长,可见明显的瘤结节;皮下接种肿瘤细胞具有操作简单、重复性好和易于观察等优点,因而可通过观察和测量皮下肿瘤的体积大小和重量,分析药物抗白血病疗效。腹腔注射成瘤时间长,存活时间短;利用腹腔接种的方法,可更好的了解白血病细胞在脏器中的浸润和转移情况。当然,如果希望充分的了解一种药物的疗效,最好同时采用两种小鼠模型来检测其抗白血病作用。
[1]Gjertsen B T,Wiig H.Investigation of therapy resistance mechanisms in myeloid leukemia by protein profiling of bone marrow extracellular fluid[J].Expert Rev Proteomics,2012,9(6):595 -8.
[2]Pui C H,Jeha S.New therapeutic strategies for the treatment of acute lymphoblastic leukaemia[J].Nat Rev Drug Discov,2007,6(2):149-65.
[3]Fortier J M,Graubert T A.Murine models of human acute myeloid leukemia.In Acute Myelogenous Leukemia[J].Springer,2010,145:183-96.
[4]Zhang S,Zhang Y,Zhuang Y,et al.Matrine induces apoptosis in human acute myeloid leukemia cells via the mitochondrial pathway and akt inactivation[J].PLoS One,2012,7(10):e46853.
[5]Tan K B,Ling L U,Bunte R M,et al.In vivo efficacy of a novel liposomal formulation of safingol in the treatment of acute myeloid leukemia[J].J Controll Release,2012,160(2):290 - 8.
[6]Banerjee S,Choi M,Aboukameel A,et al.Preclinical studies of apogossypolone,a novel pan inhibitor of bcl-2 and mcl-1,synergistically potentiates cytotoxic effect of gemcitabine in pancreatic cancer cells[J].Pancreas,2010,39(3):323 -31.
[7]Liu J,Li Y,Tang L,et al.Treatment of lycorine on SCID mice model with human APL cells[J].Biomed Pharmacother,2007,61(4):229-34.
[8]Ferretti E,Di Carlo E,Cocco C,et al.Direct inhibition of human acute myeloid leukemia cell growth by IL-12[J].Immunol Lett,2010,133(2):99-105.
[9]Uesato N,Fukui K,Maruhashi,et al.JTE-607,a multiple cytokine production inhibitor,ameliorates disease in a SCID mouse xenograft acute myeloid leukemia model[J].Exp Hematol,2006,34(10):1385-92.
[10]Han L,Zhou J,Schuringa J,et al.Treatment strategies in acute myeloid leukemia[J].Chin Med J,2011,124(9):1409 -21.
[11]Rombouts W,Martens A,Ploemacher R.Identification of variables determining the engraftment potential of human acute myeloid leukemia in the immunodeficient NOD/SCID human chimera model[J].Leukemia,2000,14(5):889 -97.
[12]Mc Cormack E,Bruserud O,Gjertsen B.Animal models of acute myelogenous leukaemia-development,application and future Perspectives[J].Leukemia,2005,19(5):687 - 706.
[13]Deng Y J,Xu Y Z,Lou S F.Establishment and evaluation of a murine model of AML[J].Progress Modern Biomed,2008,8(1):53-5.
[14]Yan Y,Wieman E A,Guan X,et al.Autonomous growth potential of leukemia blast cells is associated with poor prognosis in human acute leukemias[J].J Hematol Oncol,2009,2:51.
[15]Lord C D,Clutterbuck R,Powles R,et al.Growth of primary human acute lymphoblastic and myeloblastic leukemia in SCID mice[J].Leuk Lymphoma,1994,16(1-2):157-65.
