非创伤性股骨头坏死组织中Ezrin表达的相关性研究
2014-05-18罗正亮尚希福
罗正亮,李 旭,尚希福
非创伤性股骨头坏死主要发生于30~50岁的成年人,其男女发病率比约为2.4∶1,是一种慢性的、致残性的疾病,并最终导致关节塌陷、继发性关节炎,常需要采用全髋关节置换术治疗[1]。目前公认的发病因素主要包括:激素、酒精以及某些特发性因素[2],然而对于其发病机制现主要集中在血管内皮细胞活性、骨髓间质干细胞分化能力方面的研究[3-4]。Ezrin 蛋白是 ERM(ezrin/radixin/moesin)蛋白家族成员之一,是膜细胞骨架连接蛋白,其分子长度为585个氨基酸,相对分子质量约为81 ku[5]。目前研究[6-7]表明Ezrin蛋白在维持细胞极性、细胞活性、信号传导以及增殖、分化和凋亡以及血管生成等方面发挥重要的调控作用。尚未有相关文献报道在非创伤性股骨头坏死中Ezrin是否有特异性改变,该研究旨在初步探讨非创伤性股骨头坏死局部组织中Ezrin表达的变化及其临床意义,为非创伤性股骨头坏死的分子调控机制研究提供实验依据。
1 材料与方法
1.1 病例资料 收集2011年10月~2012年12月在安徽医科大学附属省立医院骨科行全髋关节置换术切取的股骨头标本54例。结合影像学、临床症状诊断明确的非创伤性股骨头坏死38例作为实验组,其中男24例,女14例,年龄29~67岁,平均51岁;按Ficat分期分为Ⅲ期11例,Ⅳ期27例;服用激素者20例,酗酒者11例,原因不明者7例。诊断明确的新鲜股骨颈骨折16例作为对照组,并排除心血管及免疫系统疾患,无服用激素史以及烟酒嗜好患者。股骨头经冠状面对半切开后,于坏死区与健存区之间的移行区取材,一部分置于含RNA保存液的冻存管中,然后迅速转入-80℃冰箱中冻存备用,另外一部分经4%中性福尔马林溶液固定,13%乙二酸四乙酸二钠脱钙后做成石蜡块备用。两组患者的一般临床特征对比差异无统计学意义。
1.2 主要试剂 鼠抗人Ezrin单克隆抗体(美国Sigma公司);山羊抗鼠IgG-HRP、SP免疫组化试剂盒、DAB染色试剂盒(北京中山金桥生物科技有限公司);逆转录-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)试剂盒(日本TaKaRa公司)。Ezrin(431 bp)引物序列:上游5'-CCC TCC AGT TCA AGT TCC-3',下游 5'-AAG CCA AAG GTC TGT TCC-3';β-actin(252 bp)引物序列:上游5'-ATG GAT GAT GAT ATC GCC GCG CTC-3',下游5'-TTT CTC CAT GTC GTC CCA GTT GG-3'。引物序列均由上海生物工程公司代为设计与合成。
1.3 实验方法 采用免疫组化SP法:将石蜡块制成5 μm厚切片,经65℃ 烤30 min后,二甲苯脱蜡水化,柠檬酸高温修复抗原,加入鼠抗人Ezrin单克隆抗体(1∶150)工作液,4℃孵育过夜;通用型二抗室温孵育15 min,DAB显色;随后苏木精复染,酒精梯度脱水、中性树胶封片。用PBS代替一抗作为阴性对照。RT-PCR操作如下:取50 mg待测组织,参照TRIzol说明书提取组织RNA,取2 μg RNA进行逆转录(RT)及PCR反应。PCR反应扩增条件:95℃预变性5 min;95℃ 30 s、56℃ 45 s、72℃ 60 s,共32个循环;最后于72℃ 延伸10 min。目的基因条带灰度值与管家基因(β-actin)灰度值的比值用于统计学分析,实验重复3次。
1.4 结果判定 免疫组化结果的按照评分等级由两位病理科医师分别观察读片判定。根据染色强度和阳性细胞比例分别评分,两者评分乘积≥4分确定为阳性[8]。染色强度:按切片中细胞染色的深浅,无着色或基本不着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分。阳性细胞比例:每例随机观察3个高倍镜(×400)视野,每个视野计数100个细胞,计算300个细胞中阳性细胞所占百分比,阳性细胞比例 <10%为0分;10% ~25% 为1分;26% ~50% 为2分;51% ~75%为3分;>75%为4分。
1.5 统计学处理 采用SPSS 13.0统计软件进行分析,计量资料以±s表示。两组间比较采用t检验,率的比较采用χ2检验或Fisher精确概率法进行检验分析。检验水准为α=0.05,双侧。
2 结果
2.1 Ezrin蛋白在不同组织中的表达情况 免疫组化结果显示,Ezrin阳性表达呈黄色或棕黄色,定位于细胞质。其中Ezrin蛋白在实验组中阳性表达12例,对照组中阳性表达10例,实验组阳性率(12/38)明显低于对照组(10/16),两组之间差异有统计学意义(χ2=4.459,P <0.05)。见图1。

图1 Ezrin蛋白在不同组织中的表达 IHC×400 A:实验组;B:对照组
2.2 Ezrin mRNA在不同组织中的表达差异 RTPCR结果分析显示Ezrin mRNA非创伤性股骨头坏死组织中的表达水平为0.65±0.17,而股骨颈骨折组织的表达水平为1.58±0.21,结果显示Ezrin基因在非创伤性股骨头坏死组织中的表达水平明显低于骨颈骨折组织,差异有统计学意义(t=17.105,P<0.01),见图2。
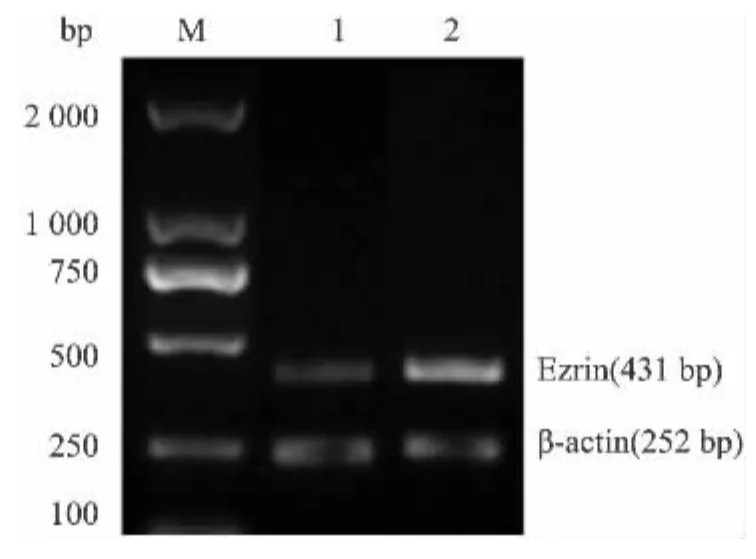
图2 RT-PCR检测Ezrin mRNA在不同组织中的表达
2.3 Ezrin蛋白的表达与临床特征间的关系 Ezrin蛋白在非创伤性股骨头坏死组织中的表达水平与患者性别、年龄、体重指数(BMI)、职业及病因无明显相关性,但与疾病分期有关(P<0.05),见表1。
3 讨论
由于骨坏死目前没有特效的指标药物,只能延缓病情,而骨坏死患者发病率较高并呈逐年上升趋势,并且其发病机制仍存在争议。目前提出的假说包括:血管内凝血、脂肪代谢紊乱、骨髓内压力升高、细胞凋亡、骨质疏松学说等[9]。这些假说虽然侧重点各不相同,但主要研究均集中于血管内皮细胞活性及骨髓间质干细胞分化能力,并已证实,在骨坏死部位,血管内皮细胞活性降低、凋亡增加、骨髓干细胞分化能力降低紊乱,造成骨坏死的修复机制受损[3-4],最终引起股骨头坏死改变。

表1 实验组中Ezrin的表达与临床特征之间的关系
Ezrin首先于1981年在鸡的肠上皮绒毛中被发现,其编码基因位于染色体6q25-q26[10]。现已证实Ezrin蛋白以非活化和活化两种状态存在,并且在新血管生成、内皮细胞通透性、细胞凋亡、分化、增殖以及肿瘤转移的过程均发挥着重要生物活性作用。Youn et al[11]报道在钙蛋白酶介导的内皮细胞血管生成机制中,Ezrin、PI3K、Akt、5'-AMP 激活性蛋白激酶这一系列的信号级联反应调节血管内皮生长因子(VEGF)诱导内皮细胞氮氧化物合酶生成eNOS,从而最终发挥血管生成作用。另外,Kishore et al[12]报道肿瘤坏死因子α(TNF-α)可通过Rho激酶诱导Ezrin活化,活化的Ezrin蛋白进入细胞核与细胞周期素A(cyclin A)的启动子结合,从而调节微血管内皮细胞的增殖、血管生成以及渗透性。在细胞凋亡方面,Kuo et al[13]采用基因敲除技术使 Ezrin 表达缺失,导致T淋巴细胞和H9细胞凋亡增加,认为Ezrin能负性调节死亡诱导信号复合体(death-inducing signal complex,DISC)诱导的细胞凋亡。Ezrin是一种细胞骨架蛋白与细胞膜之间的连接蛋白,使细胞感受细胞内外的应力调节,从而改变干细胞的分化调节;Titushkin et al[7,14]通过 RNAi敲除骨髓间质干细胞的ERM基因后不仅导致了干细胞的应力调节发生变化而且发现直接损伤了干细胞的成骨、成脂分化能力。另外,Huang et al[15]发现在类风湿性关节炎的滑膜组织中,ERM蛋白家族的磷酸化水平增高,使成纤维样滑膜细胞增殖能力增强,并指出抑制ERM蛋白家族磷酸化可能成为类风湿性关节炎的一个新治疗靶点。本研究显示,Ezrin蛋白水平和Ezrin mRNA水平在实验组的表达量均较对照组明显降低,并且Ezrin蛋白阳性表达水平与性别、年龄、BMI、职业及病因无关,但与疾病分期有关。因此,笔者认为Ezrin在非创伤性股骨头坏死中表达可能产生了变化,造成新生血管减少、内皮细胞凋亡增加以及骨髓基质干细胞分化能力降低紊乱,并可能参与非创伤性股骨头坏死的发生发展。
[1]Jones L C,Hungerford D S.The pathogenesis of osteonecrosis[J].Instr Course Lect,2007,56:179 -96.
[2]Malizos K N,Karantanas A H,Varitimidis S E,et al.Osteonecrosis of the femoral head:etiology,imaging and treatment[J].Eur J Radiol,2007,63(1):16 -28.
[3]Séguin C,Kassis J,Busque L,et al.Non-traumatic necrosis of bone(osteonecrosis)is associated with endothelial cell activation but not thrombophilia[J].Rheumatology(Oxford),2008,47(8):1151-5.
[4]Lee J S,Lee J S,Roh H L,et al.Alterations in the differentiation ability of mesenchymal stem cells in patients with nontraumatic osteonecrosis of the femoral head:comparative analysis according to the risk factor[J].J Orthop Res,2006,24(4):604 - 9.
[5]Bretscher A,Edwards K,Fehon R G.ERM proteins and merlin:integrators at the cell cortex[J].Nat Rev Mol Cell Biol,2002,3(8):586-99.
[6]Fais S,De Milito A,Lozupone F.The role of FAS to ezrin association in FAS-mediated apoptosis[J].Apoptosis,2005,10(5):941-7.
[7]Titushkin I,Cho M.Altered osteogenic commitment of human mesenchymal stem cells by ERM protein-dependent modulation of cellular biomechanics[J].J Biomech,2011,44(15):2692 -8.
[8]葛腾飞,朱克超,于在诚,等.Caveolin-1在食管鳞癌中的表达及其临床意义[J].安徽医科大学学报,2012,47(5):544-7.
[9]Assouline-Dayan Y,Chang C,Greenspan A,et al.Pathogenesis and natural history of osteonecrosis[J].Semin Arthritis Rheum,2002,32(2):94-124.
[10]Rasmussen M,Alexander R T,Darborg B V,et al.Osmotic cell shrinkage activates ezrin/radixin/moesin(ERM)proteins:activation mechanisms and physiological implications[J].Am J Physiol Cell Physiol,2008,294(1):C197 -212.
[11]Youn J Y,Wang T,Cai H.An ezrin/calpain/PI3K/AMPK/eNOSs1179 signaling cascade mediating VEGF-dependent endothelial nitric oxide production[J].Circ Res,2009,104(1):50-9.
[12]Kishore R,Qin G,Luedemann C,et al.The cytoskeletal protein ezrin regulates EC proliferation and angiogenesis via TNF-α-induced transcriptional repression of cyclin A[J].J Clin Invest,2005,115(7):1785-96.
[13]Kuo W C,Yang K T,Hsieh S L,et al.Ezrin is a negative regulator of death receptor-induced apoptosis[J].Oncogene,2010,29(9):1374-83.
[14]Titushkin I,Sun S,Paul A,et al.Control of adipogenesis by ezrin,radixin and moesin-dependent biomechanics remodeling[J].J Biomech,2013,46(3):521 -6.
[15]Huang H,Xiao Y,Lin H,et al.Increased phosphorylation of ezrin/radixin/moesin proteins contributes to proliferation of rheumatoid fibroblast-like synoviocytes[J].Rheumatology(Oxford),2011,50(6):1045-53.
